1. Documentation Level: Ende des Level of Concern
Am 14.06.2023 hat die FDA das Guidance-Dokument Content of Premarket Submissions for Device Software Functions final freigegeben. Dieses Dokument löst das Guidance-Dokument ab, welches den Level of Concern einführte und unterscheidet nur noch zwei Klassen.
a) Bestimmung der Klassen
Die FDA definiert nicht mehr drei „Level of Concern“, sondern zwei „Dokumentationsklassen“:
- Basic Documentation
- Enhanced Documentation
Eine Software verlangt eine „Enhanced Documentation“, wenn mindestens eine der folgenden Bedingungen erfüllt ist:
Das Produkt, das die Software enthält oder die Software ist,
- ein Kombinationsprodukt,
- dient dem Einsatz in der Transfusionsmedizin bzw. Organspende (Bestimmung von Organspendern und Empfängern),
- fällt in die Klasse III oder
- kann im Fall eines Fehlers zum Tod oder zu einer schweren Verletzung („serious injury“) führen.
Beim vierten Punkt bezieht sich die FDA auf vernünftigerweise vorhersehbare Risiken. Die Einschätzung erfolgt vor Risikomaßnahmen.
b) Konsequenz der Klassifizierung
Die Klassifizierung wirkt sich auf den Umfang der einzureichenden (Software-)Dokumentation aus:
| Element der Software-Dokumentation | Basic Documentation | Enhanced Documentation |
| Bestimmung der Dokumentationsklasse | x | x |
| Beschreibung der Software | x | x |
| System- und Software-Architektur | x | x |
| Risikomanagement | x | x |
| Software Requirements Specification (Software-Anforderungen) | x | x |
| Software Design Specification | — | x |
| Dokumentation der Software-Entwicklung und -Wartung | x | x (erweitert) |
| Software-Testing | x (ohne Details der Unit- und Integrationstest) | x |
| Versionshistorie | x | x |
| Liste und Bewertung der Anomalien | x | x |
Die Anforderungen erinnern sehr an die bisherigen Level moderate und major. D. h., dass Hersteller keine Software-Dokumentation einreichen können, die nur den sehr laxen Anforderungen des minor level of concern entspricht.
Anders als noch bei den Level of Concern wird OTS nicht mehr selbstständig klassifiziert sondern erbt den Documentation Level der Gesamtsoftware.
Sie als Hersteller sollten diesen Off-the-Shelf Software Guidance der FDA kennen und beachten.
Lesen Sie hier mehr zu Gemeinsamkeiten und Unterschieden zwischen OTS und SOUP.
c) Bewertung
Die FDA nimmt starken Bezug auf die IEC 62304. Ein Vorgehen gemäß Klasse A erlaubt sie aber spätestens mit der neuen Version des Guidance-Dokuments nicht mehr. Zudem sollten sich Hersteller bewusst sein, dass die Menge der einzureichenden Dokumentation unabhängig ist von der Menge der zu erstellenden Dokumentation.
Das Johner Institut empfiehlt Herstellern daher grundlegend, konform den Anforderungen der Sicherheitsklasse C zu arbeiten und zu dokumentieren.
2. Wie es vorher war: Definition und Bestimmung des Level of Concern
In ihrem vorherigen Guidance Dokument Content of Premarket Submissions for Software Contained in Medical Devices definierte die FDA drei Level of Concern zur Klassifizierung von Software:
- Minor: We believe the level of concern is Minor if failures or latent design flaws are unlikely to cause any injury to the patient or operator.
- Moderate: We believe the level of concern is Moderate if a failure or latent design flaw could directly result in minor injury to the patient or operator […].
- Major: We believe the level of concern is Major if a failure or latent flaw could directly result in death or serious injury to the patient or operator […]
Die FDA nannte in ihrem Guidance Document nicht nur diese drei Klassen, sondern gab auch Hilfestellung, um den Level of Concern zu bestimmen.
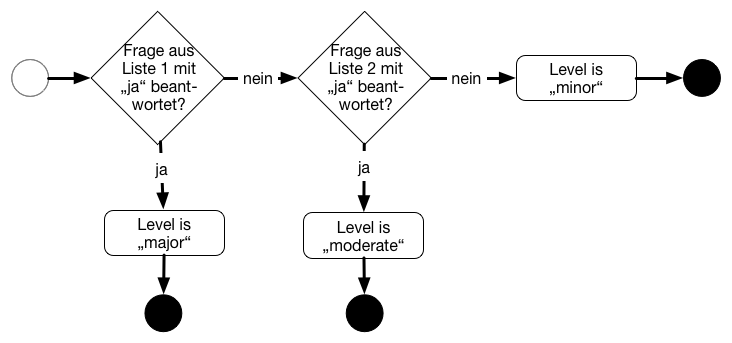
Dazu hatte die FDA einen Entscheidungsbaum definiert und zwei Listen mit Fragen. Die erste Liste enthielt u. a. die folgenden Fragen:
- Ist die Software ein Zubehör zu einem Medizinprodukt, das einen „Major Level of Concern“ hat?
- Kann ein Softwarefehler (vor Risikokontrollmaßnahmen!) zu einem Tod oder zu einer schweren Verletzung führen, beispielsweise weil die Software eine Behandlung steuert oder dem Vitaldaten-Monitoring in potenziell lebensbedrohlichen Situationen dient?
Sobald man eine der Fragen mit „ja“ beantworten konnte, war der Level of Concern bestimmt.
Umfang der einzureichenden Dokumentation
Der Level of Concern steuerte die Menge der einzureichenden Unterlagen:
| Dokument | Minor Level of Concern | Moderate Level of Concern | Major Level of Concern |
|---|---|---|---|
| Software Description | ja | ja | ja |
| Gefährdungsanalyse | ja | ja | ja |
| Software Requirements | ja | ja | ja |
| Software-Architektur | nein | ja | ja |
| Software Design Specification | nein | ja | ja |
| Software Development Environment Description | nein | ja | ja |
| Verifizierung und Validierung | verkürzt | ja | ja |
| Traceability Analysis | ja | ja | ja |
Off-the-Shelf Software
Auch bei Off-the-Shelf Software (OTSS) spielte der Level of Concern eine entscheidende Rolle: Er regelte
- den Umfang der dafür notwendigen Dokumentation (z. B. Basic Documentation, Special Documentation),
- ob und welche risikomininierenden Maßnahmen dokumentiert werden müssen,
- ob ggf. ein Audit beim Hersteller notwendig ist und
- ob diese Komponente überhaupt eingesetzt werden darf.
3. Sicherheitsklassifizierung gemäß IEC 62304 vs. Level of Concern gemäß FDA vs. documentation level
Die Level of Concern erinnern an die Sicherheitsklassifizierung von Software-Komponenten in der IEC 62304:2007:
- Klasse A: Keine Verletzung oder Schädigung der Gesundheit ist möglich
- Klasse B: Keine schwere Verletzung ist möglich
- Klasse C: Tod oder schwere Verletzung ist möglich
Das Basic Documentation Level ist vergleichbar mit der Software-Sicherheitsklasse B. Das Enhanced Documentation Level ist vergleichbar mit der Software-Sicherheitsklasse C.
Sind damit diese beiden Klassifizierungen äquivalent? Nein!
Die Klassifizierung der FDA legt fest, welche Unterlagen bei der Zulassung einzureichen sind. Die Klassifizierung nach IEC 62304 legt fest, welche Unterlagen zu erstellen sind.
Für die niedrigen Klassen kann man sich manches ersparen. Beim FDA-Audit müssen hingegen die Unterlagen für alle Komponenten vorliegen. Dass dies besonders bei niedrig klassifizierten Komponenten meist nicht erfolgt, ist eine andere Sache.
Lesen Sie hier mehr zu den Änderungen bei der Sicherheitsklassifizierung gemäß IEC 62304.
Wünschen Sie sich Unterstützung dabei, eine „FDA-konforme“ Software-Dokumentation zu erstellen? Professor Johner und sein Team helfen gerne! Nehmen Sie Kontakt auf!
Änderungshistorie
- 2024-01-19: Finale Guidance zum documentation level berücksichtigt



Hallo Herr Johner,
vielen Dank für den informativen Artikel. Eine Frage bezüglich des Level of Concern habe ich noch. Kann bei einem Produkt, dass aus meheren Software Systemen besteht (getrennte Hardwarekomponenten mit eigener CPU und Speicher) für jedes Softwaresystem der Level of Concern bestimmt werden und somit die einzureichende Dokumentation verringert werden?
Die IEC 62304 erlaubt ja unterschiedliche Sicherheitsklassen für verschiedene Softwaresysteme bzw. Softwareeinheiten. So ist es auch meiner Sicht möglich für verschiedene Softwaresysteme in einem Produkt unterschiedliche Sicherheitsklassen zu vergeben (ausgehend vom Schweregrad natürlich). Geht das bei dem Level of Concern auch?
Liebe Grüße,
Philipp Ott
Die FDA kennt das Konzept so nicht wirklich. Sie weiß zwar, dass ein Produkt mehrere „Softwares“ enthalten kann, spricht aber dann von „Software Components“.
Die FDA wäre verwirrt, wenn man für unterschiedliche Software-Systeme unterschiedliche LoC definiert und entsprechend einreicht.
ABER: Das ist auch gar nicht notwendig, weil die FDA sowieso den „risk-based approach“ propagiert. Insofern unterscheidet sich die Dokumentation nicht wesentlich.
Sehr geehrter Herr Johner,
sie schreiben in
https://www.johner-institute.com/articles/software-iec-62304/safety-classes-level-of-concern/:
„If you market your products in the US the software safety class is irrelevant. You have to document according to class C anyhow. … “
Ich wüsste gerne ob es für diese Behauptung einen weiteren Beleg von Seite der FDA gibt welcher das Vorhandensein der vollständigen Dokumentation beim Audit verlangt. Für Software die laut 62304 in die Klasse A bzw. nach der FDA Guidance Minor Level of Concern ist fällt es sonst schwer für eine vollständige Dokumentation zu argumentieren. Vor allem wenn in der Guidance dann noch steht:
„We believe the documents that we recommend submitting will generally be the same documents that you would normally generate during the development of a Software Device.“
Dass eine vollständige Dokumentation von Vorteil für den Hersteller ist und eine gute Kontrolle des Designs und der Verifikation erlaubt steht natürlich außer Frage.
Vielen Dank!
Sehr geehrter Herr Prueckl,
die FDA definiert den Level of Concern in einem Guidance Document, das den „Content of Premarket Submissions“ regelt. Es geht hier nicht um den Aufbau der SW-Dokumentation. Vielmehr fordert die FDA für SW unabhängig von dem Level of Concern die Design Controls einzuhalten.
Daher müssen Sie damit rechnen, dass ein Inspektor die Software-Akte sehen will um den Software-Lebenszyklus in Gänze zu beurteilen.
Ich widerspreche aber nicht, dass die meisten Inspektoren bei Minor Level Software den Fokus der Inspektion auf andere Teile lenken.
Sehr geehrter Herr Johner,
Für eine reine stand-alone SW oder auch eine „Haupt“-SW für ein Medizinprodukt ist der LoC recht klar. Aber wenn eine (weitere) Software als zusätzliche MSicherheitsmaßnahme zu existierenden HW-Sichereheitsmaßnahmen entwickelt werden soll tue ich mich schwer mit dem Ansatz:
Die FDA schreibt: „We recommend that you determine the Level of Concern before any mitigation of relevant hazards.“ aber auch
„We recommend that you indicate the Level of Concern for your Software Device, determined before the effects of any mitigations.“
Wie verhält es sich denn, wenn eine HW schon im Design Sicherheitsmassnahmen (z.B. ein Laser HW-Sicherheitsmassnahmen nach relevanter Lasersicherheitsnorm) mitbringt und nun anschließend für diese HW eine Kontrollsoftware entwickelt werden soll als weitere Sicherheitsmaßnahme. Ist der LoC ohne die HW-Sicherheitsmaßnahmen zu betrachten („before any mitigation“) oder kann hier davon ausgegangen werden, dass es sich um die durch die HW-Sicherheitsmaßnahmen abgedeckten Risiken um keine relevanten Gefährdungen mehr handelt („mitigation of relevant hazards)?
Sehr geehrter Herr Thiemann,
danke für die spannende Frage! Die Antwort hängt – wie Sie bereits andeuten – davon ab, wann man eine Maßnahme man als risikominimierend und wann als „selbstverständlich“ klassifiziert. Dazu gibt es keine gesetzliche Regelung, aber eine wie ich finde nützliche Einschätzung eines TÜVs:
Alle Maßnahmen, die ein junger Absolvent bzw. eine junge Absolventin einer einschlägigen Fachrichtung ergreifen würde, zählt man nicht als risikominimierend, sondern als „selbstverständlich“. Alle anderen Maßnahmen sind als risikominimierend zu klassifizieren, auch wenn sie für die Firma selbstverständlich sein mögen.
Wenn eine Firma einen Laser nur so schwach wie notwendig einbaut, dürfte das selbstverständlich sein. Hingegen wäre eine Kontrollsoftware, die Teil einer Überwachungskomponenten ist, eine risikominimierende Maßnahme darstellen. Für diese Kontrollsoftware (und natürlich auch für die kontrollierte Software) wäre somit der LoC zu bestimmen.
In der Hoffnung, mit dieser Faustformel etwas geholfen zu haben, und mit den allerbeste Grüßen, Christian Johner
Dear Mr. Johner,
I’m wondering what is the impact to OTS software? (I understand that the FDA is planning to review the OTS Guideline after finalising this Guidance Document). Does it means that OTS/SOUP that has minor LOC should have the basic documentation? If this is the case, it will be a lot of work!
Dear Chia,
unfortunately we don’t know FDAs plans related to the revision of the OTS guidance. However, since the level of concern was removed in the draft software guidance, it will most probably be removed from the OTS guidance, too. Anyhow, also under the current OTS guidance, you always need a basic documentation, even for a minor level of concern OTS software.
Best regards
Luca Salvatore
Dear Luca,
Thank you for your response! You’re right about the basic documentation requirement for minor LoC, except for the following:
– system software architecture
– documentation of software development and maintenance
If these are to be added for minor LoC OTS, it will be a lot of work. Let’s wait for FDA announcement.
Have a good day!
Das in Kapitel 4 vorgestellte Guidancedokument ist immernoch ein Draft und die Submission fordert auch immernoch die Bestimmung des Level of concern.
Macht es Sinn sich schon auf das Guidancedokument zu verlassen? Gerade der Wegfall der Software design specification wäre ja eine enorme Entlastung.
Vielen Dank!
Sehr geehrte Frau Berndt,
das Guidance ist in der Tat noch im draft, d.h. noch nicht anwendbar. Die FDA wird also bis auf Weiteres nach der alten und aktuell gültigen Version von 2005 vorgehen.
Freundliche Grüße
Luca Salvatore
Sehr geehrtes Johner Team,
können Sie mir in diesem Zusammenhang einmal helfen.
Inwieweit kann oder wäre die IMDRF Software as a Medical Device (SaMD) Dokumentation (https://www.imdrf.org/sites/default/files/docs/imdrf/final/technical/imdrf-tech-140918-samd-framework-risk-categorization-141013.pdf) sinnhaft anzuwenden auf dem Hintergrund das 62304 mit Amendment 2015 SaMD in Punkt 1.2 bereits einschließt.
Habe ich da irgendeinen Mehrwert oder reicht auch für SaMD schlicht die analoge Einstufung nach 62304 SSC? Oder gibt es da nochmal etwas komplett separates? Ich habe den Überblick evtl verloren.
Vielleicht steht das auch in der neuen 62304 dann wieder extra ausgewiesen…
Danke und mit den besten Grüßen
Sehr geehrter Herr Ranka,
die Vorgaben der IMDRF sind leider nur bedingt von Relevanz, was Inhalt und Tiefe der Software-Dokumentation betrifft. Denn weder die IEC 62304 noch die FDA-Anforderungen sind damit ausreichend harmonisiert.
An was Sie sich orientieren, hängt auch von den Märkten ab. Beispielsweise nützt es Ihnen nichts, wenn Ihnen die IEC 62304 eine niedrige SSC ermöglicht, Sie damit aber die Anforderungen der FDA nicht erfüllen.
Die IEC 62304 unterscheidet nicht zwischen SaMD und anderer Medical Device Software, die FDA bei den Anforderungen an die Dokumentation auch nicht.
Meine Faustformel wäre daher, nach Klasse C zu entwickeln (dabei es aber mit dem Detailgrad von SW-Units nicht zu übertreiben) und das Delta zu den FDA-Anforderungen zu berücksichtigen z.B. bzgl. OTS und Cybersecurity.
Beste Grüße, Christian Johner