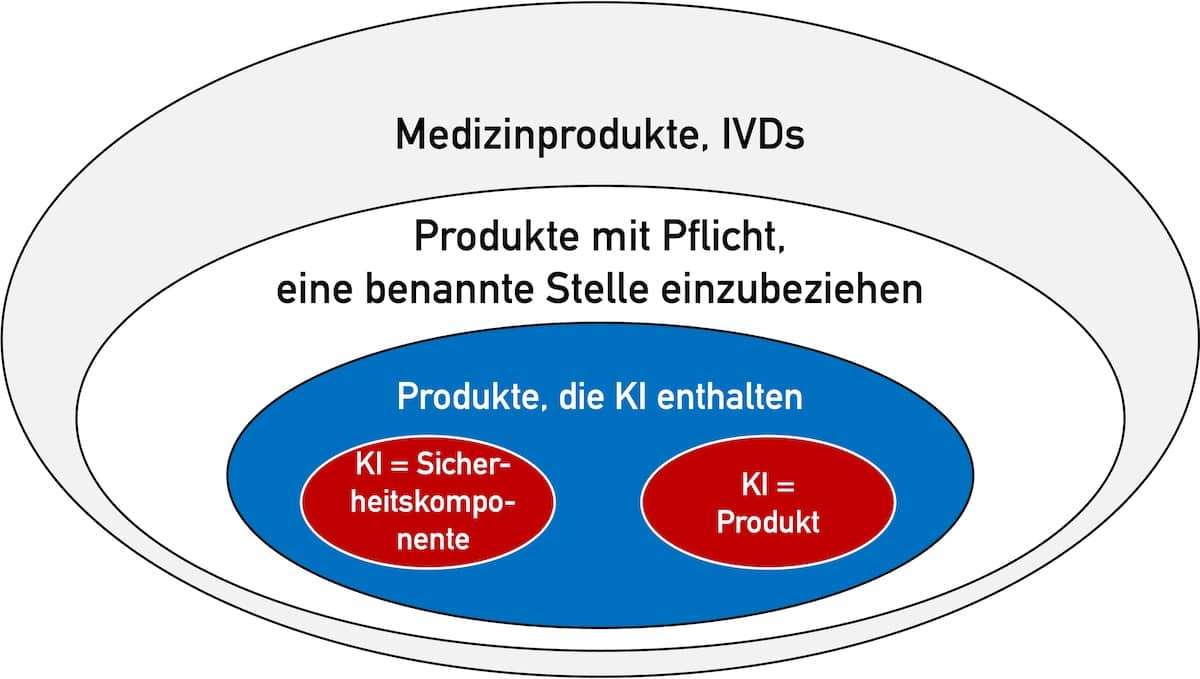
Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich sind die Artikel zum Erstellen von Prozess- und Verfahrensanweisungen sowie zum risikobasierten Ansatz bei Prozessen. Das Schreiben dieser Vorgabedokumente sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Im 21 CFR part 820 formuliert die FDA die Anforderungen an die Qualitätsmanagementsysteme u.a. von Medizinprodukteherstellern. Damit ist bzw. war der 21 CFR part 820 (Quality System Regulation QSR) das Pendant zur ISO 13485.
Müssen Medizinproduktehersteller eine KI wie ChatGPT validieren, die sie bei der Entwicklung, Produktion, Zulassung und Überwachung ihrer Produkte einsetzen? Falls ja, wie soll das gelingen mit Modellen, die nichtdeterministische Ergebnisse liefern? Antworten darauf und auf die Frage, was Ihre Auditoren erwarten (sollten), gibt dieser Fachartikel.
Details
Die EU-KI-Verordnung (EU AI Act) ist veröffentlicht. Viele Hersteller von Medizinprodukten und IVD sowie andere Akteure im Gesundheitswesen stehen vor der großen Aufgabe, den über 140 Seiten umfassenden Gesetzestext zu verstehen und die Anforderungen zu erfüllen. Beachten Sie: Verstöße gegen den AI Act werden mit Geldstrafen in Höhe von bis zu 7 % des jährlichen Umsatzes geahndet. Dieser…
Details
Eine häufige Frage an uns lautet: „Bieten Sie auch Computerized Systems Validation an?“ Einer der Gründe für das Interesse ist sicherlich, dass Behörden und Benannte Stellen das Thema CSV immer öfter zum Gegenstand von Audits machen. Lesen Sie hier, welche Regularien es zur „Computerized Systems Validation“ gibt und wie Sie deren Forderungen am elegantesten erfüllen.
Details
Unter QM-Zertifizierung bezeichnet man die Zertifizierung eines Qualitätsmanagementsystems (QM-System oder QMS) durch eine Zertifizierstelle. Die Zertifizierung bestätigt dem zertifizierten Unternehmen, dass sein QM-System einem Standard genügt, typischerweise einer Norm (z. B. ISO 9001, ISO 13485) oder einem Gesetz (z. B. MDR, IVDR).
Die Prozess-FMEA (pFMEA) ist eine Methode zur systematischen Analyse von Risiken, die sich durch Fehler in Prozessen wie der Produktion und Reinigung von Produkten ergeben. Gesetze wie die MDR und Normen wie die ISO 13485 verpflichten die Hersteller von Medizinprodukten dazu, solche Prozessrisiken zu identifizieren und zu beherrschen.
Details
Die FMEA, die Failure Mode and Effect Analysis (auf Deutsch: Fehlermöglichkeits- und -einflussanalyse), ist ein Verfahren, um zu bekannten Ursachen unbekannte Auswirkungen zu untersuchen. Bei Medizinprodukten nutzt man die FMEA beispielsweise bei der Risikoanalyse, um die Folgen einer fehlerhaften Komponente zu analysieren, insbesondere die sich daraus ergebenden Gefährdungen.
Details
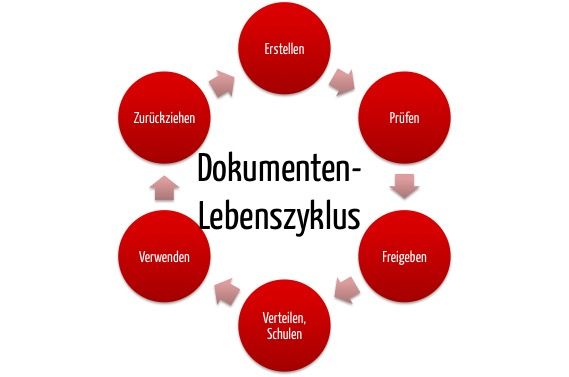
Unter Dokumentenlenkung versteht man ein dokumentiertes Verfahren, das festlegt, wie Dokumente erstellt, geprüft, genehmigt, gekennzeichnet, verteilt und aktualisiert werden. Nach ISO 9001 oder ISO 13485 zertifizierte Organisationen sind zur Dokumentenlenkung verpflichtet.
Details
Interne Audits sind Prüfungen des Qualitätsmanagement-Systems (QM-Systems) und seiner Prozesse durch die Organisation selbst. Daher werden sie auch 1st Party Audits genannt. Die ISO 13485 fordert interne Audits ebenso wie ihre „Schwesternorm“, die ISO 9001, und andere Normen und Regularien. Deshalb sind interne Audits auch Gegenstand der externen Audits und Voraussetzung für die QM-Zertifizierung. Dieser…
Details
In einer Verfahrensanweisung (VA), auch Standard Operating Procedure (SOP) oder Prozessbeschreibung genannt, legen Firmen ihre Abläufe fest, beispielsweise wie sie Produkte entwickeln oder Dienstleistungen erbringen. Die Normen wie die ISO 9001 und die ISO 13485 fordern solche Verfahrensanweisungen. Diese Vorgaben können Firmen direkt im Qualitätsmanagementhandbuch oder in eigenständigen Dokumenten festlegen.
Details