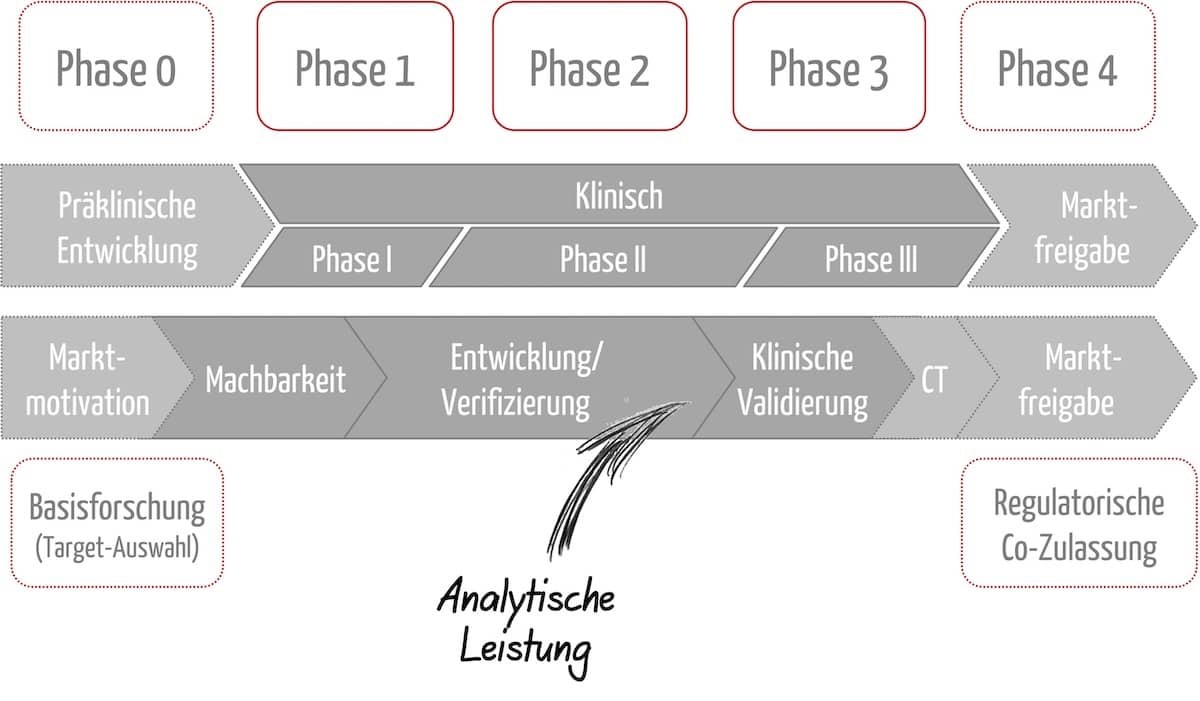
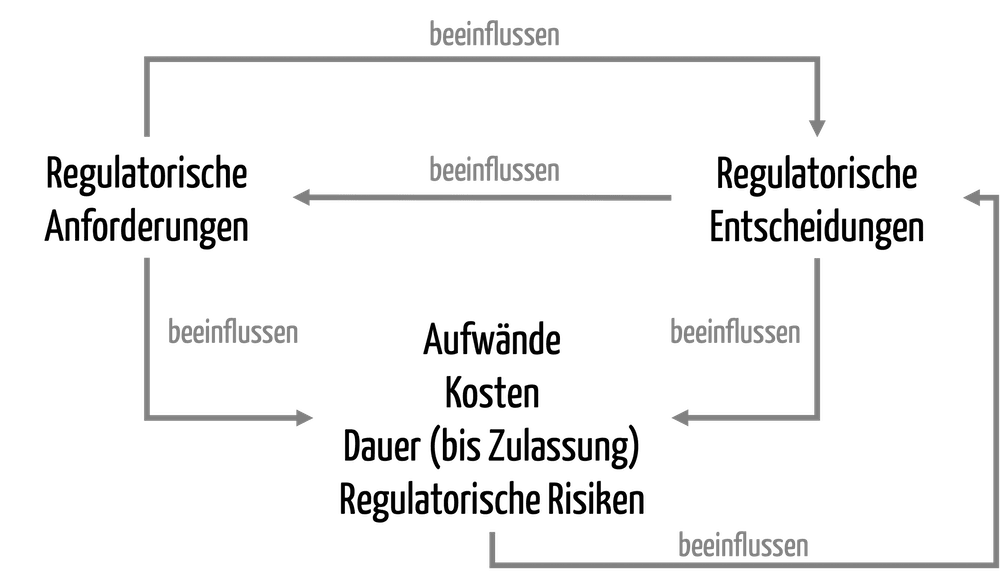
Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
e) Regulatorische Rollen
Sie finden hier Fachartikel zu mehreren regulatorischen Rollen;
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Die europäische In vitro Diagnostic Medical Device Regulation (IVDR) müssen Hersteller beachten, die in der EU In-vitro-Diagnostika in den Verkehr bringen wollen. Die Verordnung (EU) 2017/746 In vitro Diagnostic Medical Device Regulation (IVDR) regelt im europäischen Markt den gesamten Lebenszyklus von in vitro diagnostischen Medizinprodukten (IVD). Die IVDR ist zeitgleich mit der Verordnung (EU) 2017/745…
Details
Für Geräte, die WLAN oder RFID nutzen, gilt die Richtlinie 2014/53/EU (Funkanlagen-Richtlinie bzw. Radio Equipment Directive, RED). Auch Medizinprodukte, die „funken“, etwa weil sie sich mit dem Internet verbinden oder über eine Fernbedienung angesteuert werden, müssen die Konformität mit der RED nachweisen, bevor sie auf den Markt dürfen. Erfahren Sie in diesem Beitrag,
Details
Die GLP (Good Laboratory Practice) definiert Anforderungen an ein Qualitätssicherungssystem für nicht-klinische gesundheits- und umweltrelevante Sicherheitsprüfungen. Durch die GLP werden der organisatorische Ablauf und die Bedingungen festgelegt, unter denen Laboruntersuchungen geplant, durchgeführt und überwacht werden. Die Aufzeichnung und Berichterstattung der Prüfungen ist ebenfalls Gegenstand der GLP. Lesen Sie in diesem Artikel, welche Anforderungen ggf. auch…
Details
Companion Diagnostics (auch CDx oder therapiebegleitende Diagnostika) kommen gemeinsam mit einem Arzneimittel zum Einsatz. Mit ihnen können Ärztinnen und Ärzte beispielsweise sicherstellen, ob ein bestimmtes Arzneimittel für den Patienten tatsächlich geeignet ist. CDx spielen daher eine besonders große Rolle in der personalisierten Medizin. Da das therapiebegleitende Diagnostikum und das Arzneimittel untrennbar miteinander verbunden sind, gelten…
Details
Die MEDDEV 2.12-1 beschreibt die Anforderungen der EU an ein Marktüberwachungs- und Meldesystem (Vigilanz-System). Dieses Vigilanz-System ist Gegenstand von ISO-13485- bzw. Anhang-II-Zertifizierungsaudits.
Dass Gesetze und Normen die IT-Security auch bei „Legacy Devices“ einfordern, ist verständlich. Die Art, wie diese Anforderungen formuliert werden, führt allerdings oft zu Verwirrung. Beispielsweise konnten sich Gesetzgeber und Normenkomitees nicht auf gemeinsame Definitionen einigen. So geht es einmal um die IT-Sicherheit bei Legacy Devices, einmal um die IT-Sicherheit von Altprodukten bzw. von Bestandsprodukten…
Details
Die EU-Verordnungen stellen hohe Anforderungen an die sogenannte Inverkehrbringung von Medizinprodukten. Erfahren Sie in diesem Artikel, was diese Regularien unter einer Inverkehrbringung verstehen, welche Missverständnisse und Widersprüche Sie kennen müssen und welche Voraussetzung die Hersteller bzw. Produkte erfüllen müssen.
Details
Die regulatorische Strategie festzulegen, zählt zu den zentralen Aufgaben der Regulatory-Affairs-Abteilungen bei Medizinprodukteherstellern. Weshalb ist eine gute regulatorische Strategie so wichtig? Was müssen die Regulatory Affairs Experts tun? Antworten liefert dieser Artikel.
Details
Medizinprodukteberater spielen eine zentrale Rolle, um die Sicherheit von Medizinprodukten zu gewährleisten. Die Position ist dem Pharmaberater (§ 75 AMG) nachgebildet. Die EU-Verordnungen MDR und IVDR kennen dieses Konzept nicht. Doch der Medizinprodukteberater ist im nationalen Recht verankert. Deutschland und Österreich fordern die Rolle des Medizinprodukteberaters im nationalen Recht (Medizinprodukterecht-Durchführungsgesetz (MPDG) in Deutschland und Medizinproduktegesetz…
Details
Wie Sie die regulatorischen Anforderungen an die PMCF am schnellsten erfüllen Die klinische Nachbeobachtung, auf Englisch Post-Market Clinical Follow-up, beanstanden die Benannten Stellen immer häufiger. Und das, nachdem die Hersteller die Hürde davor erfolgreich gemeistert haben: die initiale klinische Bewertung. Dieser Artikel liefert Herstellern von Medizinprodukten
Details