Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
e) Regulatorische Rollen
Sie finden hier Fachartikel zu mehreren regulatorischen Rollen;
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
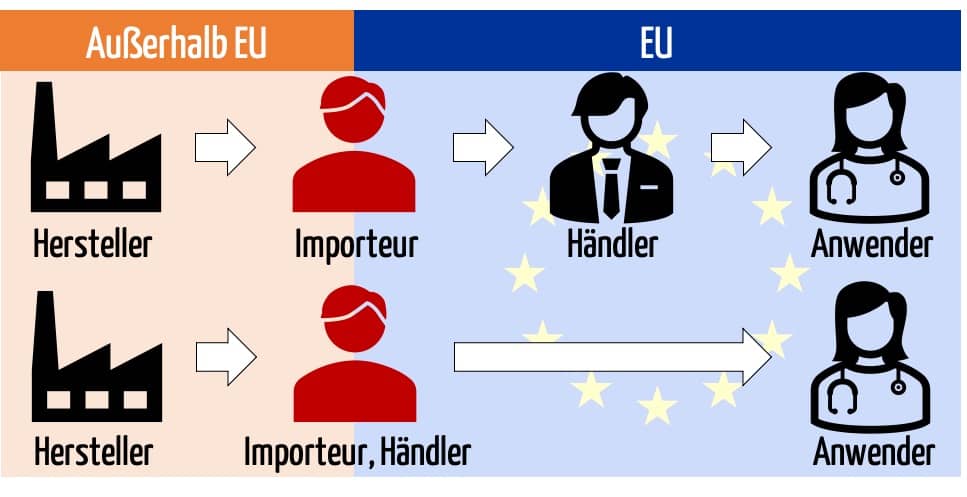
Die EU-Verordnungen MDR und IVDR stellen präzise Anforderungen an Importeure. Sie definieren auch, wer ein Importeur ist. Nicht jede Einfuhr eines Produkts in die EU stellt einen Import dar. Und andererseits haben Firmen, die Medizinprodukte importieren, nicht nur die Anforderungen an Importeure zu erfüllen.
Details
Die Medizinprodukteverordnung hat die Anforderungen an die Händler deutlich erhöht. Lernen Sie diese Anforderungen zu verstehen, um die mehrjährigen Freiheitsstrafen zu vermeiden, die bei einem Verstoß drohen. Dieser Beitrag berücksichtigt auch eine umfangreiche Leitlinie der irischen Aufsichtsbehörde.
Details
Die Begriffe Wartung, Instandhaltung, Instandsetzung, Inspektion, Service und sicherheitstechnische Kontrolle sind nicht synonym. Aber alle bezeichnen Aktivitäten im Lebenszyklus von Medizinprodukten, die dem Ziel dienen, die Sicherheit, Leistungsfähigkeit und Wirksamkeit dieser Produkte auch nach der Inverkehrbringung zu gewährleisten. Hersteller und Betreiber müssen die regulatorischen Anforderungen an die Wartung bzw. Instandhaltung erfüllen. Diese Vorgaben sind oft…
Details
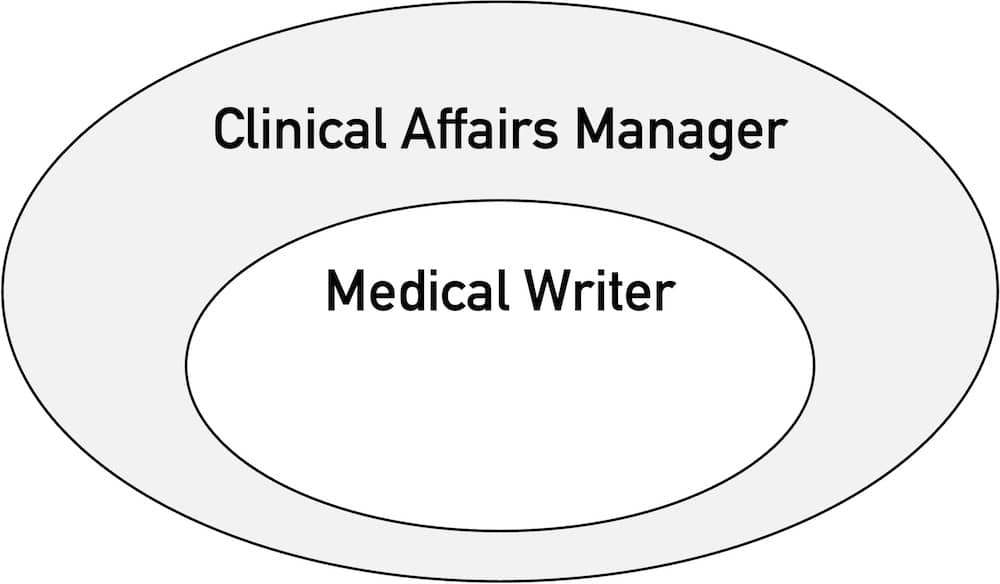
„Medical Writer“ haben einen festen Platz im Ökosystem der Medizinprodukte- und IVD-Hersteller. Dieser Artikel klärt, 1. Zusammenfassung Ein Medical Writer ist eine Person, die im Umfeld der Pharma- und Medizinprodukte Forschungsergebnisse sowie Hinweise zur Verwendung von Produkten und medizinische Informationen sammelt, bewertet sowie verständlich, wissenschaftlich korrekt und gesetzeskonform dokumentiert. Medical Writing bezeichnet das Erstellen von wissenschaftlichen und technischen…
Details
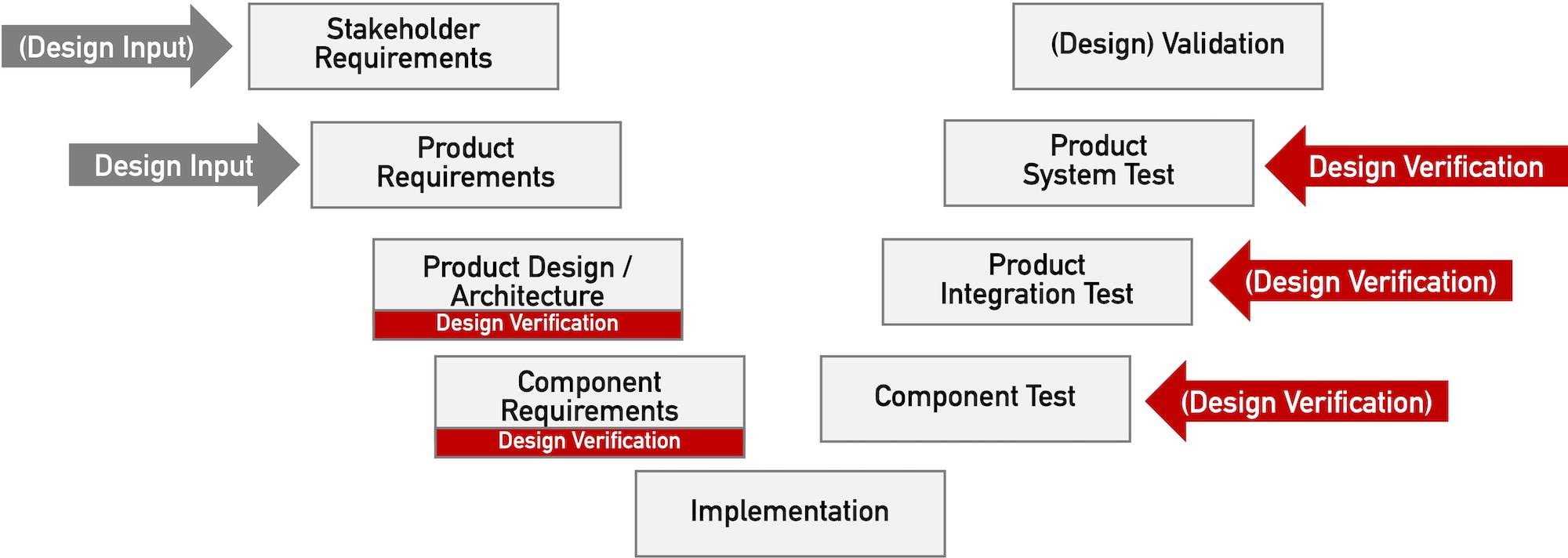
Die Forderung nach „Design Verification“ erhebt keinesfalls nur die FDA. Dieser Beitrag beschreibt, was unter „Design Verification“ zu verstehen ist und welche regulatorischen Forderungen Medizinproduktehersteller erfüllen sollten.
Der Begriff klinische Validierung wird häufig auch im Zusammenhang mit Medizinprodukten verwendet. Beispielsweise veröffentlicht das BMBF eine Richtlinie zum Thema „Klinische Validierung innovativer medizintechnischer Lösungen“. Auch die FDA spricht von clinical validation. Was ist eine klinische Validierung? Was unterscheidet sie von einer klinischen Bewertung und einer klinischen Prüfung? Sind klinische Validierungen überhaupt vorgeschrieben? Hier in…
Details
Die In-vitro-Diagnostik-Verordnung der EU (IVDR) betrifft viele medizinische Labore, obwohl diese Verordnung den Begriff „medizinisches Labor“ weder definiert noch verwendet. Welche Labore sind betroffen? Welche weiteren Gesetze müssen die Labore beachten? Und wie sollen sie all diese Anforderungen erfüllen? Dieser Artikel gibt Antworten.
Details
Über die Stilllegung bzw. Außerbetriebnahme von Medizinprodukten und über das Ende der Vermarktung wird wenig geschrieben. Dafür thematisieren hunderte Artikel die Inbetriebnahme und Inverkehrbringung von Medizinprodukten. Doch Hersteller und Betreiber stehen häufiger vor der Frage, ob und wie sie ihre Medizinprodukte stilllegen, deren Vermarktung beenden und idealerweise die Verantwortung für diese „Altprodukte“ loswerden können. Dieser…
Details
Was ist ein Device Master Record (DMR)? Ist er auch für Software gefordert? Falls ja, welche regulatorischen Anforderungen in den USA und Europa sind zu beachten? Und was sollte ein DMR enthalten? Dieser Beitrag gibt Antworten. Was ist ein Device Master Record? ‚Device Master Record‘ (DMR) ist ein durch die FDA geprägter Begriff, der auch außerhalb der…
Details
Unter eCopy versteht die FDA die elektronische Kopie/Version von papierbasierten Einreichungen, z. B. im Rahmen einer 510(k)-Submission. Die FDA hat im Dezember 2020 eine überarbeitete Version des Guidance-Dokuments eCopy Program for Medical Device Submissions veröffentlicht. Ist das eCopy-Programm verpflichtend? Die kurze Antwort auf diese Frage lautet: „teilweise“. Die FDA verlangt gemäß Sektion 745A/(b) des „Food,…
Details