Zulassung auf Knopfdruck – Mit Realtime Compliance und ohne Dokumentenstress sicher in die Zukunft
Sichern Sie das Überleben Ihrer Firma in einem akut gefährdeten Markt mit einer einzigen, zentralen Software – dem Realtime Compliance System (RCS). Völlig ohne Dokumente oder zig Iterationen mit Ihrer Benannten Stelle.
Sie beschleunigen den Zertifizierungsprozess um Größenordnungen – per Knopfdruck ist Ihr Produkt zertifiziert.
Sie haben nie wieder Abstimmungsprobleme mit der Benannten Stelle, den Behörden oder internen Abteilungen.
Regulatory Affairs wandelt sich vom gefühlten Bremser zum gefragten, strategischen Partner der Geschäftsführung.
Erkennen Sie sich hier wieder?
Sie sind im Unternehmen für Regulatory Affairs verantwortlich und mit dem Output Ihrer Abteilung nicht zufrieden, obwohl alle nach Kräften arbeiten.
Denn Sie werden daran gemessen, wie schnell Sie die Zulassung Ihrer Medizinprodukte erreichen. Und das dauert aus Sicht der Geschäftsleitung und des Produktmanagements zu lange.
Ihre Firma gerät durch die neue MDR und die damit verbunden ständigen Änderungen immer stärker unter Druck. Die Zulassungsdauern haben sich stark verlängert, doch Ihre innovativen Produkte müssten schneller in den Markt, um Ihre Wettbewerbsfähigkeit zu sichern.
Ihre Abteilung wird im Unternehmen zunehmend als Bremser und Spielverderber wahrgenommen, der die Markteinführungen neuer Produkte verzögert (obwohl Sie ja nichts dafür können).
Sie haben versucht, Ihr Team zu erweitern, um die Arbeitsbelastung auf mehr Köpfe zu verteilen und das Tempo zu erhöhen, aber Sie finden einfach keine guten Leute mehr auf dem Markt.
Sie wären gerne strategische:r Berater:in der Unternehmensleitung, gehen aber stattdessen unter in einer Flut von Dokumenten, die erstellt, geprüft und abgestimmt werden müssen.
Die Iterationsschleifen mit der Benannten Stelle werden häufiger; die entstehenden Kosten sind inzwischen immens und erhöhen zusätzlich den Kostendruck.
Ihr Team ist alles andere als happy. Die Mitarbeitenden wissen genau, dass ein Großteil der nervtötenden Arbeit mit den Dokumenten überflüssig ist, weil Computer das besser und schneller könnten.
Sie machen sich zunehmend Sorgen um die Zukunft, weil die Konkurrenz (zum Beispiel aus China) stetig stärker wird und Sie immer öfter von Insolvenzen in der Medizinproduktebranche hören.
Sie haben vielleicht ein RIMS (Regulatory Information Management System) eingeführt, das aber die Probleme nicht gelöst, sondern eher die Komplexität erhöht hat.
Zusammengefasst: Sie müssen im Unternehmen immer öfter nach Geld fragen, Ihre Abteilung bläht sich immer weiter auf, hat immer noch nicht die gewünschten Ergebnisse und das Ganze wird langsam existenzbedrohend.
Wie wäre es, wenn…
Sie nie wieder Dokumente hin- und herschieben müssten?
der ganze Stress mit den anderen Abteilungen und der Benannten Stelle sich in Luft auflösen würde?
Sie in jeder Sekunde des Entwicklungsprozesses eines neuen Medizinprodukts auf Knopfdruck nicht nur wüssten, wie weit das Projekt vorangekommen ist, sondern auch...
absolut sicher sein könnten, dass alles, was bisher entwickelt wurde, zu 100 % konform mit den gesetzlichen Regelungen ist?
Sie genau in dem Moment Ihre Zertifizierung in den Händen halten würden, in dem das Produkt fertig entwickelt ist? Also nicht mehr zwei Jahre Stress und Ärger dranhängen müssen, um endlich in den Markt zu kommen.
sich Ihre Position im Unternehmen grundlegend änderte, weil Sie nun Zeit, Kapazitäten und Energie frei hätten, um für die Business Units und die Geschäftsführung wertvolle Vorschläge für die regulatorische Strategie zu erarbeiten?
Sie durch eine grundlegende Umstellung des Zertifizierungsprozesses das langfristige Überleben Ihrer Firma sichern könnten?
Sie sich in Ihrem Bereich zum Marktführer entwickeln könnten, weil Sie die aktuelle Disruption durch Realtime Compliance nutzen, um 100 mal schneller Ihre Zertifizierung zu erhalten?
Sie mit Ihrer Abteilung endlich das tun würden, was Sie schon immer wollten: mit guten Medizinprodukten die Welt ein klein wenig besser zu machen und Ihrer Arbeit wieder mehr Sinn zu geben?
Die Situation ist tatsächlich dramatisch, und das ist keine Schwarzmalerei.
Wir haben öffentlich zugängliche Daten der Zulassungsbehörden untersucht. Die Ergebnisse haben unsere schlimmsten Befürchtungen bestätigt:
Es findet gerade ein Sterben deutscher Medizinprodukte-Hersteller statt. Die Regelungswut der EU-Kommission und des deutschen Gesetzgebers hat den Zertifizierungsprozess so verlangsamt, dass der Anteil der deutschen Hersteller massiv gesunken ist:
Von 80 % vor der Medical Device Regulation (MDR) auf 30 % stand Mitte 2023.
Die geplante PFAS-Regulierung gibt Grund zu der Annahme, dass sich dieser Trend fortsetzen wird. Denn die Gesetzesflut erfordert von den Herstellern eine Arbeitsweise, die direkt aus den 80er-Jahren kommt. Und das bedeutet, strukturierte, computerlesbare Informationen in nicht computerlesbare Dokumente zu überführen.
Das hat zur Folge, dass die Arbeitsbelastung der RA-Abteilungen mit der Zunahme der Regelungen höher wird. Die Zulassungszeiträume verlängern sich und die Hersteller können ihre Produkte nicht schnell genug in den Markt bringen und damit Geld verdienen. Gleichzeitig bleiben die laufenden (Personal)Kosten bestehen oder steigen, beispielsweise für neue Mitarbeitende in den Regualtory-Affairs-Abteilungen. Darüber rutschen viele Firmen in die Insolvenz.
Die besten Kräfte werden für die Dokumentation und Erstellung von Akten abgestellt. Die Entwicklung dringend benötigter neuer Produkte ist zurückgestellt. Dabei wäre es notwendig, insbesondere Medizinprodukte, die Software sind oder enthalten, in täglichen oder wöchentlichen Zyklen zu releasen, um mit dem Wettbewerb konkurrieren zu können.
Aber wer alles manuell machen muss, und das auch noch für divergierende Regularien in den verschiedenen Märkten, hat riesige Aufwände, verliert Zeit und ist auf Dauer nicht mehr wettbewerbsfähig.
Irgendwann geht das Unternehmen in Konkurs.
Wir vom Johner Institut beobachten, wie jeden Tag Hersteller aus dem Markt gedrängt werden. Kleine Firmen sind sogar bereit, sich zu verschenken, um überhaupt noch etwas zu retten.
Es gibt eine Lösung, aber diese hier ist keine…
Viele versuchen den Druck zu lindern, indem sie eine Software einführen, beispielsweise Regulatory Management Informationsystems (RIMS).
Aber ein weiteres System führt nur zu noch höherer Komplexität.
Im allerbesten Fall haben Sie Ihre eigene Abteilung, aber nicht den Prozess von Anfang bis zum Ende optimiert.
Das alte, dokumentenbasierte Vorgehen wird vielleicht innerhalb der eigenen Mauern ein bisschen schneller oder einfacher. Aber das eigentliche Problem haben Sie nicht gelöst.
Denn die Zulassungsdauer ist immer noch zu lang. Die Kosten sind immer noch zu hoch. Sie müssen immer noch x Iterationen mit den Zulassungsbehörden machen, immer noch in den Abteilungen den richtigen Unterlagen hinterherbetteln, Sie werden immer noch zu spät feststellen, dass Produkte entwickelt wurden, die so nicht zugelassen werden können.
Mit RIMS kaufen Sie Systeme, die helfen, einen veralteten Ansatz zu automatisieren. Aber deswegen bleibt es immer noch ein veralteter Ansatz. Was Sie eigentlich kaufen, sind bessere Dokumentenverwaltungssysteme. Die bringen Sie nicht weiter.
Wenn sich zukünftig durch den Einsatz von künstlicher Intelligenz (KI) das Entwicklungstempo erhöht und sich die Release-Zyklen verkürzen, dann ist auch mit RIMS nicht möglich, das Tempo mitzuhalten.
Diese Arbeitsweise bedeutet über kurz oder lang, dass Ihre Firma nicht mehr wettbewerbsfähig ist.
Es gibt nur zwei Auswege...
Für Hersteller von Medizinprodukten gibt es im Moment nur zwei Möglichkeiten, zu überleben:
- Sie können durch pure Disziplin und unendlichen Fleiß Ihre Dokumentation auf aktuellem Stand halten. Allerdings können Firmen aus anderen Kulturbereichen das deutlich besser als wir. Darum erobern diese im Moment auch immer höhere Marktanteile, und das wird sich in Zukunft so fortsetzen.
- Wir schaffen Systeme, bei denen die Zulassung eigentlich kein Thema mehr ist, weil sie kontinuierlich erfolgt und nicht mehr punktuell. Das setzt aber voraus, dass es gar keine Dokumente mehr geben darf und deswegen auch keine Dokumentenverwaltungssysteme.
Das Arbeiten mit Dokumenten und Dokumentenverwaltungssystemen ist ein Ansatz aus den 80er-Jahren. Damit kann man in unserer Branche mit Sicherheit nicht zukunftsfähig werden.
Was Sie bräuchten, ist Software, die gar nicht mehr in Dokumenten arbeitet, sondern die die einzelnen Inhalte sofort überprüft. Kontinuierlich und zeitgleich.
Dadurch müssen Sie gar nichts mehr machen. Die Software bringt alle Unterlagen in die Zielformate. Niemand macht da noch irgendwas von Hand oder schiebt Dokumente hin und her.
Und das Praktische ist: Diese Software wird nicht nur bei Ihnen eingesetzt, sondern auch bei den Benannten Stellen. Das heißt, alle beteiligten Parteien – nicht nur die firmeninternen Abteilungen – arbeiten auf dem gleichen Datensatz. Der Hersteller gibt ihn für die externen Parteien frei.
In anderen Worten: Die Informationen sind und bleiben von Anfang bis Ende in strukturierter, computerlesbarer Form erhalten und damit sind sie von Anfang bis Ende jederzeit in jeder Sekunde automatisiert auf Korrektheit, Vollständigkeit und Konsistenz prüfbar.
Und weil jede Information nur einmal eingegeben werden kann, ist es unmöglich, dass am Ende irgendwas nicht zusammenpasst oder anderen Daten widerspricht.
Zu jedem Zeitpunkt wissen Sie, was noch fehlt, können es sofort ändern und damit direkt die Zulassung durchführen.
Die Lösung ist also nicht die Automatisierung der Dokumentenverwaltung, sondern eine echte digitale Transformation: andere Prozesse, anders qualifizierte Mitarbeitende, eine andere Kultur, eben eine Transformation des Unternehmens.
Genau das bringt Ihnen das Realtime Compliance System.
Das ist der Schlüssel für die Zukunft in der Medizinproduktebranche. Nur auf diesem Weg werden Sie als Unternehmen zukunftsfähig und Marktanteile (zurück-) gewinnen, statt zu verlieren oder in die Insolvenz abzurutschen.
Wie würde Ihre Zukunft mit dem Realtime Compliance System aussehen?
Die wichtigste Änderung ist: Es gibt keine Dokumente mehr und damit entfällt der gesamte Stress, der Ihnen und Ihrer Abteilung im Moment das Leben schwer macht. Natürlich gibt es immer die Möglichkeit eines PDF-Exports.
Aber vor allem entfällt die Zeitverzögerung.
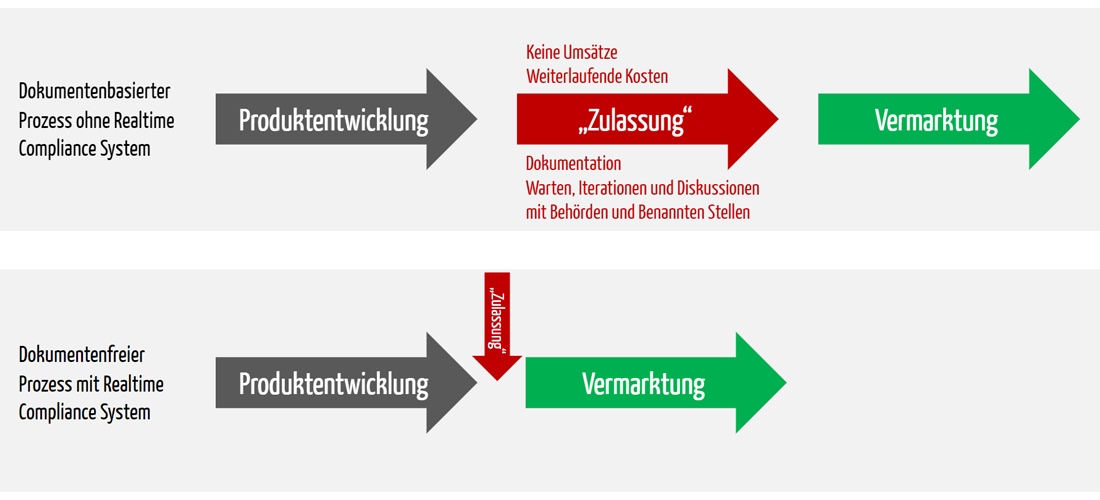
Zwischen Ihrer Firma und den Zulassungsbehörden gehen keine Dokumente mehr hin und her, weil alles datenbasiert bleibt. Sie ersparen sich die aufwändige Kommunikation sowie Abstimmungen zu den Unterlagen. Denn bei Ihnen ist quasi schon alles geprüft. Bei der Benannten Stelle laufen nach Ihrer Freigabe der Daten im Wesentlichen die gleichen Prüfungen, weil es dasselbe System ist. Benannte Stellen erhalten teilweise sogar ihre Checklisten vorausgefüllt. Beispielsweise sind die Links auf die Nachweisdokumente automatisch verlinkt. Es passiert also nicht, dass die Benannte Stelle etwas nicht findet und deshalb Rückfragen stellt oder gar eine Abweichung schreibt.
Im Prinzip können Sie einfach einen Knopf drücken, das war's – damit haben Sie Ihre Zulassung.
Sobald ein gutes Produkt entwickelt ist, bringt Ihre Regulatory-Affairs-Abteilung es dank Realtime Compliance schnell in den Markt. Die Zukunftsfähigkeit Ihrer Firma ist gesichert.
Sie haben diese ganzen Abstimmungsprobleme nicht mehr, weil der Stand des Projekts für alle sichtbar ist – vergleichbar mit einem Vollständigkeitszeiger.
So startet die Entwicklungsabteilung zum Beispiel bei 0 % Konformität. Während der Entwicklung wird dann Schritt für Schritt dokumentiert. Und stückweise geht der Zeiger hoch.
Die verschiedenen Abteilungen können nichts in die Software schreiben, was widersprüchlich ist, weil es nur eine Wahrheit in dem System gibt und nicht viele Wahrheiten.
Alle "Informations-Zulieferer" wissen also in jeder Minute genau, wie konform sie sind.
Auch Ihre Regulatory-Affairs-Abteilung ist von Anfang an involviert, weil wahrscheinlich sie das Projekt in der Software aufgesetzt hat. Das ist auch wichtig, um Zulassungsprobleme zu vermeiden.
Dadurch gibt es in Ihrer Firma zum Beispiel auch keine Silos mehr, in denen unabhängig vor sich hingearbeitet wird und Widersprüche unbemerkt bleiben.
Alle Beteiligten sind in einem System. Das betrifft sowohl Ihre Abteilungen als auch nachher die Benannte Stelle. Alles auf einem System.
Die ganze Abstimmung und dieser Riesenaufwand fallen komplett weg.
Außerdem werden Risiken minimiert, weil niemand mehr unabgestimmt etwas entwickelt, von dem am Schluss die Regulatory-Affairs-Abteilung sagen muss, dass das so nicht ginge.
Sie entwickeln Ihre Produkte gemeinsam kontinuierlich weiter, weil alles immer im gleichen System landet. Dieses sagt Ihnen immer sofort, ob etwas weiterhin konform ist oder nicht.
Sie haben völlige Transparenz und Sie haben Speed. Damit haben Sie einen Marktvorteil, weil Sie die Dauer der Entwicklungs- und Zulassungszyklen immer weiter minimieren.
Das ist das Wichtigste für Sie als europäischer Hersteller und Ihren hohen Personalkosten: Sie müssen Ihre Innovationen schnell in den Markt bekommen, bevor die anderen diese „übernommen“ haben.
Das Geheimnis ist, die nervigsten Arbeiten NICHT mehr zu tun.
Das notwendige Tempo schaffen Sie dadurch, dass ganz viele Tätigkeiten wegfallen:
Dokumente einfordern braucht es nicht mehr. Die Informationen sind längst im Realtime Compliance System (RCS). Damit können Sie jederzeit sehen, was vollständig ist und was nicht.
Prüfen, ob das, was in den Dokumenten steht, auch widerspruchsfrei mit anderen Dokumenten ist: Das brauchen Sie auch nicht mehr, denn das übernimmt das RCS für Sie.
Fehlenden Dokumenten hinterherrennen: Das müssen Sie jetzt auch nicht mehr. Alle Daten sind im RCS – für Dokumente interessiert sich niemand mehr.
Überprüfen, ob die Dokumente wirklich konform sind bzw. mit den Gesetzen übereinstimmen: Das brauchen Sie auch nicht mehr. Das übernehmen die Algorithmen des RCS für Sie – und zwar in Realtime.
Alle Dokumente in die verschiedenen Zielformate bringen für die verschiedenen Märkte, wie zum Beispiel USA oder Japan. Das heißt in unterschiedliche Reihenfolgen, unterschiedliche Formatierungen, unterschiedliche Kapitelstrukturen, unterschiedliche Detailgrade bringen. Das fällt auch weg, denn das RCS exportiert Ihnen die verschiedenen Zielformate jederzeit.
Schätzungsweise 80 % der Arbeit Ihrer Abteilung fällt weg – und zwar der nervige Teil.
Was übrig bleibt, ist der Teil, den Sie eigentlich tun sollten: Nämlich strategisch dem Business zu helfen, über die richtigen Märkte, die richtigen Produkte und deren Zusammenstellung zu entscheiden und damit die Wettbewerbsfähigkeit des Unternehmens zu sichern.
Damit sind Sie auf einer ganz anderen Ebene unterwegs. Sie sind mit Ihrer Regulatory-Affairs-Abteilung nicht mehr die Dokumentenverschieber, die alles verhindern, blockieren und nerven.
Sie sind jetzt die strategischen Partner Ihres Businesses.
Wenn man das in Beziehung zu der aktuell dramatischen Gesamtsituation setzt, dann haben Sie mit dem Realtime Compliance System praktisch die Magic Bullet in der Hand.
Und das ist keine Zukunftsmusik mehr, sondern für mehrere Firmen inzwischen Realität.
Ein neues Zeitalter bricht an; Ihre Rolle und Funktion in der Firma ändern sich...
Jetzt haben Sie Wirksamkeit, weil Sie jetzt dazu beitragen, Produkte in die Märkte zu bringen und Patient:innen zu helfen.
Jetzt ergibt alles wieder Sinn. Sie haben nicht mehr das Gefühl, im falschen Jahrtausend gelandet zu sein, in dem man mit Dokumenten hantierte.
Und damit ist es jetzt auch modern, zeitgemäß und zukunftsorientiert.
Sie werden zu wertvollen Informations-Scouts. Sie müssen zwar keine Informationen sammeln, denn das übernimmt Ihr Realtime Compliance System. Aber Sie sind diejenigen, die diese bewerten und die richtigen Schlussfolgerungen daraus ziehen.
Das sichert Ihr langfristiges Überleben, weil Sie damit wirklich einen wertvollen Beitrag leisten, den auch eine KI zukünftig nicht so einfach übernehmen kann.
Wenn Sie das überzeugt, dann vereinbaren Sie jetzt ein strategisches, unverbindliches und kostenfreies Erstgespräch mit Prof. Dr. Christian Johner und Mitarbeitenden des RCS-Teams.
Zwei Gründe, warum Realtime Compliance bisher nicht möglich war
Es gibt zwei Gründe, warum Realtime Compliance bisher nicht möglich war:
- Lange Zeit war die Zulassung nur per Papier und „wet ink“ möglich. Doch jetzt verpflichtet die MDR die Hersteller zu einfach durchsuchbaren Unterlagen und damit zu elektronischen Einreichungen. Auch die FDA verlangt dies und beginnt mit dem eStar-Programm sogar, strukturierte Informationen einzufordern.
- Eine komplizierte Software wie das Realtime Compliance System kann man nur entwickeln, wenn man die Regularien in- und auswendig kennt und vollumfänglich versteht, zum Beispiel, weil man mit an der Entwicklung dieser Regularien beteiligt war und wenn man in der Lage ist, diese Regularien in Algorithmen zu überführen und diese Algorithmen nachher auf die Daten draufsetzen kann, um dann abzugleichen, ob diese Daten korrekt sind oder nicht. Genau das hat das Johner Institut in den letzten Jahren erarbeitet.
So würde sich die Zusammenarbeit zwischen dem Johner Institut und Ihrer Firma gestalten
Der Prozess, der zur ersten Markteinführung eines Ihrer Produkte mit dem RCS führen wird, dauert ungefähr sechs Monate.
Er besteht aus den folgenden Schritten:
- „Scoping“ des Vorprojekts
Wir wählen das Produkt, den Markt und die Benannte Stelle aus, mit denen wir den „Zulassungsprozess“ exemplarisch erproben. So gelingt ein „Ende-zu-Ende-Durchstich“, mit dem wir herausfinden, wie das Hauptprojekt – der Rollout – erfolgreich gestaltet werden kann. - Quelldatenanalyse
Anschließend identifizieren wir, in welchen Systemen und Dokumenten die für die Zulassung relevanten Informationen zu finden sind. Wir legen außerdem fest, wo die Primärdaten künftig verwaltet werden sollen. - Anbindung eines Primärsystems
Wir binden eines der Systeme, das Primärdaten für das ausgewählte Produkt enthält, zum Beispiel ein ALM-System wie Jira, an. Oft müssen dazu Daten, die dort in unstrukturierter Form gespeichert werden, in präzise Informationseinheiten zerlegt werden, um automatisiert auswertbar zu werden. - Dry-Run mit Benannter Stelle
Gemeinsam mit einer Benannten Stelle führen wir einen „Dry-Run“ durch. Das heißt die Benannte Stelle führt das Review mit dem System durch. Sie erzeugt dabei die üblichen Berichte, sodass sie keine Prozessänderung bei sich durchführen muss. Wir exportieren aus Gründen der Rückwärtskompatibilität die Inhalte auch in klassische Dokumente. - Rollout
Dann folgt der Rollout, bei dem das System für alle Produkte und Märkte vorbereitet wird und alle Primärsysteme angebunden werden.
Dies sind Ihre nächsten Schritte...
Wenn Sie erkennen, dass ...
- Sie die überlebenswichtige Geschwindigkeit nicht erreichen können, solange Sie Dokumente und die "Zulassung" von Hand machen, weil Sie gegen Computer keine Chance haben – und gegen KI schon gar nicht,
- die Informationen prüffähig vorliegen müssen und nicht in Dokumenten „vergraben“ sein dürfen (hoffen Sie nicht, dass die KI das später alles magisch wieder herausbekommt) und es überhaupt keine Dokumente mehr geben darf,
- die Prozesse wie die Produktentwicklung und „Zulassung“ zunehmend parallel stattfinden müssen, um die notwendige Geschwindigkeit zu erreichen,
- das ganze Produkt und seine Entwicklung zentral an einer Stelle dokumentiert werden müssen und nach der Eingabe eine sofortige Rückmeldung notwendig ist, ob diese Daten konform sind oder nicht,
dann ist der nächste Schritt ein erstes Sondierungsgespräch mit dem Johner Institut.
Bei diesem erhalten Sie Folgendes:
Ein präzises Zukunftsbild, wie Ihre Regulatory-Affairs-Abteilung und das Arbeiten in dieser Abteilung in wenigen Jahren aussehen werden
Eine genaue Vorstellung, in welchen Schritten Sie dieses Zukunftsbild erreichen
Kriterien, mit denen Sie das Produkt, das Primärsystem, den Markt und die Personen auswählen können, um das Vorprojekt zum Erfolg zu führen
Ein Verständnis für die Dauer und Kosten, die dafür anfallen, um die Budgets zu planen
Wenn Sie das überzeugt, dann vereinbaren Sie jetzt ein strategisches, unverbindliches und kostenfreies Erstgespräch mit Prof. Dr. Christian Johner und Mitarbeitenden des RCS-Teams.
Über das Johner Institut

Prof. Dr. Christian Johner ist der anerkannt führende Experte für den Zulassungsprozess von Medizinprodukten in Deutschland.
In den letzten 20 Jahren hat er das Johner Institut zum Marktführer aufgebaut, das mit Beratung, Kursen, KI-Produkten und Trainings inzwischen weit über 1000 Kunden geholfen hat, den Zertifizierungsprozess für ihre Produkte zu schaffen.
Das hat immer funktioniert, unter anderem auch, weil das Johner Institut an der Entwicklung vieler Regularien maßgeblich beteiligt ist.
Die von ihm und seinem Team aufgebaute Informationsbasis auf der Homepage ist inzwischen für Interessierte zur wichtigsten Informationsquelle zum Thema Zulassung von Medizinprodukten geworden.
Beim vom Johner Institut veranstalteten World Medical Device Summit nahmen die FDA, die EU-Kommission, zahlreiche Ministerien, die ZLG, Benannte Stellen und Behörden teil. Diese stellten, als sie das Realtime Compliance Systeme sahen, die Frage: "Weshalb gab es so etwas nicht schon früher?" Denn sie hatten sofort erkannt, dass damit der Engpass der Benannten Stellen beseitigt und damit das Sterben der Medizinproduktehersteller gestoppt werden könnte.
Für das Projekt bot ein behördlicher Teilnehmer eine Förderung an.
Das Team des Johner Instituts umfasst inzwischen über 160 Mitarbeitende.
Für die Einführung des Realtime Compliance Systems steht Ihnen ein festes Team aus verschiedenen Expert:innen zur Verfügung.
Wenn Sie das überzeugt, dann vereinbaren Sie jetzt ein strategisches, unverbindliches und kostenfreies Erstgespräch mit Prof. Dr. Christian Johner und Mitarbeitenden des RCS-Teams.
Sie haben Fragen?
Das wäre ja zu schön, um wahr zu sein. Gibt es schon einen Beweis dafür, dass das RCS wirklich funktioniert?
Das erste große Unternehmen hat gerade sein erstes Produkt über das Realtime Compliance System erfasst und die Prüfung der technischen Dokumentation mit einer Benannten Stelle erprobt.
Das Johner Institut arbeitet seit Jahren an der Entwicklung des Realtime Compliance Systems und die intensiven Vorarbeiten haben sich jetzt gelohnt.
Ab sofort kann diese Firma alle Weiterentwicklungen ihres ersten Produkts in Lichtgeschwindigkeit zulassen und damit an allen anderen vorbeiziehen.
Hier die Case Study zu unserem ersten erfolgreichen Kundenprojekt.
Wieso ist das Johner Institut in der Lage, so eine revolutionäre Software anzubieten?
Weil das Johner Institut die Top-Expert:innen hat, die in der Lage sind, Regularien so tief zu verstehen (und daran oft sogar mitgewirkt haben), dass sie diese Regularien in Algorithmen überführen und dafür passende Datenstrukturen entwerfen können.
Außer dem Johner Institut ist dazu im Moment niemand anderes in der Lage.
Wird die Einführung des RCS bei uns nicht viel zu teuer?
Die jetzige Situation ist deutlich teurer: Jeder Monat, den das Produkt später in den Markt kommt, kostet das Unternehmen ein Vielfaches. Das Regulatory Affairs Team wird von den Fleißarbeiten (der Mehrheit der Aufgaben) befreit, arbeitet effizienter, benötigt weniger Ressourcen und steht für strategische Aufgaben zur Verfügung.
Es gibt in der aktuellen Marktsituation für die Firmen praktisch keine Alternative zur mittelfristigen Insolvenz, weil diejenigen, die auf Realtime Compliance umstellen, alle anderen verdrängen werden.
Dafür müssten wir ja das ganze Unternehmen umbauen. Außerdem haben wir keine Ressourcen. Wie soll das gehen?
Das Projekt startet mit einem MVP, der nur wenige Monate dauert und keine Ressource vollzeit bindet. In dieser Zeit wird prototypisch für ein Produkt, einen Markt und ein angebundenes System der Zulassungsprozess Ende zu Ende (Entwicklung bis Benannte Stellen) ausprobiert. Dabei machen sich die Vorteile bemerkbar und die Einsparungen bezahlen den weiteren Rollout.
Begeben wir uns mit der Einführung des RCS nicht in die Abhängigkeit vom Johner Institut?
Alle Daten können in den Primärsystemen verbleiben. Alle Daten im System können jederzeit strukturiert sowie in konventionelle Dokumentenformate exportiert werden. Die Subscription ist jederzeit kündbar. Im schlimmsten Fall hat das Unternehmen sein Unternehmensdatenmodell definiert und damit für Klarheit und Redundanzfreiheit gesorgt, die das künftige Arbeiten oder das Anbinden anderer Systeme vereinfachen.
Falls wir das RCS einführen würden, wie lange würde das dauern?
Die Prototyp-Phase dauert nur wenige Monate. Die Dauer für die Transformation bestimmt das Unternehmen selbst. Das Johner Institut hat erprobte Vorgehensmodelle, die einerseits einen kontinuierlichen Fortschritt sicherstellen und andererseits auch gewährleisten, dass das Team jederzeit eingebunden ist und sich mitgenommen fühlt.
Weil wir immer zuerst mit einem Produkt und für einen Markt das System und dessen Einführung erproben, hängt die Dauer weniger von der Unternehmensgröße ab, sondern vielmehr von der Bereitschaft und den Ressourcen, die das Unternehmen für das Projekt bereitstellt.
Haben wir dann nicht eine Software und ein Datensilo mehr?
In der Tat kann es eine Software mehr geben. Aber oft lassen sich Altsysteme ablösen und über das ganze Unternehmen verteilte Dokumente ersetzen, die für Inkonsistenzen und ineffiziente Prozesse mitverantwortlich sind.
Erhalten die Benannten Stellen oder Behörden dann unsere internen Daten oder gegebenenfalls sogar welche, die noch nicht freigegeben sind?
Nach außen gehen nur die Daten, die Sie nach außen freigeben. Also keine Zwischenstände und keine Details, welche die externen Parteien nichts angehen. Denn die bleiben im Primärsystem.
Was machen wir mit Behörden oder Benannten Stellen, die noch nicht mit dem RCS arbeiten?
Das Realtime Compliance System ist rückwärtskompatibel: Es erlaubt, konventionelle Dokumente bzw. Akten zu exportieren. Ganz klassisch arbeitende Unternehmen können diese sogar zum Unterschreiben ausdrucken.
Ich habe weitere Fragen. Wo bekomme ich Antworten?
Sie bekommen Antworten im Erstgespräch sowie über unser Kontaktformular oben auf der Webseite.
Vereinbaren Sie gerne direkt ein strategisches, unverbindliches und kostenfreies Erstgespräch mit Prof. Dr. Christian Johner und Mitarbeitenden des RCS-Teams.


