Orphan Medical Devices: Hoffnung für die Schwächsten?
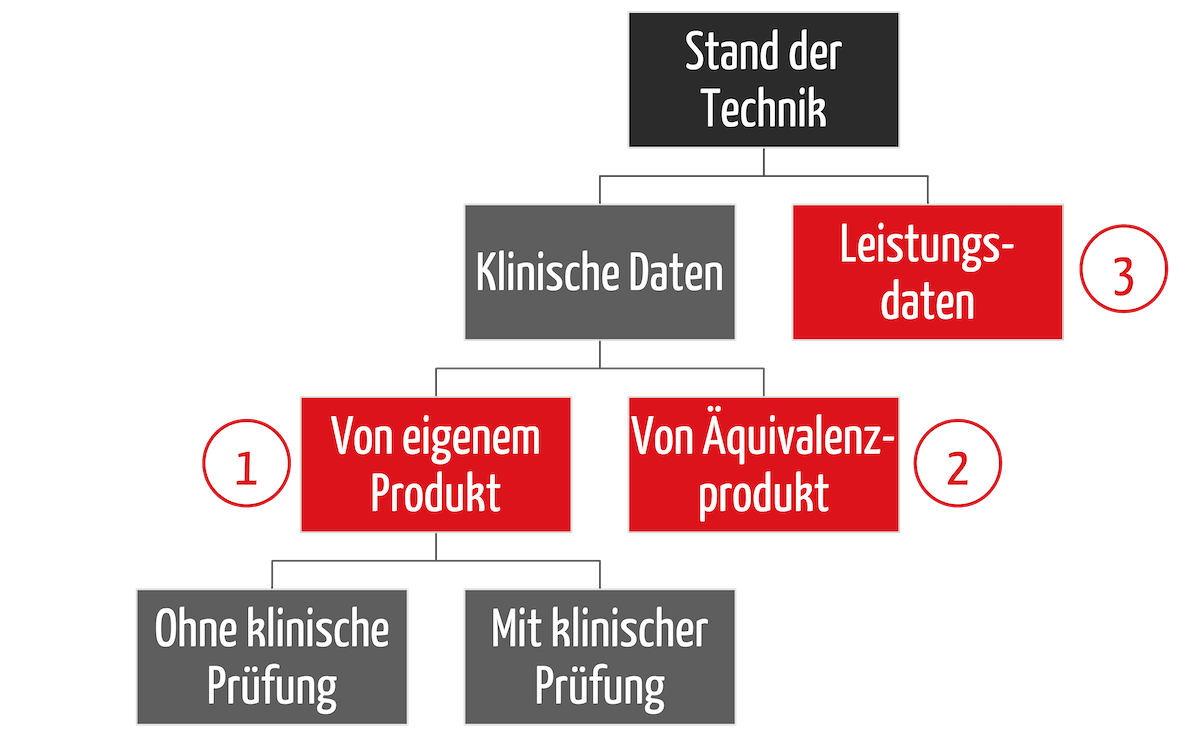
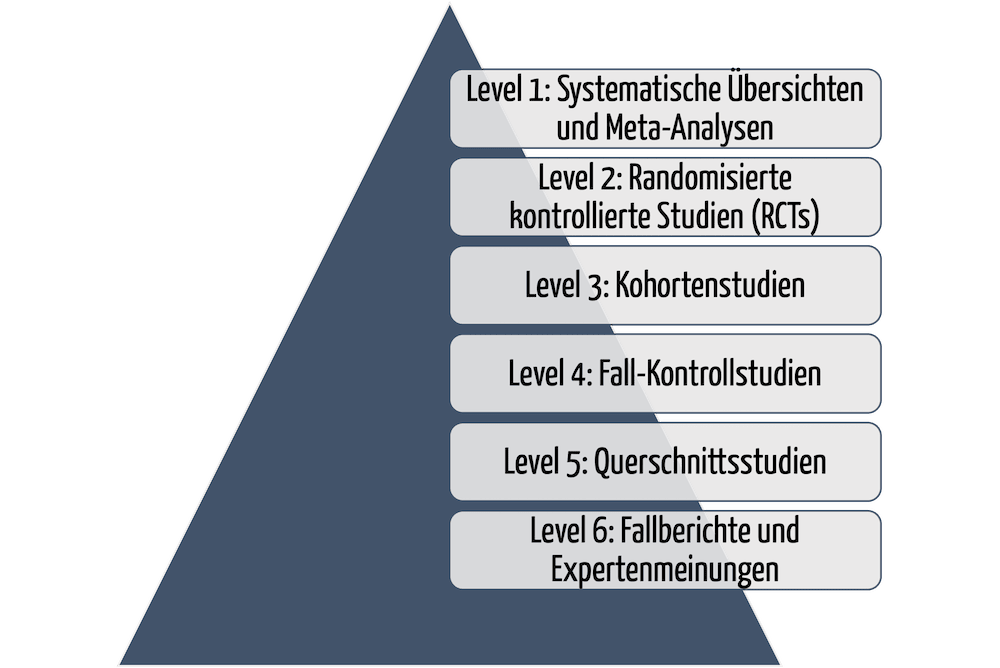
Orphan Medical Devices sind Medizinprodukte (und IVD) für kleine Patientengruppen. Die Entwicklung dieser Nischenprodukte rechnet sich für die Hersteller oft nicht. Das führt dazu, dass besonders vulnerable Gruppen wie Kinder nicht immer ausreichend medizinisch versorgt werden können. Dieser Artikel zeigt Lösungsansätze auf und ordnet die Leitlinie MDCG 2024-10 ein.
Details