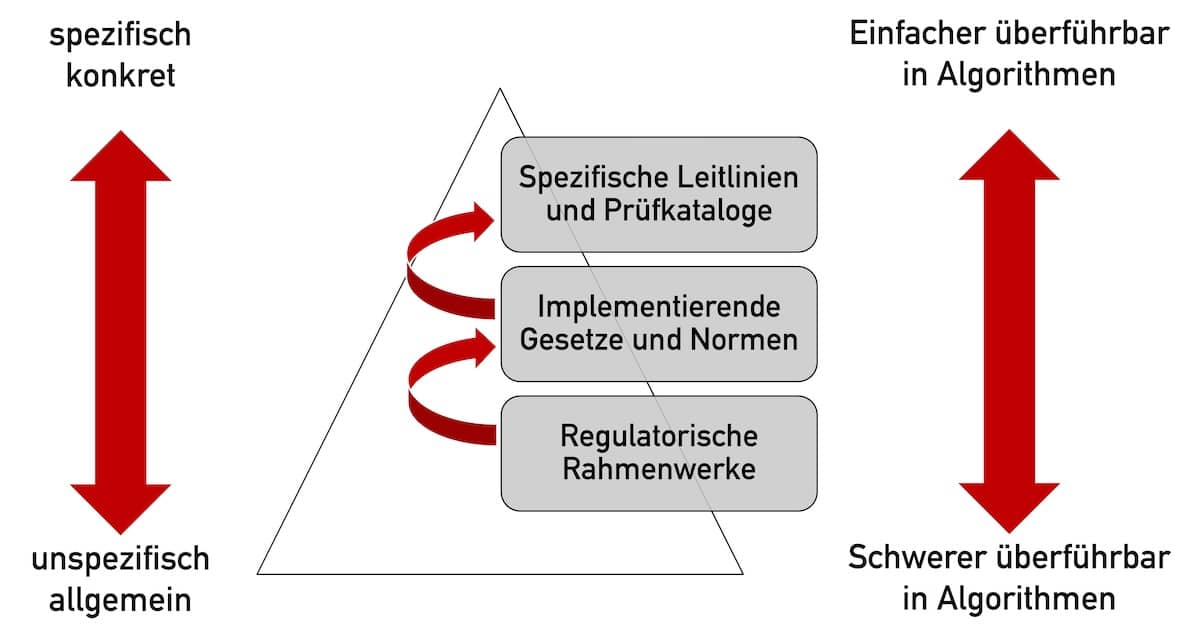
Professor Johner ist Experte für die Entwicklung und Zulassung von Medizinprodukten, die Software enthalten oder Software sind.
Als Auditor, als Mitglied eines Normen-Komitees, als Ausbilder benannter Stellen sowie als Autor mehrerer Bücher und Leitfäden trägt der promovierte Physiker zur Weiterentwicklung der regulatorischen Landschaft bei. Davon zeugen auch Leitfäden, die er für die WHO und die Benannten Stellen entwickelt hat.
Sein Unternehmen, das Johner Institut, unterstützt Medizinproduktehersteller weltweit beim Aufbau von QM-Systemen, bei der Zulassung und Prüfung ihrer Produkte sowie bei der digitalen Transformation regulatorischer Prozesse. Es bietet Weiterbildungen wie E-Learning und Seminare an und übernimmt für Hersteller Prozesse wie die Überwachung der Regularien und der Produkte im Markt.
Christian Johner lehrte an mehreren Universitäten u.a. an der Hochschule Konstanz, der Universität St. Gallen, der Universität Würzburg sowie der Stanford University v.a. Software-Architektur, Software-Qualitätssicherung und medizinische Informatik.