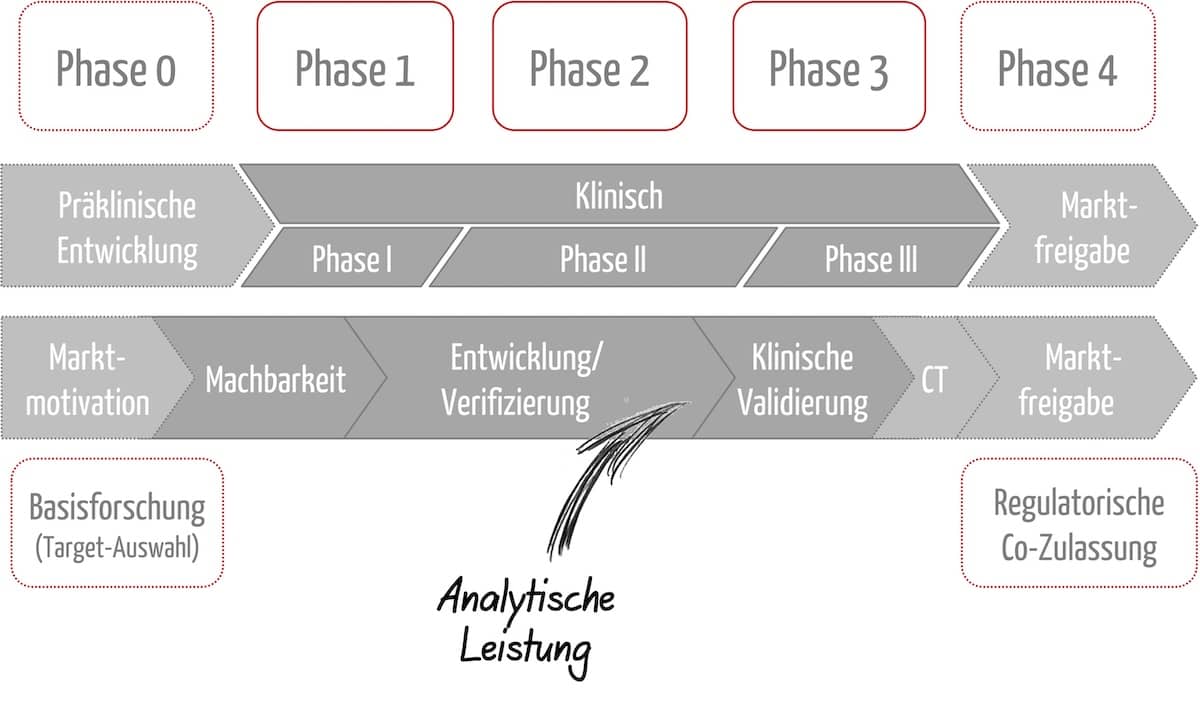
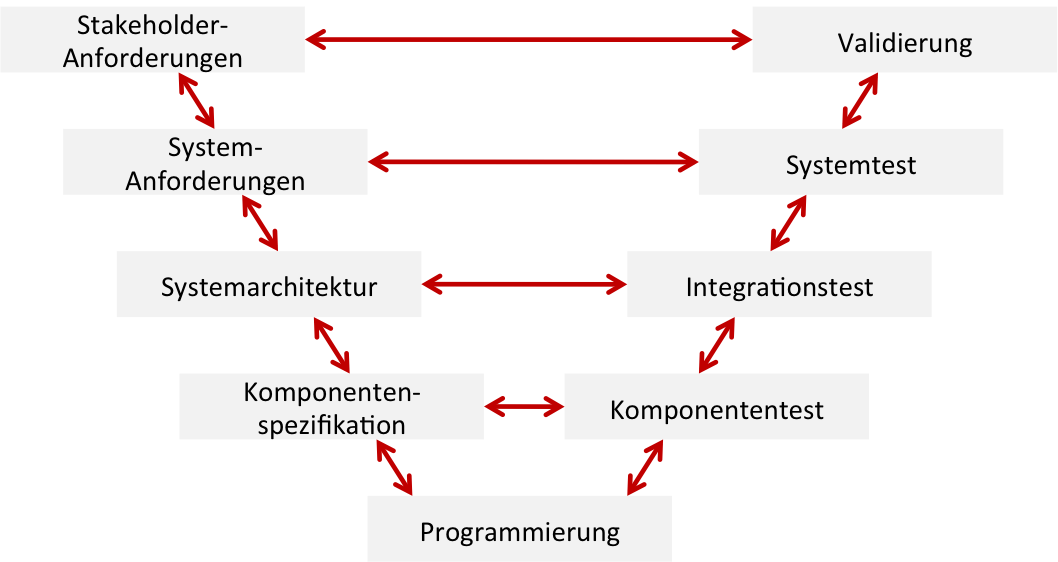
Laborprodukte „For Research Use Only“ (RUO) – Oft eine gefährliche Behauptung
Mit dem Label „For Research Use Only“ (RUO) erklären Hersteller, dass ihre Produkte nicht in diagnostischen Verfahren eingesetzt werden sollen. Sie vermeiden damit die aufwendige Dokumentation für In-vitro-Diagnostika (CE-IVD-Produkte). Dennoch verwenden z. B. medizinische Labore RUO-Produkte in diagnostischen Verfahren, teilweise sogar mit Wissen der Hersteller. Das kann Konsequenzen haben – nicht nur für Hersteller und…
Details