Die FDA fordert in 21 CFR part 820 (das sind die „Quality System Regulations“) ein Design History DHF. Dieses DHF sollte nicht mit dem Device History Record und dem Device Master Record verwechselt werden. Dieser Beitrag erläutert, was das Design History File enthalten muss und wie es sich von den beiden anderen „Akten“ unterscheidet.
Design History File
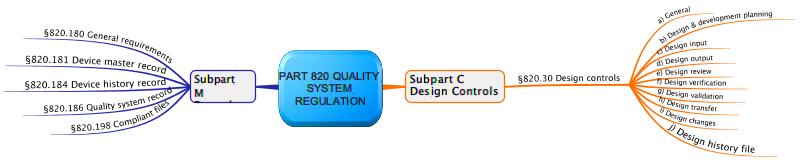
Die FDA fordert in 21 CFR part 820.30j (Design History File): Each manufacturer shall establish and maintain a DHF for each type of device. The DHF shall contain or reference the records necessary to demonstrate that the design was developed in accordance with the approved design plan and the requirements of this part.
Zu den Dokumenten, die ein Design History File enthalten sollte, zählen:
- Design Inputs wie z.B. eine System oder Software Requirements Specification
- Design Outputs wie System- oder Software-Architekturen, Bauteilzeichnungen sowie die Risikoanalyse und Risikobewertungen des Designs
- Design Verification z.B. in Form von Komponenten-, Integrations- und System-Tests sowie Usability Verifizierungen und Validierungen, die sowohl während als auch zum Ende der Entwicklung stattfinden sollten.
- Design Validation
- Design Transfer, aus dem hervorgeht, wie das Produkt später produziert werden soll.
Bei Software gibt Ihnen auch das FDA Dokument „Content of the Premarket Submissions for Software Contained in Medical Devices“ weitere Informationen zum Inhalt eines Design History Files.
Allerdings darf das Design History File nicht nur den letzten Stand der Entwicklung repräsentieren. Vielmehr muss das Design History File den Verlauf der Entwicklung nachvollziehbar dokumentieren, beispielsweise wie Änderungen am Design (Design Change) eingeflossen, freigegeben und umgesetzt wurden. Das Design History File entspricht somit der Historie der Entwicklungsdokumentation.
Ihr Design History File muss den Nachweis erbringen, dass Sie als Hersteller sich an Ihre eigenen Verfahrensanweisungen insbesondere mit Bezug zur Entwicklung gehalten haben.
Unterschied von Design History File und DMR bzw. DHR
Device Master Record DMR
Nachdem das Design History File das zu entwickelnde Gerät zeigt, beschreibt der Device Master Record wie das Gerät genau zu produzieren ist. Dazu können Vorgaben zählen,
- wie das Gerät zusammenzubauen ist,
- wie Produktionsmaschinen einzustellen sind,
- wie das Gerät zu prüfen ist,
- wie das Gerät verpackt werden soll,
- wie das Gerät installiert und gewartet werden muss
- usw.
Für standalone Software kann der Device Master Record relativ dünn ausfallen.
Device History Record DHR
Der Device History Record schließlich liefert den Nachweis, dass man das Gerät gemäß den Vorgaben des Device Master Records produziert hat und die darin geforderten Akzeptanzkriterien erfüllt.
Diese „Akte“ enthält Aufzeichnungen wie die Ergebnisse von Produktprüfungen z.B. am Ende der Produktion. Jedes einzelne Gerät (bei Pharmaprodukten wären das die „Batches“) gilt es dabei zu identifizieren. Auch Wartungsberichte und Ergebnisse von Installationstests wären Bestandteil dieser Akte.
Für standalone Software wird auch der Device History Record schlank sein, da es keine wirkliche Produktion gibt. Die Vervielfältigung auf Datenträger oder die Verteilung über Downloads zählen aber dazu.
Erstellen eines Design History Files (DHF)
Benötigen Sie Unterstützung beim Erstellen einer FDA-konformen Dokumentation insbesondere für eine 510(k) Submission? Wir helfen Ihnen gerne, schnell und kompetent, (nicht nur) Ihr Design History File konform mit den Forderungen des 21 CFR part 820 zu erstellen.




Hallo,
ich habe eine Frage. Das „Device History Record“ (DHR) ist eine FDA Anfoderung des „21 CFR part 820“.
Nach meiner Ansicht ist das DHR vergleichbar mit dem Kapitel 7.5 „Produktion und Dienstleistungserbringung“ der ISO 13485.
„[…] Die Organisation muss für jedes Medizinprodukt oder jede Charge von Medizinprodukten eine Aufzeichnung
erstellen und aufrechterhalten (siehe 4.2.5), die eine Rückverfolgbarkeit in dem in 7.5.9 festgelegten Umfang
ermöglicht und die hergestellte Menge und die für den Vertrieb genehmigte Menge identifiziert. Die
Aufzeichnungen müssen verifiziert und genehmigt werden.“
Müssen diese Produktionsaufzeichnungen aber nach der EU-MDR (Anhang II+III) und Kapitel „4.2.3 Medizinprodukteakte“ der ISO 13485 ein Bestanteil der Technischen Dokumentation sein? Ich habe keine Informationen/Anforderungen in der MDR und der ISO 13485 entnehmen können. Würde es damit ausreichen, wenn man die Produktionsaufzeichnungen nach ISO 13485 Kapitel 7.5 in einem ERP System dokumentiert, worin man Wareneingänge, QCs und Produktionsbatches exakt tracken kann?
Oder ist es doch dringend erforderlich, diese Aufzeichnungen nochmal zu exportieren und in die entsprechene Technische Dokumentation einzufügen, um MDR- und ISO 13485-konform zu sein?
Vielen Dank.
Hallo Herr Salis,
die Produktionsaufzeichnungen sind nicht Bestandteil der technischen Dokumentation gemäß MDR. Diese können Sie in Ihrem ERP-System dokumentieren. Bestandteil der technischen Dokumentation sind hingegen die Vorgaben für die Produktion/DMR.
Freundliche Grüße
Luca Salvatore