| Inhaltsübersicht |
|---|
| Inhalt der MAUDE Datenbank » |
| Neues Werkzeug zur Auswertung » |
| Regulatorischer Hintergrund » |
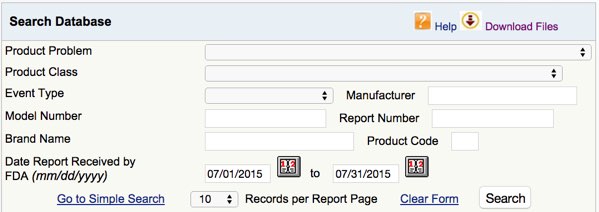
Inhalt der FDA MAUDE Datenbank
Die FDA MAUDE Datenbank enthält Informationen zu
- dem Problem
- der Produktklasse und Produkt-Code
- Der Auswirkung des Zwischenfalls (Tod, Verletzung, …) („Event“)
- Hersteller
- Datum der Meldung
Regulatorischer Hintergrund
Pflicht zur Auswertung
Hersteller sind verpflichtet, ein adäquates Risikomanagement zu betreiben. Das schließt die Überwachung des Produkts im Markt, aber auch ähnlicher Produkte und Technologien mit ein. Nur so kann es Herstellern gelingen,
- Gefährdungen möglichst vollständig zu identifizieren,
- Wahrscheinlichkeiten von Schäden und Problemen sowie
- Schweregrade von Schäden möglichst korrekt abzuschätzen.
Die Datenbanken des BfArMs sowie die FDA MAUDE zählen zu den Quellen, die Sie dabei immer einbeziehen sollten — unabhängig davon, in welchem Rechtsraum Sie Ihre Produkte vermarketen.
Pflicht zur Meldung
Sowohl in den USA als auch in Europa müssen sowohl Hersteller als auch Anwender Probleme und Zwischenfälle melden. Die FDA schreibt hierzu:
- Manufacturers and importers must submit reports when they become aware of information that reasonably suggests that one of their marketed devices may have caused or contributed to a death or serious injury or has malfunctioned and the malfunction of the device or a similar device that they market would be likely to cause or contribute to a death or serious injury if the malfunction were to recur. Manufacturers must send reports of such deaths, serious injuries and malfunctions to the FDA.
- Importers must send reports of deaths and serious injuries to the FDA and the manufacturer, and reports of malfunctions to the manufacturer.
- Device user facilities include hospitals, outpatient diagnostic or treatment facilities, nursing homes and ambulatory surgical facilities. Device user facilities must submit reports when they become aware of information that reasonably suggests that a device may have caused or contributed to a death or serious injury of a patient in their facility. Death reports must be sent to the FDA and the manufacturer, if known. Serious injury reports must be sent to the manufacturer or to the FDA, if the manufacturer is not known.
Änderungshistorie:
- 2023-12-06: Verweis auf Maude-Analyzer des Johner Instituts entfernt




Leider funktioniert aktuell dier Link zum maude analyzer nicht.
Das stimmt, Sie haben Recht!
Wir haben die Datenbank derzeit in der Überarbeitung. Wir sind gewissermaßen Opfer des Erfolgs dieses Services geworden und müssen nun die Infrastruktur neu aufsetzen.
Danke für Ihre Geduld!