Von 2017 bis 2022 bot die FDA ausgewählten Firmen für standalone Software ein „Precertification (Pre-Cert) Pilot Program“ an, das den Zulassungsprozess von Digital Health Produkten vereinfachen und beschleunigen sollte.
Auf Ihrer Webseite informiert die Behörde ausführlich darüber.
Dieser Artikel fasst Ihnen die wichtigsten Aspekte zusammen und verschafft Ihnen einen schnellen Überblick.
Precertification (Pre-Cert) Pilot Program
Die FDA hat erkannt, dass Software
- sehr schnell geändert wird und auch werden muss,
- eine immer wichtigere Rolle in der Gesundheitsversorgung spielt und
- die Anzahl der Zulassungsanträge (insbesondere 510(k)) stark steigen wird.
Der neue Ansatz
Daher experimentiert die Behörde mit einem neuen Ansatz, der schon fast das Attribut „revolutionär“ verdient. Der Gedanke dahinter besteht darin, dass nicht mehr primär das Produkt über die Zulassungsfähigkeit entscheidet, sondern die Organisation. Sie muss nachweisen, dass Sie in der Lage ist,
- den Patienten einen sicheren Umgang mit den Produkten zu gewährleisten
- klinisch verantwortlich zu handeln,
- Produkte höchste Qualität bereitzustellen,
- der Verantwortung bezüglich Cybersecurity gerecht zu werden und
- proaktiv und nicht (nur) reaktiv zu handeln.

Abb. 1: Das Precertification (Pre-Cert) Pilot Program baut auf die Säulen der „ Culture of Quality and Organizational Excellence” (CQOE)
Die Fähigkeit der Organisation, diese Kultur zu leben, möchte die FDA an Kennzahlen festmachen.
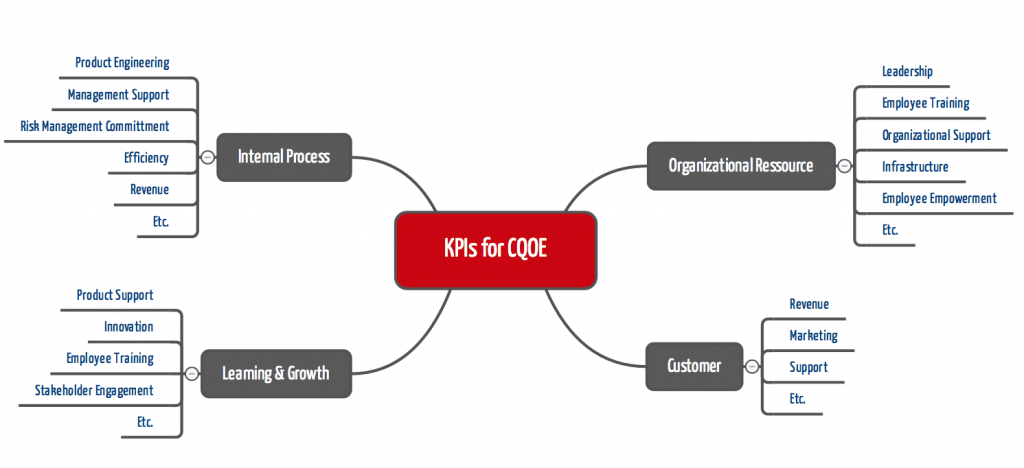
Abb. 3: Wie eine Balanced Score Card möchte die FDA die verschiedenen Perspektiven der CQOE quantifizieren.
Damit verschiebt die FDA den Fokus von
- Produkteigenschaften hin zu den Fähigkeiten einer Organisation (Qualitätsmanagementsystem),
- der Überwachung der Konformität durch die Behörde hin zur Überwachung der Konformität durch die Firma selbst,
- Pre-Market- auch hin zu den Post-Market-Aktivitäten..
Insbesondere das Risikomanagement, die Ausbildung der Mitarbeitenden, die Post-Market Überwachung einschließlich Post Market Clinical Follow-up und das Usability Engineering dürften an Bedeutung gewinnen.
In der Aufzeichnung eines Webinar „Digital Health Software Precertification (PreCert) Pilot Program“ stellt die FDA ihren neuen Ansatz vor:
Die Folien zu diesem Webinar finden Sie hier.
Die FDA beschreibt in einem 17-seitigen Dokument das Software Precertification Program.
Erleichterungen durch das FDA Precertification Program
- Bereits der 21st Century Cure Act hat Erleichterungen gebracht, in dem viele Software-Produkte von der Definition als Medizinprodukt ausgeschlossen wurden.
- Weitere Erleichterungen sollen dadurch erfolgen, dass der „Premarket Review“ beschleunigt wird und
- Software-Produkte mit niedrigem Risiko sogar ohne solch ein Review vermarktet werden dürfen – falls die organisatorischen Anforderungen erfüllt sind.
Teilnahme am Pre-Cert Pilot Program
Die FDA will das Programm im Rahmen eines Piloten ausprobieren. Die Anzahl der Teilnehmer ist sehr begrenzt. Mit Apple, Johnson & Johnson und ROCHE sind große und bekannte Namen dabei.
Das Programm betrifft nur „Software as a Medical Device“, wenn diese keine anderen Geräte kontrolliert. Sie darf aber Daten von solchen Geräten empfangen.
Ergebnisse des Programms
2022 hat die FDA einen Bericht über die bisherigen Erfahrungen mit dem Pre-Cert-Programm veröffentlicht. Ganz offen gesteht sie ein, dass das Experiment (methodisch) schwierig war, auch wegen der regulatorischen Rahmenbedingungen. Dennoch kann sie aus den Erfahrungen ableiten, dass für moderne Technologien neue Zulassungsverfahren hilfreich sind, die jedoch Gesetzesänderungen notwendig machen.
Selbst wenn das Experiment kein uneingeschränkter Erfolg war. Die FDA zeigt uns, wie man Regulierung vorantreibt: Durch einen wissenschaftlichen Ansatz (Regulatory Science), der sich auch des Experiments als Methode bedient.
Die Arbeit ist daher ein wichtiger Beitrag für eine evidenzbasierte Regulierung.
Fazit
Die FDA wird sicher nicht leichtsinnig. Aber sie erkennt, dass traditionelle Mechanismen zur Marktzulassung bei Software ungeeignet sind, weil sie zu schwergewichtig oder/und nicht wirkungsvoll sind. Die Balance aus Patientensicherheit und der zeitnahen Verfügbarkeit von Produkten war nicht mehr ausreichend gegeben.
Dass die Behörde von Vertrauen spricht, das Sie Firmen schenken will, ist ungewöhnlich und gleichzeitig auch begrüßenswert.
Wir dürfen gespannt sein, ob die europäischen Behörden ein vergleichbares „Precertification Program“ anbieten werden. Die Regel 11 der MDR deutet eher in die entgegengesetzte Richtung.
Versionshistorie:
- 2022-09-30: Ergebnisse der FDA aus 2022 ergänzt




