Die Norm ISO 15223-1 regelt die Symbole, die Hersteller zur Kennzeichnung von Medizinprodukten nutzen dürfen (bzw. müssen).
Die EU-Kommission hat im Januar 2022 die EN ISO 15223-1 als einige von relativ wenigen Normen unter der MDR harmonisiert und in die Liste harmonisierter Normen aufgenommen. Das allein macht deutlich, wie relevant die Kennzeichnung mittlerweile geworden ist.
Lesen Sie in diesem Artikel, was die ISO 15223-1:2021 wirklich beschreibt und fordert und woher Sie die Symbole beziehen können.
Update: Die geänderte Version von 2024 liegt als Entwurf vor (s. u.).
Regulatorischer Hintergrund
Die MDR verpflichtet die Hersteller, Informationen auf der Kennzeichnung bereitzuhalten (s. Anhang I, Abschnitt 23.2). Dazu zählen:
- Los- oder Seriennummer
- Haltbarkeit und/oder Herstelldatum
- Lagerbedingungen
- Tatsache, dass das Produkt ein Medizinprodukt ist
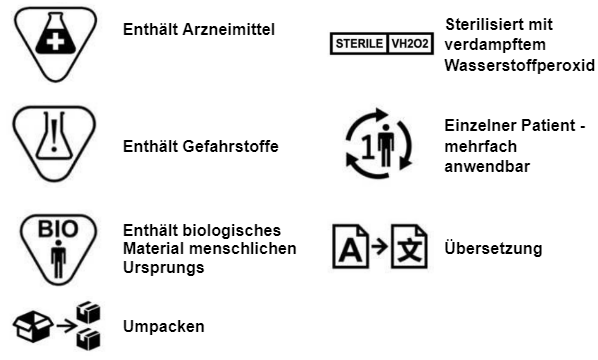
- Enthält Arzneimittel
- Enthält Gewebe oder Derivate menschlichen oder tierischen Ursprungs
- Enthält krebserzeugende, erbgutverändernde, fortpflanzungsgefährdende oder endokrin wirkende Stoffe
- Wurde sterilisiert
- Darf wiederverwendet werden oder eben nicht
- Ggf. den EU-Repräsentanten
Üblicherweise verwenden Hersteller Symbole, um diese Informationen klar verständlich und auf minimalem Platz zu kommunizieren. Diese Symbole wiederum werden durch Normen wie die ISO 15223-1 festgelegt. Daneben gibt es produkt- und prozessspezifische Normen wie die IEC 60601-1 mit Anforderungen an die zu verwendenden Symbole, welche aktuell (noch?) nicht harmonisiert sind.
Bedingt durch nationale Vorgaben der EU-Mitgliedsstaaten an die Begleitinformationen ist es notwendig, jede gemäß MDR regulatorisch notwendige Information in einer anerkannten Sprache (meist die Amtssprache(n)) bereitzustellen. Dies bedeutet, dass Informationen in Textform übersetzt werden müssen. Die Verwendung von anerkannten Symbolen erspart den Herstellern diesen Aufwand, zumindest für die Kennzeichnung. Die Gebrauchsanweisung muss dennoch ggf. übersetzt werden.
Über die ISO 15223-1
Aufbau der Norm
Die ISO 15223-1:2021 bzw. deren deutsches Pendant, die DIN EN ISO 15223-1:2022, ist mit 74 Seiten keine kurze Norm, durch die zahlreichen Tabellen jedoch recht übersichtlich:
- 22 Seiten dienen den Anhängen ZA und ZB, die das Mapping zwischen den Anforderungen der EU-Medizinprodukteverordnungen (MDR und IVDR) herstellen.
- Auf den nächsten zehn Seiten befinden sich das Vorwort, die Einleitung, Begriffsbestimmungen und wenige normative Forderungen wie etwa jene, die Größe der Symbole gemäß der vorgesehenen Funktion abzuleiten. Hier fordert die ISO 15223-1 auch, die Symbole auf dem Medizinprodukt, auf der Verpackung oder in den bereitgestellten Unterlagen (z. B. Gebrauchsanweisung) zu verwenden.
- Es folgen 25 Seiten Tabellen, die die Symbole und deren Bedeutung vorstellen.
- Weitere neun Seiten erläutern anhand von Beispielen die mögliche Verwendung.
- Der Rest des Umfangs entfällt auf Deckblätter und Verzeichnisse.
Neue Version 2021
Die aktuelle harmonisierte Version EN ISO 15223-1:2021 kommt mit einigen Neuerungen und insgesamt 25 neuen Symbolen daher.
Gegenüber DIN EN ISO 15223-1:2017-04 wurden folgende Änderungen vorgenommen:
- Aufnahme von 25 neuen Symbolen
- Aktualisierung der Begriffsbestimmungen unter Berücksichtigung von DIN EN ISO 20417, DIN EN ISO 14971 und DIN EN ISO 13485
- Überarbeitung der Anforderungen an die Verwendung von Symbolen (4.2) (u. a. wurde der erste Absatz mit ähnlicher Bedeutung komplett umformuliert. Außerdem „muss“ der Hersteller nun die angemessene Größe des Symbols festlegen, anstatt dies nur zu „sollen“.)
- Erweiterung der Beispiele im informativen Anhang A zu Hinweisen und Beispielen für die Verwendung von Symbolen, einschließlich der gemeinsamen Verwendung mehrerer Symbole
- Ergänzung der informativen Anhänge zum Zusammenhang zwischen dieser europäischen Norm und den grundlegenden Sicherheits- und Leistungsanforderungen der abzudeckenden Verordnung (EU) 2017/745 über Medizinprodukte sowie Zusammenhang zwischen dieser europäischen Norm und den grundlegenden Sicherheits- und Leistungsanforderungen der abzudeckenden Verordnung (EU) 2017/746 über In-vitro-Diagnostika
- Änderung des Titels in „Symbole zur Verwendung im Rahmen der vom Hersteller bereitzustellenden Informationen“
- Redaktionelle Überarbeitung
Nach Anhang I, Artikel 23.1 h) der Medical Device Regulation MDR – Medizinprodukteverordnung (2017/745) sind die entsprechenden neuen Symbole zwingend zu verwenden. Durch die Harmonisierung von EN ISO 15223-1:2021 ist es dabei nicht immer nötig, die in der Norm aufgeführten Symbole in der Gebrauchsanweisung zu erklären. Das gilt aber nur, wenn dies zu keinen höheren Risiken durch das Produkt führt. Ob dies der Fall ist, sollten Hersteller in Gebrauchstauglichkeitsstudien feststellen.
Ist das Produkt für Laienawender gedacht, müssen die Symbole immer erläutert werden. Hier können Hersteller nicht davon ausgehen, dass die Laien Symbole ohne Erklärung verstehen. Ob sich die zahlreichen neuen und sehr detaillierten Symbole in der Praxis ohne Laserdrucker anwenden lassen, bleibt abzuwarten – gerade wenn man bedenkt, dass der Implantationsausweis, für den einige Symbole wohl speziell kreiert wurden, die Größe einer Kreditkarte erhalten soll.
Die zusätzlichen Symbole sind die folgenden:
Änderung 2024
Auf Antrag der Europäischen Kommission soll die ISO 15223-1 geändert werden. Um Verwechslungen mit Ecuador (ISO 3166 ALPHA-2 Länder-Code EC) zu vermeiden, muss das Symbol für den EU-Repräsentanten von EC-REP zu EU-REP geändert werden.
Auch wenn es für Ecuador keine Verpflichtung gibt, den lokalen Repräsentanten auf dem Etikett anzuzeigen, ist es natürlich löblich, dieser möglichen Irreführung entgegenzuwirken. Die Änderung ist mit aktuell zehn Seiten (im Entwurf) sehr kurz und mit gut 40 € auch nicht extrem teuer.
Aber: Pro relevantem Buchstaben (U statt C) ist das wohl die teuerste Norm aller Zeiten. Diese Anpassung ist nicht sicherheitsrelevant, daher erschließt sich nicht, warum es explizit einer sofortigen Änderung bedarf und warum die Hersteller dafür zahlen sollen. Das Länderkürzel EC für Ecuador stammt schließlich bereits aus dem letzten Jahrtausend. Insbesondere, da viele Hersteller auf Symbole für das Inverkehrbringen von Systemen nach Artikel 22 der MDR oder für den Hinweis, dass Schnelltests nicht zur Eigenanwendung gedacht sind (Artikel 20.2 r) in Anhang I der IVDR), hoffen, um Text auf dem Etikett zu vermeiden.
Vom Kauf der Änderung raten wir entsprechend erst einmal ab. Wo Sie das Symbol erhalten, können Sie weiter unten nachlesen. Denken Sie aber daran, Ihre Technische Dokumentation entsprechend zu aktualisieren.
Beispiel für die Festlegung von Symbolen
Die ISO 15223-1:2021 legt die Anforderungen an die Darstellung und die Verwendung von Symbolen tabellarisch fest. Die Tabellen enthalten folgende Spalten:
- Bezugsnummer und Grafik
- Symboltitel
- Symbolbeschreibung
- Anforderungen
- Anmerkungen
- Einschränkung des Gebrauchs
- ISO/IEC-Symbolnummer und Registrierungsdatum
Hier ist ein Beispiel des Symbols „Hersteller“:
| Bezugsnummer und Grafik | Titel | Beschreibung | Anforderungen | Anmerkungen | Einschränkung des Gebrauchs | ISO/IEC-Symbolnummer und Registrierungsdatum | |
5.1.1 | Hersteller | Zeigt den Hersteller des Medizinprodukts an | Name und Anschrift des Herstellers müssen in unmittelbarer Nähe dieses Symbols angegeben werden. | ANMERKUNG 1: Dieses Symbol wird verwendet, um Informationen anzuzeigen, die in Europa erforderlich sind und von anderen zuständigen Behörden gefordert werden können. […] | – | ISO 7000-3082 2011-10-02082 2011-10-02 |
Die DIN ISO 7000 trägt den Titel „Graphische Symbole auf Einrichtungen“. Die darin definierten Symbole beschränken sich keinesfalls auf den Bereich der Medizinprodukte.
Die Webseite der ISO listet alle Symbole:
Die ISO bietet diese zum Kauf an. Eine kostenfreie Publikation von MedTechEurope enthält die meisten Symbole.
Änderungshistorie
- 2024-08-22: Abschnitt Änderung 2024 hinzugefügt, Verweise auf ISO 980 entfernt, Hinweis auf nationale Vorgaben ergänzt, Wording an ISO 15223-1:2021 angepasst
- 2022-08-17: Hinweise zur Version aus 2021 ergänzt
- 2021-11-30: Publikation von MedTechEurope ergänzt
- 2021-08-17: Abschnitt „Neue Version 2021“ aktualisiert





In der kürzlich veröffentlichten Liste der harmonisierten Normen OJ C 149 of 16/05/2014 wird die EN 980:2008 wieder angeführt (die EN ISO 15223-1 jedoch nicht).
Danke, ein ganz wichtiger Hinweis, lieber Herr Wrodnigg!
Dies ist scheinbar auch 2017 noch nicht geändert.
Auch unser Auditor will von uns nach wie vor die EN 980:2008 angeführt haben.
In der veröffentlichten Liste der harmonisierten Normen OJ C 149 scheint die EN 980:2008 auf, die EN ISO 15223-1 nicht
Der Harmonisierungsprozess ist leider (weitgehend) zum Erliegen gekommen. Daher gibt es oft keine aktuellen Normen in der Liste der harmomisierten. Viele benannte Stellen verlangen aber die neusten Versionen. Dabei gehen sie aber leider nicht einheitlich vor, was das Konzept der Harmonisierung ad absurdum führt.
Ist ein Symbol geplant für ‚Das ist ein Medizinprodukt‘ nach MDR 2017/745?
Nein, das ist mir nicht bekannt.
Müssen Symbole, die in der EN ISO 15223-1 aufgeführt sind, in der Gebrauchsanweisung nochmals erklärt werden?
D.h. muss dort das Symbol für Hersteller (schwarze Fabrik) aufgeführt sein mit der oben stehenden Erklärung „Zeigt den Hersteller des Medizinprodukts nach den EU-Richtlinien 90/385/EWG, 93/42/EWG, 98/97/EG“.
Oder reicht hier das Aufführen des Herstellers mit Anschrift (ohne schwarze Fabrik) aus? Die Grundlegenden Anforderungen lassen hier Spielraum zur Interpretation wie ich meine.
Die Symbole, die etwas mit der Risikobeherrschung zu tun haben wie Warnungen müssen Sie erklären.
Bei einem Symbol wie dem Fabriksymbol sollte eh „Hersteller“ dabei stehen. Daher sehe ich keine Notwendigkeit, diese in der GA nochmals erläutern.
Da die Frage schon über ein Jahr her ist bezüglich „ist ein Symbol geplant für ‚Das ist ein Medizinprodukt“: Gibt es da Neuigkeiten? Bzw. wie kann man das handhaben? Das Symbol der FDA (Rx only; bei Produkten wo das passt) nutzen und in der IFU erklären? Oder „MD“ schreiben und in der IFU erklären?
Lieber Herr Kuerschner,
mir ist das Symbol noch nicht bekannt. Danke für Ihr Nachfragen. Sobald ich etwas weiß, gebe ich Bescheid.
Nochmals besten Dank!
Viele Grüße, Christian Johner
Hallo Herr Kuerschner, hallo Herr Prof. Johner,
MedTech Europe hat im Mai 2019 ein Guidance-Dokument dazu veröffentlicht, wie das MD-Symbol „sehr wahrscheinlich“ aussehen wird.
https://www.medtecheurope.org/wp-content/uploads/2019/05/191217_MD-labelling_Symbols-guidance_REVISED_FINAL.pdf
In dem Guidance-Dokument ist aber selbst geschrieben, dass die finale Revision der ISO 15223-1 noch nicht veröffentlicht ist und das Symbol im Endergebnis anders aussehen könnte.
Auf Nachfrage beim DIN wurde mir gesagt, dass im Oktober/November das Treffen für die Entwurfsabstimmung der Norm stattfindet, dann wird international darüber abgestimmt, sodass vermutlich Anfang 2021 mit der Veröffentlichung gerechnet werden kann.
Beste Grüße
Martin von Rüden
Danke für Ihren sehr wertvollen Beitrag, lieber Herr von Rüden!
Dieser Hinweis interessiert die Leser sehr. Ich werde den Beitrag zeitnah überarbeiten und im Instituts-Journal darauf hinweisen.
Herzlichen Dank für Ihre Hilfe!
Viele Grüße, Christian Johner
Liebes Team,
haben Sie Informationen, ob ein Symbol für die Kennzeichnung der Sterilverpackung zur Erfüllung MDR, Anhang I, 23.3 a) in Arbeit ist?
Herzlichen Dank
Anna Schade
Liebe Frau Schade,
das Symbol für „Sterile“ bleibt unverändert. Hier erwarte ich keine Änderung.
Jetzt hoffe ich, dass ich Ihre Frage richtig verstanden und beantwortet habe.
Viele Grüße, Christian Johner
Sehr geehrte Damen und Herren,
wenn ich Sie richtig verstanden habe gibt die ISO 15223-1 vor, welche Symbole auf einem Produktlabel sein sollten. So auch das Symbol oben links in Abbildung 3 – „MD“ für Medical Device. Das Symbol besteht aus den Buchstaben M und D.
Aus einer Recherche geht hervor, dass die Firma Olympus die Buchstabenkombination MD als Wortmarke angemeldet hat (siehe https://register.dpma.de/DPMAregister/marke/register/2910107/DE). Gemäß der Nizza Klasse 10 schränken sie sich dabei zwar auf Endoskope und andere ähnliche Geräte ein, dennoch beinhaltet die Klasse 10 weitaus mehr Produkte als nur Endoskope. Rechtlich gesehen könnte dies Probleme bereiten.
Wie sollen wir Unternehmen mit der geschützten Marke umgehen? Kann das MD-Symbol dennoch auf den Labels verwendet werden, ohne dass hier rechtliche Schritte seitens Olympus eingeleitet werden?
Ich freue mich auf eine Rückmeldung. Vielen Dank im Voraus.
Mit freundlichen Grüßen
Jennifer Biendara
Sehr geehrte Frau Biendara,
das ist eine spannende Frage! Danke!
Ich bin kein auf das Markenrecht spezialisierter Jurist. Aber die Firma würde sich meines Erachtens keinen Gefallen damit tun, die Verwendung des Symbols MD einzuklagen, da das als Konsequenz die Löschung der Marke bedeuten könnte. Das MD-Symbol ist ein offizielles und in einer Norm veröffentlichtes. Daher wäre es meine Empfehlung, es auch zu verwenden.
Ich kenne Olympus nicht als eine Firma, die Medizinproduktehersteller abmahnen würde, weil die ihre gesetzliche Pflicht erfüllen.
Beste Grüße, Christian Johner
Hallo Hr. Prof. Johner,
Sie beziehen sich bei der regulatorischen Forderung nach Kennzeichnung als Medizinprodukt im Rahmen der MDR auf Anhang I, Abschnitt 23.2 q. (nicht wie angegeben 23.2 f.), richtig?
Freundliche Grüße
Lieber Herr Stadler,
es ist sogar beides richtig: 23.2.q mit dem Medizinprodukte, 23.2.f mit Informationen zu bestimmten stofflichen Produkten. Man müsste aber auch 23.2.e) erwähnen, weshalb ich nun einfach nur noch von 23.2 spreche.
Danke für Ihren wichtigen Hinweis, der mir geholfen hat, den Beitrag zu optimieren!
Herzliche Grüße, Christian Johner
Sehr geehrter Herr Johner,
lt. ISO 15223-1 muss die Herstelleradresse in unmittelbarer Nähe vom Herstellersymbol angeführt werden. Da wir ein rundes Etikett haben, würden wir gerne unter dem Herstellersymbol die Adresse in einem runden Bogen an der Außenkante des Etiketts aufdrucken. Da keine Angabe gemacht wird, in welcher Form (geschwungen, gerade,…) und wo (neben, unter, über dem Symbol) die Adresse angeführt werden muss, sollte das OK sein, oder?
Ist die Mindestgröße der Symbole irgendwo definiert? Ich kenne nur die Angabe für das CE Symbol.
Bis jetzt haben wir das so überprüft, dass wir die Ausdrucke auf Druckqualität und Lesbarkeit überprüft haben. Ist das ausreichend? Oder gibt es hierzu andere Empfehlungen?
Vielen Dank für Ihre Unterstützung!
Beste Grüße,
Karl-Heinz
Besten Dank für Ihre Frage!
Mir ist keine Vorgabe bekannt, die Ihrem Plan widerspricht. Die Lesbarkeit ist i.d.T. das Kriterium. Meines Wissens gibt es keine Vorgabe bezüglich der Schriftgröße. Die ISO 9241 hat einen Teil, in der sie Schriftgrößen in Abhängigkeit vom Leseabstand empfiehlt.
Viele Grüße, Christian Johner
Sehr geehrter Herr Johner,
vielen Dank für Ihre rasche Antwort und Hilfe!
Beste Grüße,
Karl-Heinz
Sehr geehrter Herr Johner,
gibt es eine Vorgabe welche Symbole zwingend erforderlich sind für die Kennzeichnung eines MD ?
Vielen Dank und viele Grüße
Melanie
Sehr geehrte Melanie,
danke für Ihre Frage!
Eine generelle Antwort auf diese Frage gibt es leider nicht, da für unterschiedliche Produkte unterschiedliche Normen und Gesetze greifen. Diese fordern teilweise unterschiedliche Symbole. Die Produktklasse wirkt sich auch direkt auf die Symbole aus. Beispielsweise muss ein Einmalprodukt als solches gekennzeichnet sein.
Zum zweiten hängt die Antwort vom Risiko des jeweiligen Produkts ab. Die Symbole dienen v.a. dazu, auf diese Risiken hinzuweisen und diese damit zu minimieren.
Das „MD“ Symbol wird man aber künftig auf allen Produkten erwarten. Die neue ISO 15223-1 hat es mit eingeführt.
Hilft das? Falls nicht, haken Sie gerne nach.
Viele Grüße, Christian Johner
Sehr geehrter Herr Johner,
für einige der dort genannten Symbole fordert die ISO 15223-1 die Erklärung des Symbols „in den durch den Hersteller bereitgestellten Informationen“. So muss z.B. das Symbol „Bei beschädigter Pkg. nicht verwenden“ durch diesen Text in der Kennzeichnung erläutert werden (GA oder Etikett usw.). Ist die Annahme korrekt, dass diese Erläuterung in der Landessprache des Anwenders zu erfolgen hat. Anders gefragt, wenn statt des Symbols der Text in englischer Sprache auf einer Pkg. erscheint, kann die bekannte Anforderung an Übersetzung z.B. in das Deutsche nicht entfallen – korrekt?
Sehr geehrter Herr Ehret,
vielen Dank für Ihre Frage.
Laut MDR müssen Angaben in Form von international anerkannten Symbolen gemacht werden, wo dies möglich ist (Anhang I 23.1 h). Sollte es für Angaben entsprechende Symbole geben, wäre reiner Text also nicht zulässig.
Sie dürfen allerdings die Symbole mit zusätzlichem, erläuterndem Text versehen.
Laut MDR muss die Kennzeichnung, wozu auch Angaben auf der Verpackung und die Gebrauchsanweisung gehören, in den jeweiligen Amtssprachen der Zielländer bereitgestellt werden (Artikel 10, Absatz 11).
Um auf Ihre Frage zu antworten: Erstens wäre es nicht zulässig, auf das Symbol zu verzichten und nur den entsprechenden Text anzubringen und zweitens müsste der Text in den jeweiligen Amtssprachen der Zielländer bereitgestellt werden.
Ich hoffe meine Antwort hilft Ihnen weiter. Ansonsten fragen Sie gerne nach.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Becker,
ja das hilft mir sehr. Haben Sie vielen Dank für die schnelle Antwort.
Freundliche Grüße,
Andreas Ehret
Sehr geehrter Herr Johner,
das MD Symbol ist mit der neuen Verordnung Pflicht auf jedem Etikett und jeder Verpackung.
Mir ist nicht ganz klar ob das MD-Symbol, wie das CE Zeichen, direkt auf dem Medizinprodukt angebracht werden muss?
Vielen Dank und viele Grüß
Lena
Sehr geehrte Frau Lena,
die Kennzeichnung muss generell immer, wenn möglich und sinnvoll, direkt auf dem Produkt angebracht werden. Die Kennzeichnung enthält dabei alle notwendigen Symbole (somit auch das MD-Symbol), Warnungen und Hinweise. Sicherlich ist es nicht immer sinnvoll, sämtliche Informationen auf dem Produkt anzugeben, insbesondere wenn dieses klein ist.
Beste Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
wann gilt denn ein Etikett als „klein“?
Die Frage zielt darauf ab, dass man nach EN ISO 18113-1 auf kleinen Etiketten bei den Primärgefäßen auf bestimmte Angaben verzichten kann.
Guten Tag!
Hierzu gibt es leider keine genaue Größenvorgabe. Am Ende ist das „Auslagern“ von Informationen – entschuldigen Sie bitte die Floskel – risikobasiert zu bewerten. Welche Informationen müssen Sie zwingend auf dem Primäretikett anbringen, um eine sichere Verwendung zu gewährleisten? Könnten Sie auf ein größeres Etikett (z.B. Faltetikett) alle Informationen aufbringen, ohne die Handhabung negativ zu beeinflussen? Müssten Sie bei kritischen Risiken evtl. sogar einen größeren Primärbehälter wählen, um alle Informationen direkt aufzubringen?
Lässt sich auf dem Etikett nicht alles in einer ausreichenden Größe aufbringen, um es ohne Zuhilfenahme einer Lesehilfe zu identifizieren, und trifft nichts vom oben erwähnten zu bzw. wäre nicht zielführend, so würde ich von einem kleinen Etikett sprechen und Sie könnten die Informationen gemäß EN ISO 18113-1 zumindest dort weglassen.
Ich hoffe diese etwas schwammige Antwort hilft Ihnen dennoch ein wenig weiter.
Herzliche Grüße
Christopher Seib
Sehr geehrter Herr Dr. Johner,
ist es verpflichtend das Symbol 5.4.3 Gebrauchsanweisung beachten der ISO 15223-1 auf die Gebrauchsanweisung aufzubringen? Muss dieses Symbol dann ebenfalls auf dem Etikett es Produktes angebracht werden?
Viele Grüße
Lena Schneider
Sehr geehrte Frau Schneider,
als Experte für Gebrauchsanweisungen beim Johner Institut antworte ich gerne auf Ihre Frage.
In der MDR heißt es: „Wo dies angebracht ist, werden die vom Hersteller bereitgestellten Angaben in Form von international anerkannten Symbolen gemacht.“. Somit ist die Verwendung von Symbolen nicht per se verpflichtend.
Symbole sollen vor allem dazu dienen, ohne textliche Beschriftung den Anwendern Hinweise und Informationen zu liefern. In der Gebrauchsanweisung ist die Verwendung von Symbolen häufig nicht nötig, wenn entsprechende Hinweise eindeutig und für den Nutzer verständlich textlich vermittelt werden. Ob Sie in Ihrer Gebrauchsanweisung Symbole verwenden sollten, prüfen Sie letztendlich in einer Risikoanalyse.
Auf der Kennzeichnung (Etikett), sollten Sie für alle in der MDR geforderten Angaben bzgl. der Kennzeichnung (siehe Anhang I 23.2) entsprechende Symbole verwenden (falls verfügbar), damit wichtige Hinweise eindeutig und ohne Text dem Anwender schnell vermittelt werden können.
Falls Sie in Ihrer Risikoanalyse feststellen, dass der Anwender vor Benutzung des Produkts die Gebrauchsanweisung lesen muss, sollten Sie darauf auf der Kennzeichnung mit dem entsprechenden Symbol 5.4.3 der ISO 15223-1:2020 aufmerksam machen.
Ich hoffe, meine Antwort hilft Ihnen weiter. Ansonsten fragen Sie gerne nach.
Beste Grüße
Nils
Hallo Nils,
Hinweis: mit Herausgabe des Amendment 2 der IEC 60601-1 sollte ja sogar das „lesende Männchen“ (M002, ISO 7010) wieder verwendet werden, sofern in der Risikoanalyse die IFU als eine Maßnahme gefunden wurde.
Beste Grüße,
Carsten
Sehr geehrter Herr Dr. Johner,
kennen Sie ein harmonisiertes Symbol zur Anzeige der Mengenangabe. Wir als Hersteller drucken auf unsere Etiketten die Mengenangabe mit Qty.: 100 pc. Dies ist jedoch nicht in allen Sprachen verständlich. Hier würde ein harmonisiertes Symbol sehr hilfreich sein.
Viele Grüße
Lena Schneider
Sehr geehrte Frau Schneider,
als Experte für Kennzeichnung beim Johner Institut antworte ich gerne auf Ihre Frage.
Leider ist mir auch kein (unter der MDD/MDR) harmonisiertes Symbol zur Angabe der Stückzahl bekannt. Viele Hersteller geben auf Ihrer Verpackung einfach die Stückzahl in Ziffern an, ohne weitere Beschriftung oder Symbol. Falls die Angabe der Stückzahl mit einem Risiko verbunden ist, sollte der Hersteller die angedachte Lösung im Rahmen seines Risikomanagements bewerten.
Für IVDs kennt die ISO 15223-1:2020 ein Symbol, mit welchem gekenzeichnet werden kann, für wie viele Tests der Inhalt der Verpackung ausreicht (unter 5.5.5). Die ISO 7000 enthält zudem ein Symbol mit der Referenznummer 2794, mit welchem die Stückzahl angegeben werden kann. Dieses Symbol findet allerdings eher im Dentalbereich Verwendung.
Ich hoffe, meine Antwort hilft Ihnen weiter, ansonsten fragen Sie gerne nach.
Herzlich Grüße
Nils Becker
Sehr geehrter Herr Becker,
vielen Dank für die schnelle und ausführliche Antwort.
Diese hat mir weitergeholfen.
Viele Grüße
Lena Schneider
Sehr geehrter Herr Johner,
gemäß MDR müssen alle Informationen der IFU und des Labels in der Amtssprache der Mitgliedsstaaten bereitgestellt werden, in denen die Produkte verfügbar sind. Bis auf einige wenige Angaben werden auf den Labels üblicherweise Symbole – soweit möglich – aus harmonisierten Normen verwendet.
Muss auch der Produktname auf dem Label in die Amtsprachen der Mitgliedsstaaten übersetzt werden?
Viele Grüße
Juliane Dragon
Sehr geehrte Frau Dragon,
als Experte für Kennzeichnung beim Johner Institut antworte ich gerne auf Ihre Frage.
Produktnamen sind häufig Eigennamen und müssen oder können nicht unbedingt übersetzt werden.
Die MDR fordert allerdings in Anhang I unter 23.2 „alle unbedingt erforderlichen Angaben [auf dem Label], aus denen der Anwender ersehen kann, worum es sich bei dem Produkt, dem Packungsinhalt sowie der Zweckbestimmung eines Produkts, sofern diese für den Anwender nicht offensichtlich ist, handelt;“ Häufig gehen diese Informationen schon aus dem Produktnamen hervor. Sollte der Produktname für die vorgesehenen Anwender in der Originalsprache nicht verständlich sein und die Zweckbestimmung auch sonst nicht offensichtlich sein, sollten Sie zumindest ein paar entsprechende Hinweise in der geforderten Sprache des Ziellandes geben.
Ich hoffe, das beantwortet Ihre Frage. Ansonsten haken Sie gerne nach.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Johner,
wir versuchen gerade die Draftversionen der ISO 15223-1 und der ISO 20417 zu entschlüsseln. Wir sind Hersteller unserer Produkte, lassen aber ausserhalb der EU fertigen. Müssen wir neben dem „Hersteller“-Symbol auch das „Importer“-Symbol aufbringen?
… Und da wir auch Vertreiber unserer Produkte sind, womöglich auch noch das „Distributor“-Symbol? Oder erübrigt sich das mit dem Herstellersymbol, wenn wir alles in einem sind? Alle drei Symbole nebeneinander macht so den Eindruck von Schilderwald.
Vielen Dank im Voraus für die Antwort
Beste Grüße
Nicole
Sehr geehrte Nicole, Ihre Frage kam an. Ich weiß nicht, ob wir es heute schon schaffen, könnte Anfang nächster Woche werden. Danke für die spannende Frage!
Sehr geehrte Damen und Herren,
ist der Hersteller verpflichtet die KENNZEICHNUNG EN 455 auf den Boxen drucken zu lassen bzw. auf den Boxen anzugeben?
Liebe Grüße
Sehr geehrter Herr Haque,
Hersteller sind nicht verpflichtet, Normen auf die Boxen zu drucken. Auch nicht die Nummer der Norm für Einmalhandschuhe.
Beste Grüße, Christian Johner
Sehr geehrte Damen und Herren,
gibt es eigentlich Neuigkeiten bezüglich des Abstimmungsprozesses der ISO 15223-1, die bis zum 14.05.2020 zur Abstimmung gestellt worden war?
Dürfen/müssen die Symbole (z.B. [MD] oder [UDI]) auch schon vor Harmonisierung verwendet werden?
Mit freundlichen Grüßen.
Lieber Leser,
vielen Dank für Ihre spannende Frage!
Leider sind mir auch keine Neuigkeiten bezüglich des Abstimmungsprozesses der ISO 15223-1 bekannt. Der ISO-Webseite ist zu entnehmen, dass die Abstimmung erst noch bevorsteht (Stand 26.01.2021).
Ich würde empfehlen, bereits jetzt die Symbole der Pre-Version zu verwenden, selbst wenn die Norm noch nicht publiziert und unter MDR harmonisiert ist. Viele Benannte Stellen fordern das sogar.
Ich würde unbedingt empfehlen, auch die Symbole der 15223-1 in der Gebrauchsanweisung zu erklären. Einige der (neuen) Symbole dürften noch nicht allen Nutzern bekannt sein.
Herzliche Grüße
Nils Becker
Sehr geehrte Damen und Herren,
wissen Sie, ob es bereits eine Tendenz für ein Inkrafttreten der aktuell noch im Entwurf befindlichen ISO 15223-1:2020 gibt? Also genau gefragt, wissen Sie in wie weit die aktuell noch im Entwurf gefassten Symbole für MD und auch UDI tatsächlich so aufgenommen werden und ab Mai dann auch auf Medizinproduktlabeln so geführt werden sollten?
Hierzu finde ich leider keine expliziten Angaben und der Entwurf der aktualisierten ISO 15223 schwebt nun ja bereits schon etwas länger.
Vielen Dank für Ihre Hilfe!
MfG
K. Porth
Liebe/r Leser/in,
danke für Ihre Frage! Ich erlaube mir, meine Antwort auf genau die gleiche Frage zu diesem Blogartikel zu kopieren:
„Leider sind mir auch keine Neuigkeiten bezüglich des Abstimmungsprozesses der ISO 15223-1 bekannt. Der ISO-Webseite ist zu entnehmen, dass die Abstimmung erst noch bevorsteht (Stand 26.01.2021).
Ich würde empfehlen, bereits jetzt die Symbole der Pre-Version zu verwenden, selbst wenn die Norm noch nicht publiziert und unter MDR harmonisiert ist. Viele Benannte Stellen fordern das sogar.
Ich würde unbedingt empfehlen, auch die Symbole der 15223-1 in der Gebrauchsanweisung zu erklären. Einige der (neuen) Symbole dürften noch nicht allen Nutzern bekannt sein.“
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Johner,
ich wollte mich erkundigen, ob es bereits eine Antwort auf folgende ältere Anfrage gibt: „Nicole | Freitag, 18. Dezember 2020 um 09:19 Uhr „.
Wir haben eine ähnliche Situation. Wir kaufen Zubehör aus Asien für unsere Cardiometer ein, welches wir an verschiedene Kunden weltwelt weiter verkaufen. Müsste dieses dann das „Importer“ und das „Distributor“ Symbol erhalten?
Des Weiteren hatte ich mich heute auf der ISO-Website (https://www.iso.org/standard/77326.html) nach dem aktuellen Stand der Ed. 4 erkundigt und überrascht festgestellt, dass der Status immer noch auf „Under development“ steht. Gibt es von irgendeiner Seite aus einen Hinweis, dass die aktuelle draft-Version zum Geltungsbeginn der MDR im Mai diesen Jahres als bindend angesehen werden muss?
Vielen Dank und freundliche Grüße
Stefan Ribbe
Sehr geehrter Herr Ribbe,
gerne antworte ich Ihnen anstelle von Herrn Johner.
Wenn Sie ein Produkt in die EU importieren, müssen Sie „auf dem Produkt oder auf seiner Verpackung oder auf einem dem Produkt beiliegenden Dokument ihren Namen, ihren eingetragenen Handelsnamen oder ihre eingetragene Handelsmarke, ihre eingetragene Niederlassung und die Anschrift an[geben], unter der sie zu erreichen sind, […]“ (siehe MDR Artikel 13 Absatz 3).
Weiter formuliert die MDR etwas schwammig in Anhang I 23.1 h: „Wo dies angebracht ist, werden die vom Hersteller bereitgestellten Angaben in Form von international anerkannten Symbolen gemacht.“
Falls Sie die Angaben zum Importeur auf der Verpackung oder dem Produkt angeben, würde ich Ihnen empfehlen, das entsprechende Symbol der ISO 15223-1 zu verwenden (das ist aber regulatorisch nicht verpflichtend).
Der Händler muss nur auf dem Produkt bzw. der Verpackung angegeben werden, wenn er die Gebrauchsanweisung bereitstellt und übersetzt oder etwas an der Verpackung ändert. In dem Fall würde ich Ihnen ebenfalls empfehlen, dass entsprechende Symbol zu verwenden.
Zu der Ed. 4 der ISO 15223-1 liegen mir leider auch keine weiteren Informationen vor. Die Harmonisierung der Normen unter MDR ist in naher Zukunft auch nicht zu erwarten (siehe https://www.johner-institut.de/blog/regulatory-affairs/harmonisierte-normen/). Dennoch würde ich Ihnen empfehlen, die Anforderungen der Normen (auch der Entwürfe) zu erfüllen, da dies de facto von einigen benannten Stellen gefordert wird.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Johner,
wir haben gerade wieder eine Frage, auf die wir keine Antwort finden und wären sehr dankbar, wenn Sie uns diesbezüglich weiterhelfen könnten!
Wir haben eine Frage bezüglich der Etiketten: unsere Produkte sind unter MDD zertifiziert und unser Zertifikat hat noch eine Gültigkeit von etwa zwei Jahren. Müssen die Etiketten dann trotzdem bereits ab dem 26.05.2021 die Information enthalten, dass es sich um ein Medizinprodukt handelt und das Symbol tragen, dass es sich um ein Medizinprodukt handelt?
Wir wären für eine Beantwortung dieser Fragen sehr dankbar!!!
Mit freundlichen Grüßen
Katrin Münster
Qualitätsmanagement
Sehr geehrte Frau Münster,
gerne antworte ich Ihnen als Experte fürs Labelling beim Johner Institut anstelle von Herrn Johner.
Die MDD stellt im Gegensatz zur MDR nicht die Anforderung, dass die Kennzeichnung die Information enthalten muss, dass es sich um ein Medizinprodukt handelt. Solange Ihr „MDD“-Zertifikat für Ihr Produkt noch gültig ist, müssen Sie diese Angabe folglich auch nicht machen.
Zudem können Sie, müssen aber nicht, für die Angabe, dass es sich um ein Medizinprodukt handelt, das entsprechende Symbol der 15223-1 verwenden. Die MDR schreibt lediglich, dass Symbole verwendet werden können, „wo dies angebracht ist“. Auch die neu erschienene ISO 20417:2021 spricht von „may“ und nicht „shall“ in diesem Zusammenhang.
Ich hoffe meine Antwort hilft Ihnen weiter. Falls nicht, fragen Sie gerne nach.
Herzlich Grüße
Nils Becker
Hallo liebes Johner-Team!
Kennen Sie irgendwelche Vorgaben bzw. Einschränkungen hinsichtlich der Farbgebung von Symbolen? Oder anders gefragt, kann man Symbole in einer beliebigen Farbe auf ein MP-Etikett anbringen (unter Berücksichtigung der Gebrauchstauglichkeit)?
Vielen Dank und beste Grüße
Gitte Graubner
Sehr geehrte Frau Graubner,
Sie können die Symbole in einer beliebigen Farbe anbringen, solange die Symbole erkennbar und verständlich bleiben. Die prEN ISO 15223-1:2020 schreibt in Kapitel 4.2 b explizit, dass sie keine Vorgaben zur Farbwahl und Größe der in dieser Norm spezifizierten Symbole macht.
Herzliche Grüße
Nils Becker
Hallo Herr Becker,
ergänzend zur Frage von Frau Gaubner:
Wenn die Farbwahl nicht festgelegt ist, folgt daraus, dass auch Negativdrucke erlaubt sind? Ein Negativdruck entspricht schließlich einem Druck in weißer Farbe auf farbigem/schwarzen Hintergrund.
Viele Grüße
Marek Deckena
Lieber Herr Deckena,
Sie haben vollkommen recht. Da es keine regulatorischen Vorgaben zur Farbwahl der Symbole gibt, sind auch Negativdrucke erlaubt.
Herzliche Grüße
Nils Becker
Liebes Johner-Team,
MUSS hinter der Symbol „LOT“ direkt die Losnummer aufgebracht werden?
Oder besteht auch die Möglichkeit, direkt hinter dem Symbol „LOT“ den Verweis „siehe XY(Ort der Aufbringung)“ zu nennen?
Viele Grüße
Liebe Bettina,
vielen Dank für Ihre Frage.
laut der ISO 15223-1 muss die Losnummer unmittelbar in der Nähe des Symbols stehen. Ein Verweis auf eine andere Stelle wäre nicht zulässig.
Herzliche Grüße
Nils Becker
Sehr geehrte Damen und Herren,
meines letzten Standes bzgl des Aufbringens des Herstellungsortesherrschte Uneinigkeit über die Notwendigkeit der Deklaration (bspw „Made in China“).
Hier bin ich mir unsicher, ob ich hier korrekt informiert bin. Können Sie mir hier weiterhelfen?
Herzliche Grüße
Sehr geehrte Frau Caesar,
vielen Dank für Ihre Frage!
Es gibt keine regulatorische Pflicht, den Herstellungsort anzugeben. Weder die MDR noch die ISO 20417 verlangen dies. Sie können den Herstellungsort aber natürlich angeben, falls Sie das möchten, und dazu das Symbol 5.1.11 der ISO 15223-1 verwenden. Alternativ kann auch die Angabe „Made in XX“ gemacht werden, wobei XX den Ländercodes nach ISO 3166-1 entsprechen sollte.
Ich hoffe, meine Antwort hilft Ihnen weiter.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Johner,
anbei möchte ich nochmal auf die Frage von Herrn Kuerschner aus dem Jahr 2019 zurückkommen.
hier meine Frage:
Gibt es eine Regelung zur Benutzung des Symbol “ Rx only“ auf einem Medizinprodukt ( Label )? Bezeichnet dieses Symbol das es sich um ein Medizinprodukt handelt? Oder nur von einem Fachpersonal benutzt werden darf? oder ist das nur ein notwendiger Hinweis/ Symbol der FDA und kann außerhalb der USA außeracht gelassen werden ?
vielen Dank im Voraus
Sascha Voigt
hier nochmal die Frage aus 2019.
Da die Frage schon über ein Jahr her ist bezüglich „ist ein Symbol geplant für ‚Das ist ein Medizinprodukt“: Gibt es da Neuigkeiten? Bzw. wie kann man das handhaben? Das Symbol der FDA (Rx only; bei Produkten wo das passt) nutzen und in der IFU erklären? Oder „MD“ schreiben und in der IFU erklären?
Prof. Dr. Christian Johner | Dienstag, 25. Juni 2019 um 11:47 Uhr – Antworten
Lieber Herr Kuerschner,
mir ist das Symbol noch nicht bekannt. Danke für Ihr Nachfragen. Sobald ich etwas weiß, gebe ich Bescheid.
Nochmals besten Dank!
Viele Grüße, Christian Johner
Lieber Herr Voigt,
das Rx Symbol steht gemäß 21 CFR section 801.109 für „Caution: Federal law restricts this device to sale by or on the order of a physician / dentist.“. Demzufolge geht es nur um den Nutzen, nicht darum, ob es ein Medizinprodukt ist (auch wenn es das impliziert). Das Symbol ist nur von der FDA anerkannt und hat im Rest der Welt keine Bedeutung bzw. ist nicht verpflichtend. Natürlich kann das Symbol auch anderswo verwendet werden, wenn es erklärt wird, und muss nicht zwangsläufig entfernt werden. Das MD Symbol hingegen ist in der neuen ISO 15223-1 enthalten und muss daher in Europa (die MDR verlangt eine entsprechende Kennzeichnung auf dem Label) verwendet werden oder alternativ ein Textstring. In den USA ist das MD Symbol jedoch nicht relevant.
Liebe Grüße
Philipp Schleer
Hallo Herr Schleer,
vielen Dank für die Antwort,
im Bezug auf dem Textstring anstelle dem MD Symbol, wie muss der Hinweis z.B. aussehen oder was muss er enthalten?
vielen Dank im Voraus.
Lieber Herr Voigt,
leider gibt es hierzu keine klaren Vorgaben. Aber um eine Medizinprodukt als solches zu kennzeichnen wäre der Ausdruck „Medizinprodukt“ am geeignetsten.
Liebe Grüße
Philipp Schleer
Sehr geehrter Herr Johner und Mitarbeitende,
wenn eine Behandlungseinheit aus verschiedenen Produkten zusammengestellt wird, die ihrerseits das MD- oder das IVD-Symbol tragen, müssen beide Symbole entsprechend auf die Umverpackung der Behandlungseinheit gedruckt werden oder überwiegt eines das andere?
VG
Marek Deckena
Liebe Frau Deckena,
die MDR schreibt in Artikel 22(5) „Systeme oder Behandlungseinheiten selber werden nicht mit einer zusätzlichen CE-Kennzeichnung versehen; sie tragen jedoch den Namen, den eingetragenen Handelsnamen oder die eingetragene Handelsmarke der in den Absätzen 1 und 3 des vorliegenden Artikels genannten Person sowie die Anschrift, unter der diese Person zu erreichen ist, so dass der tatsächliche Standort der Person ermittelt werden kann.“ Auch die IVDR oder die ISO 15223-1 geben hierzu keine konkrete Vorgaben. Demzufolge sind Name sowie Anschrift ausreichend und die Behandlungseinheit muss weder das MD- noch das IVD-Symbol tragen.
Liebe Grüße
Philipp Schleer
Hallo Herr Schleer,
vielen Dank für die Info. Das heißt demzufolge das nur das Symbol „MD“ oder die Beschreibung als solches “ Medizinprodukt“ als Aussage gilt das es sich um Medizinprodukt handelt. eine UDI nummer oder das CE XXXX zählt als solches nicht. korrekr?
vielen Dank im Voraus.
Sascha Voigt
Lieber Herr Voigt,
korrekt, die MDR fordert explizit die Angabe, dass es sich bei dem Produkt um ein Medizinprodukt handelt.
Liebe Grüße
Philipp Schleer
Sehr geehrter Herr Schleer,
ich entnehme Ihrer Aussage, dass aktuell also entweder das „MD“ Symbol oder ein entsprechender Hinweistext, dass es sich um ein Medizinprodukte handelt, regulatorisch korrekt sind?
Beste Grüße
Jens Meyer
Sehr geehrter Herr Meyer,
da liegen sie vollkommen richtig.
Liebe Grüße
Philipp Schleer
Sehr geehrte Damen und Herren,
ich hätte eine Frage zum Symbol „Gebrauchsanweisung lesen“ auf dem Label.
Wir verwenden bisher die Symbole 5.4.3 (Gebrauchsanweisung lesen) sowie 5.4.4 (Achtung) der ISO 15223-1 auf unserem Produkt, um den Anwender darauf aufmerksam zu machen, dass er die Gebrauchsanweisung sowie deren Sicherheitshinweise beachten muss.
Dabei muss man anmerken, dass wir die IFU auch als risikominimierende Maßnahme verwenden.
Um nun den Anforderungen des Amendment 2 der IEC 60601-1 gerecht zu werden, wollen wir in Zukunft stattdessen das Symbol ISO7010-M002 („lesendes Männchen“) verwenden. Benötigen wir dann trotzdem zusätzlich noch das Symbol 5.4.4 aus der ISO 15223-1 auf dem Produkt, um auf die Sicherheitshinweise aufmerksam zu machen?
Oder braucht man das Symbol auch noch aus anderen Gründen?
Vielen Dank und Beste Grüße,
Bettina Seidl
Liebe Frau Seidl,
die MDR macht keine Vorgaben dazu aus welcher Norm die Symbole stammen müssen. Konkret für ihren Fall macht die ISO 20417 jedoch eine Empfehlung in „6.1.5 Consult instructions for use“. Eine dieser Empfehlungen ist unter anderem die Verwendung des Symbols ISO 7010-M002. Demzufolge ist die Verwendung dieses Symbols ausreichend.
Liebe Grüße
Philipp Schleer
Sehr geehrter Herr Schleer,
wir produzieren Behandlungseinheiten nach §22 MDR. Die zugehörigen Produkte haben teils gleiche, teils unterschiedliche ISO-Symbole. Schreibt die ISO vor, welche davon auf die Umverpackung gedruckt werden müssen?
Mit freundlichen Grüßen
Wolfgang Siebert
Lieber Herr Siebert,
weder die MDR noch die ISO 15223-1 schreibt vor, welche Symbole auf die Umverpackung gedruckt werden müssen. Generell besteht somit keine Pflicht Symbole anzugeben. Insofern Symbole angegeben werden, sollten diese jedoch aus der ISO 15223-1, der ISO 7000, der ISO 7010 oder anderen anerkannten Normen stammen.
Die MDR schreibt allgemein in Anhang I 23.1 b) „Die für die Kennzeichnung vorgeschriebenen Angaben werden auf dem Produkt selbst angebracht. Ist dies nicht praktikabel oder angemessen, so können einige oder alle Informationen auf der Verpackung jeder Einheit und/oder auf der Verpackung mehrerer Produkte angebracht sein.“
Dabei sollte der Set-Zusammensteller risikobasiert vorgehen. Wichtige Informationen wie Lagerbedingungen müssen auf die Umverpackung.
Zusätzlich schreibt die MDR in Artikel 22: (2) b) „das System oder die Behandlungseinheit verpackt und die einschlägigen Benutzerhinweise angegeben hat, unter Einbeziehung der Informationen, die vom Hersteller der Medizin- und sonstigen zusammengestellten Produkte bereitzustellen sind,“
Auch demnach ist somit eine risikobasierter Ansatz zu empfehlen, um zu entscheiden welche Informationen auf die Umverpackung gedruckt werden sollten.
Liebe Grüße
Philipp Schleer
Sehr geehrte Damen und Herrn,
die ISO 15223-1:2021 gibt jetzt Symbole für die Sterilbarriere vor. Müssen diese jetzt sowohl bei sterilen Medizinprodukten als auch IVDs verwendet werden?
Wir stellen z.B. sterile Blutentnahmeröhrchen her. Dabei ist das Innere der Röhrchen steril. Müssen wir somit das Symbol für die Sterilbarriere (Nr. 5.2.11) zusätzlich zum Symbol für die Sterilisationsmethode anbringen? Oder gibt es hier Ausnahmen?
Vielen Dank im Voraus.
Mit freundlichen Grüßen,
Martina M.
Sehr geehrte Martina M.,
sowohl für die MDR als auch für die IVDR gilt, dass Symbole verwendet werden können, allerdings nicht verwendet werden müssen. Die entsprechende Sterilbarriere muss jedoch in jedem Fall gekennzeichnet werden. Insofern hierfür Text verwendet wird, muss dieser auch in die im jeweiligen Land geforderten Sprachen übersetzt werden. Wird ein Symbol für die Sterilbarriere verwendet, muss dieses in der IFU erklärt werden, da die 15223-1 bislang nicht harmonisiert ist.
Liebe Grüße
Philipp Schleer
Sehr geehrter Herr Johner,
dürfte man für ein Gerät ohne CE-Zulassung, welches nicht auf dem europäischen Markt verkauft wird, dennoch das Symbol MD verwenden?
Vielen Dank.
Mit freundlichen Grüßen,
Birgit Jacobs
Sehr geehrte Frau Jacobs,
vielen Dank für Ihre Frage. Sehr gerne antworte ich an Herrn Johners Stelle.
Die Symbole der ISO 15223-1, wie das MD-Symbol, können auch außerhalb des europäischen Markts verwendet werden, sofern sie von den lokalen Behörden akzeptiert werden. Die Norm gibt im Scope an:
„This document is applicable to symbols used in a broad spectrum of medical devices, which are marketed
globally and therefore need to meet different regulatory requirements.“
Mit freundlichen Grüßen
Nils Becker
Hallo liebes Johner Team,
wir sind Hersteller von Produkten zur Entfernung von Thromben.
Im Falle einer erneuten oder zusätzlichen Prozedur kann dasselbe intakte Produkt im selben Patienten bis zu zwei Mal erneut verwendet werden.
Das bedeutet, dass während einer Intervention bzw. während einer Narkose, das Produkt 3 Mal verwendet werden kann, um bspw. 3 einzelne Thromben zu entfernen.
Handelt es sich in diesem Fall um ein Produkt, das man mit dem Symbol „Einzelner Patient – mehrfach anwendbar“ kennzeichnen müsste, wie es in Abb. 3 dieses Beitrags abgebildet ist?
In der EN ISO 15223-1:2021 ist dieses Symbol folgendermaßen beschrieben: „zeigt ein Medizinprodukt an, das an einem einzelnen Patienten mehrere Male (für mehrere Verfahren) verwendet werden darf“.
Da unser Produkt, wie vorstehend beschrieben, innerhalb EINER Intervention bzw. während EINER Narkose mehrmals verwendet werden darf, stellen wir uns die Frage, ob man hier von EINEM Verfahren sprechen kann (und wir das Produkt als Einmalprodukt kennzeichnen dürfen) oder von MEHREREN Verfahren (i.S.d. Norm) sprechen muss (und wir das oben genannte Symbol verwenden müssen).
Herzlichen Dank und viele Grüße
Peter K.
Lieber Peter,
herzlichen Dank für Ihre Frage.
Das „Einzelner Patient – mehrfach anwendbar“-Symbol wäre nach meiner Einschätzung nicht für Ihr Produkt anwendbar. Das Symbol kommt bei Produkten zum Einsatz, die in mehreren Interventionen ohne Aufbereitung eingesetzt werden können.
Herzliche Grüße
Nils Becker
Hallo liebes Johner-Team,
gibt es eine Übergangsfrist, bis wann Medizinprodukte ohne das Symbol MD erstmalig in den Verkehr gebracht werden dürfen? Zum Zeitpunkt der Herstellung im Herbst 2021 war die überarbeitete Norm mit allen neuen Symbolen noch nicht verfügbar gewesen.
Vielen Dank für Ihre Antwort
R. Hahn
Guten Tag liebe Frau Hahn,
hier gibt es keine definierten Deadlines, welche Sie einhalten müssten. Natürlich sollten Sie gemäß MDR immer nach dem State-of-the-Art arbeiten, zudem ist die EN ISO 15223-1:2021 mittlerweile sogar harmonisiert. Wenn Sie nun eine neue Konformitätserklärung für Ihr Produkt ausstellen, so wäre diese nicht mehr korrekt, wenn Sie nach der „alten“ Norm arbeiten, daher wäre es sinnvoll, ab diesem Zeitpunkt umzustellen. Natürlich nur dann, wenn Sie über das Risikomanagement zum Schluss kommen, dass dies vertretbar ist und Sie der Forderung der MDR, das Produkt eindeutig als Medizinprodukt zu kennzeichnen (Anhang I, Artikel 23.2 q), auch ohne das MD-Symbol nachkommen.
Herzliche Grüße
Christopher Seib
Guten Tag liebes Team,
Können Sie mir sagen, unter welchen Bedingungen laut DIN EN ISO 15223-1:2022-02 das Land der Herstellung deklariert werden muss?
Vielen lieben Dank im Voraus!
Beste Grüße
Frederik
Guten Morgen Frederik,
die EN ISO 15223-1:2022 macht Ihnen keine Vorgaben, dass ein gewisses Symbol genutzt werden muss, sondern legt nur fest, welches Symbol zu verwenden ist, falls eines eingesetzt werden soll.
Entscheidend für die regulatorischen Anforderungen ist Anhang I der MDR; hier wird in Artikel 23.2 c) die Anschrift des Herstellers verlangt. ISO 20417:2022 konkretisiert, dass zu einer vollständigen Anschrift auch das Land, in welchem sich die Niederlassung des Herstellers befindet, gehört. Artikel 6.1.2 e) der Norm besagt, dass das Herstellungsland durch das entsprechende Symbol aus der 15223-1 hervorgehoben werden darf; zwingend erforderlich ist das jedoch nicht.
Kurzum: Das Herstellungsland ist ohnehin Teil Ihrer Herstelleradresse. Sie können zusätzlich das Herstellungsland über das Symbol aus der 15223-1 hervorheben, müssen dies jedoch nicht.
Herzliche Grüße
Christopher Seib
Sehr geehrter Herr Seib,
meiners Ansicht nach ist das Land der Herstellung („Made in xy“) nicht zwingend die Adresse des Herstellers (legal manufacturer). Das CC im Symbol 5.1.11 hätte ich als „Made in XY“ angegeben (gem. Ursprungserklärung) und beim Symbol 5.1.1 die Adresse (und daher auch das Land) des Herstellers.
MfG
Udo Klinger
Sehr geehrter Herr Klinger,
für die beschriebene Konstellation haben Sie natürlich recht! Sofern sich das Land der Herstellung und der Firmensitz des Herstellers unterscheiden, wären in den beiden Symbolen unterschiedliche Angaben zu machen.
Hier stellt sich mir jedoch die Frage, inwiefern ein Unternehmen als Hersteller auftreten kann, wenn das Produkt in einem anderen Land „hergestellt“ wurde. Kapitel 3.1 aus dem Amtsblatt C 247/2022 (https://eur-lex.europa.eu/legal-content/DE/TXT/?uri=uriserv%3AOJ.C_.2022.247.01.0001.01.DEU&toc=OJ%3AC%3A2022%3A247%3ATOC) interpretiere ich so, dass dasjenige Unternehmen, welches das Produkt in der EU letztendlich in Verkehr bringt, auch die Funktion der Herstellers übernimmt – unabhängig davon, wo die eigentliche „Herstellung“ (Fertigung?) erfolgt ist. Die Angabe des Landes der Fertigung ist auf dem Etikett nicht erforderlich, da diese quasi im Auftrag des Herstellers erfolgte und dieser am Ende die Verantwortung trägt.
Aus persönlicher Erfahrung weiß ich, wie oft der „Werbeslogan“ Made in Germany bei einem unterschiedlichen Firmensitz des Herstellers den verschiedenen nationalen Behörden sauer aufstößt und dort vor allem beim Zoll zu Problemen führt. Verständlicherweise.
Lassen Sie es mich gerne wissen, wenn Sie das anders sehen – ich bin sehr dankbar für den spannenden Austausch hier im Chat. Und entschuldigen Sie die vielen Anführungszeichen.
Herzliche Grüße
Christopher Seib
Sehr geehrter Herr Johner,
muss man die Symbole der ISO 7000 erwerben um sie benutzen zu dürfen? Ich habe online widersprüchliche Informationen hierzu gefunden.
Vielen Dank.
Mit freundlichen Grüßen,
Leonie Weinmann
Sehr geehrte Frau Weinmann,
sehr gerne antworte ich Ihnen an Stelle von Herrn Johner.
Die Symbole aus der ISO 7000 dürfen gemäß den Herausgebern der Norm in skalierter Form vervielfältigt werden. Das bedeutet, wenn Sie nicht die Original-Datei in höchster Auflösung benötigen, so können Sie die Symbole auch aus anderen Quellen beziehen.
Herzliche Grüße
Christopher Seib
Hallo liebes Team,
die neue Version der 15223-1 hat ein Symbol zur Kennzeichnung einer Sterilbarriere eingeführt – muss dieses Symbol auch schon für Produkte verwendet werden, die aktuell noch über ein gültiges MDD-Zertifikat verfügen (also für Legacy Devices)?
Vielen Dank und viele Grüße
Nicole Blümling
Lieb Frau Blümling,
Die EN ISO EN ISO 15223-1 ist nur für die MDR harmonisiert und wird für die MDD nicht mehr harmonisiert werden. Daher ist diese Norm auch nicht verpflichtend auf ein Legacy Device anzuwenden.
Grundsätzlich sind Sie als Hersteller in der Pflicht zu bewerten, welche Norm Sie tatsächlich anwenden – Normen sind keine Gesetze. Solange Sie im Rahmen der Übergangsfristen zum Inverkehrbringen von Produkten mit gültiger Konformitätsbescheinigung arbeiten, müssen Sie Ihre Kennzeichnung auch nicht zwingend auf die MDR und damit auf die EN ISO 15223-1 anpassen, da Ihre Produkte ja nach wie vor konform zur MDD sind.
Herzliche Grüße
Christopher Seib
Sehr geehrter Herr Johner,
müssen Hersteller in der Übergangsphase zur MDR (geplante Zertifizierung Q1 2024), die von der MDR geforderten Symbole (beispielsweise MD, UDI) bereits jetzt auf Ihren Etiketten berücksichtigen, obwohl noch unter der MDD produziert wird?
Freundliche Grüße,
Astrid Unterkreuter
Sehr geehrte Frau Unterkreuter,
Ich erlaube mir, an Stelle von Herrn Johner zu antworten.
Die EN ISO 20417:2022 bzw. EN ISO 15223-1:2021 sind nur für die MDR harmonisiert und werden für die MDD nicht mehr harmonisiert werden. Daher ist es nicht verpflichtend, diese Normen auf ein Legacy Device anzuwenden.
Grundsätzlich sind Sie als Hersteller in der Pflicht zu bewerten, welche Norm Sie tatsächlich anwenden – Normen sind keine Gesetze. Solange Sie im Rahmen der Übergangsfristen zum Inverkehrbringen von Produkten mit gültiger Konformitätsbescheinigung (https://www.johner-institut.de/blog/johner-institut/uebergangsfristen-mdr/) arbeiten, müssen Sie Ihre Kennzeichnung auch nicht zwingend auf die MDR und damit auf die neuen Normen anpassen, da Ihre Produkte ja nach wie vor konform zur MDD sind.
Herzliche Grüße
Christopher Seib
Herzlichen Dank für die aufschlussreiche Antwort!
Beste Grüße,
Astrid Unterkreuter
Hallo liebes Johner-Team,
halten Sie das IVD-Symbol 5.5.1 der ISO 15223-1 für Primäretiketten von Reagenzien und Komponenten eines IVD-Kits, dessen Reagenzien/Komponenten nicht separat als IVD-Medizinprodukte zur Verfügung gestellt werden, anwendbar?
Klausel 6.5 der ISO 18113-2 fordert die Kennzeichnung des Zwecks für In-vitro-Diagnostik auf Primäretiketten. Mit der Annahme, dass sich diese Forderung auch auf die Primäretiketten der Komponenten eines Kits bezieht (korrigieren Sie mich bitte, falls ich die Forderung falsch interpretiere), könnte dies mittels eines entsprechenden Symboles geleistet werden. Das IVD-Symbol 5.5.1 der ISO 15223-1 scheint für den Zweck auf den ersten Blick gut geeignet zu sein.
Allerdings impliziert die Beschreibung des IVD-Symbols 5.5.1 in der ISO 15223-1 stark, dass es sich bei einer damit gekennzeichneten Einheit um ein IVD-Medizinprodukt handelt. Das geht über die beabsichtigte Kennzeichnung der Anwendung der Komponenten in der In-Vitro-Diagnostik hinaus. Die Komponenten gelten individuell nicht als „IVD-Medizinprodukte“. Das IVD-Symbol 5.5.1 könnte also für die in der Klausel 6.5 der ISO 18113-2 geforderten Kennzeichnung ungeeignet sein.
Viele Grüße und danke im Voraus!
Yoval
Hallo lieber Yoval,
dieses Symbol ist nicht nur anwendbar, sondern gemäß Anhang I, Artikel 20.2 e) der IVDR verpflichtend; die ISO 18113-2 fordert ebenfalls, dass dieses Symbol zu verwenden ist, falls es sich um ein Produkt handelt, welches für die In-vitro-Diagnostik gedacht ist. Dabei ist dieses Symbol auf dem Primäretikett jeder Komponente, welche zum Gesamtprodukt gehört, anzubringen. Und hier ist es unerheblich, ob diese Komponente nun ein eigenständiges IVD darstellt oder, wie in Ihrem Fall, einen Teil eines IVDs (Kit) abbildet.
Herzliche Grüße
Christopher Seib
Hallo liebes Johner-Team,
Gibt es für die Titel der Symbole eine einheitliche Übersetzung in den einzelnen Ländersprachen der EU? Oder reicht es aus, wenn diese Titel auf der englischen Grundlage durch uns übersetzt werden?
Wir möchten die verwendeten Symbole in den IFUs der einzelnen Ländersprachen betiteln / erklären.
Liebe Frau Beck,
eine einheitliche Übersetzung gibt es nur in den entsprechenden nationalen Implementierungen der Norm – sofern diese bereits vorliegen. Eine allgemeine Übersicht, welche diese Übersetzungen zusammenträgt, ist mir nicht bekannt.
Entsprechend würde ich die Symbolerklärung wie den Rest der Gebrauchsanweisung behandeln und selbst übersetzen bzw. durch einen geeigneten Dienstleister übersetzen lassen. Achten Sie dabei auch auf die nötige Güte der Übersetzung – wir haben einen entsprechenden Blog-Artikel, der Ihnen hoffentlich weiterhilft (https://www.johner-institut.de/blog/regulatory-affairs/gebrauchsanweisungen/, Kapitel 2g)).
Herzliche Grüße
Christopher Seib
Viele Grüße
Silvia Beck
Liebes Johner Team,
ist für ein Annex XVI Produkt die Kennzeichnung mit „MD“ möglich, respektive handelt es sich bei diesen Produkten um Medical Devices bzw. ist MDR Annex I 23.2 (q) überhaupt anwendbar? Nach Artikel 1 Abs.(2) gilt die MDR ja explizit auch für Annex XVI Produkte und stellt ferner klar, dass der Stand der Technik und insbesondere bereits geltende harmonisierte Normen für diese Produkte zu berücksichtigen sind, wobei sich bei genauerer Betrachtung doch einige Unklarheiten ergeben. Danke für Ihre Unterstützung.
Stefan Scheider
Lieber Herr Schneider,
die benötigte Kennzeichnung der in Anhang XVI gelisteten Produkte findet sich in Durchführungsverordnung 2022/2346 (https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32022R2346&from=EN). Dies umfasst gemäß Anhang I, Artikel 11, unter anderem die Angabe „nichtmedizinische Zweckbestimmung“. Dies schließt für mein Verständnis die Verwendung des MD-Symbols aus, diese Kennzeichnung ist zudem nicht explizit für Produkte gemäß Anhang XVI gefordert.
Herzliche Grüße
Christopher Seib
Liebes Johner-Team,
zum Thema Kennzeichnung von Zubehör: Wenn man ein Zubehör (Klasse I) getrennt von dem Medizinprodukt (Klasse IIa) verkauft – kann das Zubehör in einer Form als Zubehör gekennzeichnet werden und ist es von der Kennzeichnung mit dem „MD“-Symbol ausgeschlossen? Es gibt leider kein Symbol für Zubehör, in seiner Zweckbestimmung unterstützt es aber die Anwendung des Medizinprodukts und hat keinen anderen Gebrauch.
Danke für die Unterstützung!
Michael
Lieber Michael,
auch Zubehör muss die Anforderungen der MDR erfüllen (https://www.johner-institut.de/blog/regulatory-affairs/zubehoer-fuer-medizinprodukte-definition-und-regulatorische-anforderungen/) – und damit auch die Grundlegenden Sicherheits- und Leistungsanforderungen. Eine dieser Anforderungen ist die vollständige Kennzeichnung gemäß Anhang I der MDR. Somit sollte auch Zubehör das MD-Symbol tragen, um zu zeigen, dass es sich um medizinisches Zubehör handelt und damit alle nötigen Anforderungen erfüllt. Eine Unterscheidung von einem „richtigen“ Medizinprodukt ist nicht nötig und wäre auch inhaltlich nicht korrekt.
Liebe Grüße
Christopher Seib
Sehr geehrtes Johner Team,
unsere weltweiten Vertriebskanäle für unsere Klasse I Medizinprodukte erweitern sich und wir suchen für unsere Produktkennzeichnung Lösungen, um möglichst „ein Label für alle Länder“ realisieren zu können.
In einigen Ländern außerhalb des MDR Geltungsbereiches müssen unsere Produkte nicht als Medizinprodukte registriert werden, folglich ist hier das MD-Symbol auf dem Produktlabel nicht notwendig.
Können wir das MD-Symbol trotzdem für den Export in diese Länder auf der Kennzeichnung lassen?
Wenn ja, ist ein zusätzlicher Hinweis auf dem Produktlabel notwendig, um den Geltungsbereich des MD-Symbols zu verdeutlichen und Missverständnisse vorzubeugen?
Wenn ja, gibt es Vorgaben, welche Informationen ein solcher zusätzlicher Hinweis enthalten muss ( reicht z.B die Information: „EU/CH/UK information only“)?
Vielen Dank für Ihre Rückmeldung.
MfG
Dirk
Sehr geehrter Herr Schäfer,
danke für die spannende Frage!
Prinzipiell spricht nichts dagegen, wenn Sie Symbole verwenden, welche in den entsprechenden Märkten regulatorisch keine Bedeutung haben – Sie müssen auch nicht das CE-Zeichen, das sich als notwendiger Teil der Kennzeichnung direkt auf Ihrem Produkt befindet, wieder entfernen. Auch umgekehrt können Sie für die europäischen Markt Symbole verwenden, die gegebenenfalls nur in den USA Anwendung finden (beispielswiese „Rx only“). Entscheidend ist, dass mindestens alle regulatorisch geforderten Inhalte enthalten sind.
Hilfreich (und für viele Märkte notwendig) wäre in der Tat ein entsprechender Hinweis in Form einer Symbolerklärung – diese würde ich jedoch sofern möglich in die Gebrauchsanweisung oder ähnliches auslagern. Ansonsten müssten Sie diesen Hinweis auf dem Etikett in Landessprache übersetzen und hätten erneut eine Länderversion für jeden Markt, in den Sie Ihr Produkt vertreiben.
Herzliche Grüße
Christopher Seib
liebes johner-team,
eine frage bezüglich übersetszungen.
wir vertreiben unser produkt sowohl innerhalb als auch ausserhalb der EU. eine anforderung von ausserhalb der EU (südafrika) ist, auf den karton „for professional use only“ anzubringen, sofern anwendbar. dies ist es bei uns. wenn wir nun diese info auf unseren karton geben, muss das in allen amtssprachen übersetzt werden? (im moment planen wir das anbringen dieser information lediglich auf englisch). das ist ja keine unbedingt erforderliche angabe für den anwender in allen ländern…
hoffe, ihr könnt mir hier helfen. oder kennt ihr vielleicht ein symbol „for professional use only“? wir werden leider nicht fündig…
danke für die hilfe,
mfg
eva
Liebe Eva,
gemäß Artikel 10(11) fordert die MDR nur die Übersetzung der in Anhang I Abschnitt 23 benötigten Informationen. Die Bezeichnung als “ professional use only“ gehört nicht dazu, ihr müsst diese also auch nicht zwingend übersetzen (eine Erläuterung in der Gebrauchsanweisung wäre eventuell aber hilfreich, z.B. gilt nur für Südafrika). Als Symbol ist mir nur das „Rx only“ Symbol aus den USA bekannt, das dort verpflichtend zu verwenden ist (sofern anwendbar). Um Verwechslungen zu vermeiden und dass dadurch der Eindruck entsteht, Ihr wäret in den USA tätig, würde ich jedoch davon abraten, dieses Symbol ohne direkte Erklärung, dass es nur für Südafrika gilt, zu verwenden.
Herzliche Grüße
Christopher Seib
vielen dank für die schnelle antwort! Rx only hab ich immer als verschreibungspflichtig interpretiert, bei uns ist es so dass der intended user professional sein sollte. kommt mir nicht ganz passend vor.
hat uns auf jeden fall sehr geholfen, nochmal danke!
Guten Tag, können Sie mir erklären, was mit dem Symbol # „Modellnummer“ deklariert werden muss? Wie definiert sich „Modell“?
Besten Dank vorab!
Mit freundlichen Grüßen
Heike Schulenburg
Liebe Frau Schulenburg,
Vielen Dank für die Frage!
Hierzu möchte ich gerne ISO 20417, Kapitel 5.7 zitieren:
„a) Eine Modellnummer darf dazu verwendet werden, ein Medizinprodukt, ein Zubehör oder eine
Medizinproduktgruppe zu repräsentieren, das/die gemeinsame Merkmale aufweist.
b) Eine Modellnummer darf mehreren Katalognummern zugeordnet sein.
c) Die Modellnummer darf mit der Katalognummer identisch sein, wenn es eine einzige Katalognummer gibt,
die von der Modellnummer repräsentiert wird. “
Eine Modellnummer ist also erstmal nicht zwingend erforderlich; Sie können diese Nummer hingegen wenn Sie möchten nutzen, um Ihre Produkte zu identifizieren und rückverfolgen zu können. Letztendlich ist diese Nummer sehr eng mit der Katalognummer verbunden, bietet Ihnen aber die Möglichkeit, ein Produkt nachvollziehbar mehreren Katalognummern zuzuordnen.
Ich hoffe, das klärt Ihre Frage und lassen Sie es mich gerne jederzeit wissen, wenn wir Sie weiter im Detail unterstützen können!
Herzliche Grüße
Christopher Seib
Sehr geehrter Herr Seib,
das hilft mir schon mal weiter. Wir stellen stoffliche MP her, die mit Artikelnummern und Lotnummern gekennzeichnet werden. Hier wird eine Lot / Charge bei mehrere Patienten angewendet., z.B. bei einem Zahnzement. Wir waren der Meinung, dass das ausreichend ist. Ein Kunde, für den wir herstellen, beharrt auf die Modellnummer und wir haben die Vermutung, dass er aus Unwissenheit „alles“ möchte. Man muss zu seiner Entschuldigung sagen, dass er ein Gerätehersteller ist. Hier kann ich mir eine Modellnummer vorstellen.
Ich bedanke mich und verbleibe
Mit freundlichen Grüßen
Frau Schulenburg
Liebes Johner Team,
vielen Dank für den informativen Beitrag! Ich hätte eine generelle Frage zu Gebotszeichen auf Medizinprodukten: Wenn man ein Gebotszeichen anbringen muss, reicht es dann wenn das Symbol in schwarz-weiß abgebildet ist? Oder muss man das Gebotsschild in Farbe (blau) anbringen? (zB auf dem Typenschild)
Liebe Grüße
Philipp
Lieber Philipp,
die Farbe von Warn-, Alarm- oder Gebotszeichen ist über die ISO 3864 normiert. Die ISO 7010, welche die Symbol festlegt, referenziert für die Farbgebung diese Norm. Entsprechend muss die Farbe auch übereinstimmen, ansonsten wäre das ein Verstoß gegen die Norm und die Symbole würden außerhalb der vorgesehenen Spezifikationen verwendet.
Die ISO 15223-1 hingegen macht keine Vorgaben zur Farbgebung – das gilt nur die Symbole aus der ISO 7010 (oder vergleichbaren Sicherheitsnormen mit spezifischen Forderungen).
Herzliche Grüße
Christopher Seib
Danke für die Antwort! 🙂
Hallo, mich würde folgendes interessieren:
Muss bei MDR zertifizierten Klasse I Produkten die Lot nummer zwingend auf der Sekundärverpackung aufgeführt sein oder reicht es wenn sie auf der Primärverpackung ersichtlich ist? Die UDI muss ja noch nicht zwingend aufgeführt werden.
Vielen Dank und Gruss
Hallo Daniel,
sofern es sich bei der Sekundärverpackung nicht um eine reine Transportverpackung handelt, müssen auch alle Anforderungen an eine vollständige Kennzeichnung erfüllt sein. Dazu zählt – wie in ISO 20417, Kapitel 6.5.1 b)4)i) beschrieben – auch eine entsprechende Art der Produktionskontrolle. Ist dies die Lot, so sollte sich diese auch auf der Verpackung befinden. Dies macht es dem Anwender am Ende erst möglich, das Produkt vollständig zu identifizieren, ohne es auspacken zu müssen.
Herzliche Grüße
Christopher Seib
Hallo,
verstehe ich das richtig: die Entscheidung, welche „genormten“ Symbole aus der Norm letztendlich noch in der Gebrauchsanweisung erklärt werden müssen liegt beim Hersteller und dieser trifft diese Entscheidung wenn er dies im Risikomanagement ( mittels Risikoanalyse oder einer Gebrauchstauglichkeits Studie) , bzw. den grundlegenden Sicherheits- und Leistungsanforderungen betrachtet hat? Muss man wirklich jedes Symbol dass auf dem Produkt Verwendung findet so betrachten? Dann wären letztendlich die „genormten“ Symbole gleichzusehen wie ein Symbol dass nicht aus der Norm kommt.
Eine sehr schwere Entscheidung finde ich, denn hier stellt sich die Frage welche Symbole aus der Norm sind beispielsweis für einen Laien verständlich? Prinzipiell kann ich alle Symbole in Frage stellen. Eines der einfachsten Symbole, wie das Symbol 5.1.5 Chargenbezeichnung. Ist das Symbol ohne Symboltitel für einen Laien verständlich oder muss man dass in der Gebrauchsanweisung erklären? Wenn man hier den Maßstab zu tief anlegt ist man quasi gezwungen jedes Symbol aus der Norm zu erklären und in einer Risikoanalyse oder einer Gebrauchstauglichkeitsstudie zu betrachten und dies halte ich nicht für verhältnismäßig.
Hallo Frau Schwörer,
Artikel 23.1 h) aus Anhang I der MDR gibt vor, dass Sie die Symbole, die nicht aus einer harmonisierten Norm (wie der EN ISO 15223-1) stammen, zwingend in Produktdokumentation erklären. Harmonisierte Symbole müssen Sie nach der MDR nicht erklären, schaden kann es jedoch nicht.
Für Laien empfehle ich, den Prozess etwas zu verallgemeinern und generell zu überlegen, ob der Anwender mit harmonisierten Symbolen etwas anfangen kann. Davon gehe ich erst einmal nicht aus. Entsprechend sollten alle Symbole zur Sicherheit in der begleitenden Dokumentation erklärt werden. In einer möglichen Studie sollten Sie dann bedenken, aus welchen Symbolen (und vielmehr dem damit verbundenen Inhalt!) tatsächlich ein Risiko für den Anwender entstehen kann. Die Charge spielt vermutlich eher eine untergeordnete Rolle. Weiß der Anwender, dass das Produkt bei 2-8°C gekühlt zu lagern ist und es ab einem gewissen Datum nicht mehr verwendet werden darf, da ansonsten keine verlässlichen Ergebnisse mehr zu erwarten sind? Dies könnte schon eher ein risikobasiertes Szenario darstellen.
Herzliche Grüße
Christopher Seib
Guten Morgen Prof. Dr. Johner, guten Morgen Herr Seib,
es geht um die mir unklare Verwendung des Symbols 5.1.9 „Vertriebspartner“. Wir haben Vertriebspartner, die unsere Produkte auf dem Markt bereitstellen, aber wir als Hersteller werden als solcher auf dem Etikett genannt und sind weiterhin für die Einhaltung der Anforderungen verantwortlich, die gemäß der Verordnung für Hersteller gelten. Ist in diesem Fall die Verwendung des Symbols und die Angabe von Name und Anschrift des Vertriebspartners erforderlich?
Im Anhang ZA gibt es keine Verbindung von diesem Symbol und Grundl. Anforderung der MDR.
Beste Grüße
Karen Haßelfeldt
Im Anhang ZA gibt es keine Verbindung von diesem Symbol und Grundl. Anfor-derung
Guten Tag Frau Haßelfeldt,
die MDR fordert nach Artikel 14 nicht, dass der Vertriebspartner auf dem Produkt zu erkennen sein muss (außer es werden Tätigkeiten nach Artikel 16(2) durchgeführt). Solange Sie als Hersteller zu erkennen sind und die Verantwortung für das Produkt tragen, ist regulatorisch alles abgedeckt. Wenn der Vertriebspartner auf dem Etikett / der Verpackung erscheinen möchte, kann bzw. sollte das Symbol 5.1.9 verwendet werden – diese Angabe ist jedoch kein Muss.
Herzliche Grüße
Christopher Seib
Vielen Dank für die Antwort.
Beste Grüße
Karen Haßelfeldt
Hallo,
gemäss aktuellem Draft ISO 15223-1:2021/ DAM 1, Annex A, A.4 müsste das Symbol für den EC-REP „EU REP“ beinhalten („EC“ ist nach ISO 3166 der Code für Ecuador …).
Gemäss der ISO 15223-1:2021, 5.1.2 war das Symbol „EC REP“ noch korrekt.
Bedeutet das, dass demnächst bei vielen Herstellern alle Etiketten und IfUs korrigiert werden müssen?
Viele Grüsse
JS
Sehr geehrter Herr Schneider,
danke für den wertvollen Hinweis! Wird diese Änderung umgesetzt, dann haben Sie (leider) Recht und es bedarf einer Änderung an der Kennzeichnung. Bis dahin würde ich jedoch noch nicht tätig werden, da es sich noch um einen Entwurf handelt. Ein Umetikettieren bestehender Produkte wird zwar meiner Meinung nach nicht notwendig sein, da sich hier keinerlei Risiken ergeben, es wird jedoch weiter nicht langweilig.
Herzliche Grüße
Christopher Seib
Guten Tag Johner Label Team
Wie verhält es sich mit dem Biohazard Label bei Produkten, welche erst in Verwendung beim Kunden durch Probenmaterial menschlichen Urprungs kontaminiert werden?
Bei der Auslieferung vom Inverkehrbringer zum Kunden sind diese Produkte / Consumables noch nicht pot. infektiös sondern erst nach Einsatz im System und kontaminierung durch eine Probe.
Ist das in einer Norm genauer beschrieben?
Besten Dank für einen Hinweis und
Freundliche Grüsse
Roger Sandoz
Sehr geehrter Herr Sandoz,
zum Zeitpunkt der Auslieferung besteht kein Biohazard-Risiko, also wäre die Verwendung dieses Symboles erst einmal falsch. Und genau diesen aktuellen Zustand sollten Sie in der Kennzeichnung beschreiben. In der Gebrauchsanweisung sollten Sie im Rahmen der Warnhinweise und besonders zur Entsorgung auf dieses Risiko hinweisen und erklären wie die Produkte sicher zu handhaben sind. Gegebenenfalls können Sie – wenn beispielsweise die Probe eingesendet werden soll – einen Beutel mit entsprechender Kennzeichnung beifügen.
Herzliche Grüße
Christopher Seib
Guten Tag, sehr geehrtes Johner Team,
muss im Falle eines Ersatzteils das Label das MD Zeichen tragen? Eingedenk dessen, dass es sich NICHT um ein eigenständiges, einer Konformitätsbewertung unterworfenes Zubehör bzw. Medizinprodukt handelt, meine ich nein. Liege ich mit dieser Einschätzung richtig?
Guten Tag Frau Sachner,
Sie haben komplett Recht! Ein Ersatzteil ist kein eigenständiges Medizinprodukt und darf somit weder ein CE- noch ein MD-Zeichen tragen (außer es wäre auch gleichzeitig als separates Zubehör erhältlich).
Herzliche Grüße
Christopher Seib
Hallo, sehr geehrtes Johner-Team,
ich habe eine Frage bezüglich Kennzeichnung von System- und Behandlungseinheiten nach Art. 22 Satz 1,2 und 5.
Müssen diese mit dem Symbol MD gekennzeichnet werden, obwohl diese nicht als ein eigenständiges Medizinprodukt ausgewiesen werden. Auf den Einzelkomponenten der zusammengesetzten Medizinprodukte ist die Kennzeichnung MD ersichtlich.
Meiner Meinung sind wir nicht dazu verpflichtet diese Kennzeichnung MD noch zusätzlich auf dem Label der System- und Behandlungseinheit anzubringen.
Liege ich da mit meiner Einschätzung richtig?
Sehr geehrter Herr Ninkovic,
im Englischen spricht die MDR in der Definition von System und Behandlungseinheiten explizit von „products“, nicht zwingend „devices“, da auch nicht-Medizinprodukte enthalten sein können. Eine Kennzeichnung des gesamten Produktes als Medizinprodukt wäre also nicht immer zwingend korrekt, bzw. würde ggf. sogar Produkte als Medizinprodukte kennzeichnen, welche dies gar nicht sind. Entsprechend sollte auf der Kennzeichnung weder ein CE-Zeichen noch ein MD-Symbol erscheinen.
Herzliche Grüße
Christopher Seib
Sehr geehrtes Johner-Team,
der Systemzusammensteller nach Artikel 22 (MDR) hat ja leider kein Symbol bekommen. Er muss sich aber auf seinen Produkten kennzeichnen. Klar ist, dass er hier nicht das Herstellersysmbol (5.5.1) verwendet werden darf. Für den Anwender sollte jedoch leicht erkennbar sein (auch durch eine Symbol) an wen er sich bezüglich des Produkt wenden kann.
Kann der Systemzusammensteller ein eigenes Symbol erfinden oder wäre das irreführend?
(Zum Beispiel Herstellersymbol ohne Schornstein und mit Summenzeichen)
|\ |\ |\
| \| \| \
| ∑ |
|________|
Schönen Gruß
Michael Balling
Sehr geehrter Herr Balling,
korrekt, leider gibt es noch kein passendes Symbol. Der TÜV Rheinland hat sich diesem Thema in seinem „Praxis Medizinprodukterecht“ – das ich an dieser Stelle nur wärmstens empfehlen kann – gewidmet und kommt zum gleichen Schluss, dass das Herstellersymbol hier irreführend wäre.
Ein eigenes Symbol, das Sie in der Gebrauchsanweisung erläutern (nach Anhang I, Artikel 23.1 h)), ist eine Möglichkeit, um Platz (und die Übersetzung) direkt auf dem Etikett zu sparen. Ansonsten könnten Sie auch das Wort „Ersteller“ in allen relevanten Sprachen voranstellen. Eine gewisse Verwechslungsgefahr sehe ich in Ihrem Symbol nach wie vor, gerade im Vergleich zu Symbol 5.1.11. Evtl. eine Umkehrung zu Symbol 5.7.9, quasi als „Zusammenpacken“?
Herzliche Grüße
Christopher Seib
Hallo!
Die Änderung von EC-Rep zu EU-Rep finde ich sehr interessant und wichtig für alle Händler/Importeure, aber natürlich auch alle als EC-REP/EU-REP tätigen.
Leider konnte ich noch nirgends das neue Symbol finden, auch nicht bei den Symbolen der ISO 7000.
Haben Sie einen Tip, wo das jetzt schon erhältlich ist? Am besten natürlich kostenfrei 🙂
Danke!
Herzliche Grüße
Dazu wurde jetzt die ISO 15223-1:2021/Amd 1:2025 publiziert.
https://www.iso.org/standard/86270.html
Lieber Herr Schneider,
danke für’s Verlinken! Zusätzlich gibt es noch den Entwurf der DIN EN ISO 15223-1/A1. Vom Kauf rate ich aber nach wie vor ab, da hier nur das Symbol XX REP vorhanden ist und jeder Hersteller selbst das noch einmal anpassen muss. Das kann man auch mit dem EC REP aus der alten Norm. Übrigens: Die DIN EN ISO ist deutlich länger als die ISO (12 statt 3 Seiten), weil sie ein nationales Vorwort, generelles Vorwort, Leerseiten (ja, plural bei 12 Seiten), Seitenwechsel und die deutsche sowie englische Version enthält.
Herzliche Grüße
Christopher Seib
Liebe Frau Rieger,
ich fürchte fast, da müssen wir lange drauf warten. Die Norm enthält nur das Symbol XX REP. In den Beispielen finden sich zwar auch der EU und CH REP, doch hier wurde auch nur ein Textfeld über das EC oder XX gelegt (das den Rand der Box teilweise überdeckt). Ich würde vorschlagen, selbst ein entsprechendes Symbol zu entwerfen auf Grundlage des vorhandenen EC-REP.
Herzliche Grüße
Christopher Seib