Der FDA Usability Guidance ist seit dem 3. Februar 2016 „amtlich“: Nach viereinhalb Jahren hat das FDA Guidance Dokument „Applying Human Factors and Usability Engineering to Medical Devices“ das Entwurfsstadium verlassen und beschreibt die Sicht der Behörde zum Usability Engineeering.
Sie können das Guidance Document hier herunterladen.
FDA Usability Guidance für eilige Leser
Ziel des Dokuments
Die FDA zielt mit dem Usability Guidance darauf ab, Risiken durch mangelnde Gebrauchstauglichkeit zu minimieren. Es geht also wie bei der IEC 62366 nicht darum, gebrauchstaugliche und von den Anwendern begehrte Produkte zu entwickeln.
Was das Dokument beschreibt
Der FDA Usability Guidance beschreibt die Sicht der FDA:
- Wie Sie die Benutzer und die Benutzungsumgebung charakterisieren
- Was zu einer Benutzungsschnittstelle zählt
- Mit welchen Methoden Sie die Risiken analysieren
- Welche Ansätze Sie haben, um Risiken zu minimieren
- Wie Sie das Usability Testing („Human Factors Validiation Testing“) planen, durchführen und dokumentieren
Forderungen der FDA zum Usability Engineering erfüllen
Variante 1: Dem Buch von Geis und Johner folgen
Die einfachste Möglichkeit, die Forderungen der FDA zu erfüllen besteht darin, gemäß dem „Kochrezept“ im Buch „Usability als Erfolgsfaktor – IEC 62366 und FDA-konform dokumentieren“ vorzugehen. Das mag sich werblich anhören, aber wir haben das Buch genau mit diesem Ziel geschrieben, schnell eine konforme Gebrauchstauglichkeitsakte erstellen zu können.
Die dort genannten Methoden und Dokumentenvorlagen sind (basierend auf dem Entwurf für dieses Guidance Document) so gewählt, dass „automatisch“ eine FDA-konforme Dokumentation entsteht. Wenn Ihnen das zu viel Arbeit ist, können Sie die Dokumentenvorlagen im Auditgarant nutzen, die von den Use Scenarios bis zum Usability-Validierungs-Plan alles enthalten.
Variante 2: Mit der Dokumentenstruktur der FDA beginnen
Alternativ können Sie mit der Dokumentationsstruktur beginnen, die die FDA im Anhang vorschlägt:
- Listen Sie alle Dokumente auf, die dort genannt sind.
- Legen Sie fest, in welcher Phase Ihres Entwicklungsprozesses Sie diese Dokumente erstellen.
- Schreiben Sie eine entsprechende Verfahrensanweisung oder ergänzen Sie Ihre Verfahrensanweisung zur Entwicklung entsprechend.
- Legen Sie die Methoden fest, mit denen Sie die Informationen erheben, die die jeweiligen Dokumente enthalten müssen. Wählen Sie dazu aus den Methoden, die Ihnen die FDA vorschlägt. Ergänzen Sie die Verfahrensanweisung damit.
- Schreiben Sie Templates, um sich künftig das Erstellen der Dokumente zu vereinfachen. Referenzieren Sie diese Templates zusätzlich in der Verfahrensanweisung.
Diese Arbeit haben wir für Sie allerdings bereits gemacht – siehe Variante 1.
In jedem Fall die regulatorischen Anforderungen kennen
Die FDA hat nicht nur den Usability Guidance veröffentlicht, sondern weitere Dokumente mit direktem oder indirektem Bezug zur Gebrauchstauglichkeit.
Lesen Sie hier mehr über die Anforderungen der FDA an das Human Factors Engineering sowie über die diesbezüglichen regulatorischen Anforderungen in den USA.
Bemerkenswertes im FDA Usability Guidance
Auf einige Besonderheiten in dem FDA Guidance Document „Applying Human Factors and Usability Engineering to Medical Devices“ möchte ich hinweisen:
- Der Begriff „Usability Engineering“ ist wieder gesellschaftsfähig: Die FDA hat sich lange gegen den Begriff Usability gewehrt und „Human Factors Engineering“ genutzt, weil sie befürchtet, dass Usability zu sehr mit designerischen Aspekten verwechselt wird.
- Der Anwendungsbereich (Scope) schließt nicht nur das Medizinprodukt sondern auch das Labeling (Verpackung, Gebrauchsanweisung, Beschriftung) mit ein.
- Bei 510(k) Submissions von Geräten, bei denen Risiken durch Fehlbedienung / mangelnde Gebrauchstauglichkeit auftreten können, erwartet die FDA entsprechende Daten – wie in diesem Dokument beschrieben.
- Das Dokument ist an vielen Stellen relativ konkret. Im Gegensatz zur IEC 62366:2015-1 nennt es konkrete Methoden z.B. zur Risikoanalyse oder zum Usability Testing. Damit entspricht es eher dem Technical Report IEC 62366-2:2016.
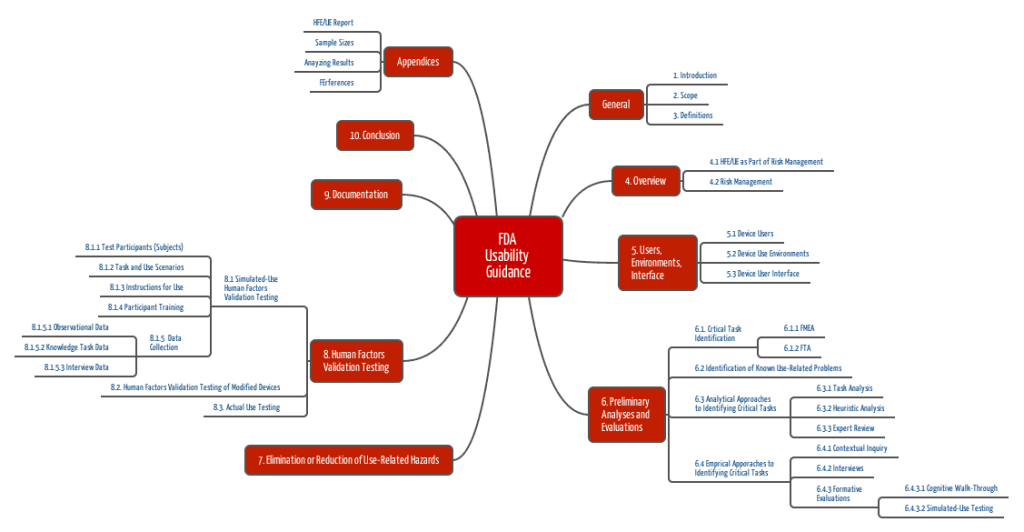
Kapitel des Guidance Dokuments zum Human Factors Engineering
Und nun noch konkrete Überlegungen zu den wichtigsten Kapiteln:
- Im Kapitel „Device Users, Use Environments and User Interfaces“ steht wie genau diese drei Elemente zu charakterisieren sind, etwa so genau wie die IEC 62366 einschließlich Anhang.
- Das Kapitel „Analytical Methods for Identifying, Evaluating and Understanding Use-Related Hazards“ fordert konkrete Verfahren wie „Contextual Inquiry“, „Interviews and Focus Groups“, „Function and Task Analysis“, „Heuristic Analysis“ und „Expert Review“ bereits während(!?!) des Design Prozesses. Diese Forderung hat mich überrascht.
- Das Kapitel „Formative Evaluations“ fordert weitere Verfahren bereits während des Design, nämlich einen „Cognitive Walk-Through“ (mit Nutzern!) und „Simulated Use Testing“, das auch an Mockups gemacht werden darf. Die Ziele dieser „Formative Evaluation“ bestehen darin, Ideen für Testszenarien zu generieren, gefährliche Situationen zu identifizieren, Input für Verbesserung der UI zu bekommen und ein besseres Verständnis möglicher Fehler zu bekommen. Etwas entsprechendes kennt die IEC 62366 nicht, zumindest nicht so explizit.
- Das kurze Kapitel „Mitigation and Control of Use-Related Hazards“ nennt die Möglichkeiten der Mitigation, nämlich Anleitungen, Alarme und Meldungen, Fehlertoleranz schaffen, Design modifizieren.
- Das folgt aber im Kapitel „Human Factors Validation Testing“, das Vorgaben zur Auswahl der Nutzer, der Nutzungsumgebung, dem Testprotokoll sowie zur Auswertung und Beurteilung von Restrisiken gibt.
Wie die gesamte Akte aufgebaut sein soll, verrät der Anhang A, der Anhang B beschreibt, wie viele Nutzer notwendig sind, um eine bestimmte Aussagequalität zu bekommen.
Im Vergleich zur IEC 62366 fällt auf, dass einerseits keine harten Forderungen gestellt werden, man aber auf der anderen Seite ziemlich genaue Vorstellungen hat, wie Dinge getan werden sollen. Der theoretische Background scheint an manchen Stellen etwas veraltet oder unbekannt zu sein.
Nachtrag
Gleichzeitig hat die FDA ein Guidance-Document veröffentlich, in dem sie Medizinprodukte nennt, bei denen sie die Usability (das Human Factors Engineering) am wichtigsten einschätzt. Sie finden es hier.



Ich besitze das Buch „Usability als Erfolgsfaktor – IEC 62366 und FDA-konform dokumentieren“ und kann es wirklich nur jedem empfehlen. Das Buch eignet sich sowohl für Einsteiger in das Thema Usability, als auch erfahrene Personen in der Medizinprodukte-Industrie, die nochmals in der Thematik nachlesen möchten. Das Buch ist für jede Anwendergruppe verständlich (Entwickler, Marketing, Sales, Regulatory Affairs etc.) und der aktuelle Bezug ist mit der Berücksichtigung der IEC 62366-1:2015 ebenfalls gegeben.
Daher vielen Dank Herr Geis und Herr Johner für dieses ausgezeichnete Buch!
Freundliche Grüsse,
Timur Resch