Regulatorische Anforderungen an die Usability Validierung
Die Medizinprodukteverordnung MDR fordert explizit, dass Hersteller auch Risiken identifizieren und beherrschen müssen, die sich aus einem spezifischen Nutzungskontext und durch die Charakteristiken der Nutzer (z.B. Ausbildungsgrad, intellektuelle und sprachliche Fähigkeiten) ergeben. Das gleiche tut die FDA.
Lesen Sie hier alle Anforderungen der MDR zur Gebrauchstauglichkeit nach: Anforderungen der MDR an die Usability.
Um den Nachweis zu erbringen, dass diese Forderungen erfüllt sind, bedarf es einer Usability Validierung. Die IEC 62366-1 sowie das Human Factors Engineering Guidance Dokument der FDA geben Hinweise, wie diese Usability Validierung zu erfolgen hat.
1. Charakterisierung der Benutzer
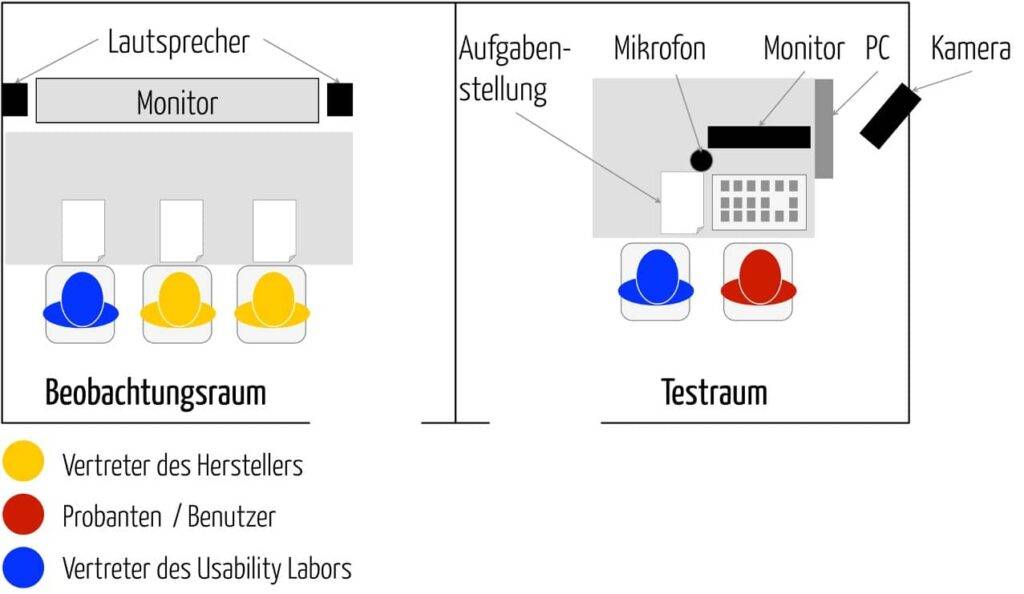
Die Usability Validierung muss also mit typischen Vertretern der spezifizierten Nutzergruppe erfolgen, üblicherweise in Form einer teilnehmenden Beobachtung. Diese Prüfung setzt natürlich voraus, dass man spezifiziert hat:
- Die Nutzergruppe, beispielsweise anhand des Alters, der Ausbildung, der Erfahrung mit dem Produkt, den körperlichen und intellektuellen Fähigkeiten.
- Den Nutzungskontext, beispielsweise die „mentale Workload“, die Umgebung (Temperatur, Feuchtigkeit, Helligkeit, …), die zu erledigenden Aufgaben uvm.
- Die Nutzungsziele, hier referenziert man üblicherweise die (medizinische) Zweckbestimmung.
Dass die Nutzer und die Nutzungsumgebung zu spezifizieren sind, verlangt die IEC 62366-1 in Kapitel 5.1.
2. Einbeziehung repräsentativer Benutzer in die Usability Validierung
Nur für die Usability Validierung benötigen Sie zwingend repräsentative Nutzer und einen repräsentativen Nutzungskontext (Gebrauchsumgebung).
3. Anzahl an Probanden bei der Usability Validierung
Die IEC 62366-1 verlangt bei der Validierung der Gebrauchstauglichkeit repräsentative Anwender. Wie viele das sind, sagt sie aber nicht. Das geht auch kaum, schließlich hängt die Anzahl auch davon ab, wie homogen die verschiedenen Nutzergruppen sind.
Die FDA hingegen referenziert in ihrem Guidance Dokument „Applying Human Factors and Usability Engineering to Optimize Medical Device Design“ eine Studie, die konkretere Zahlen nennt.
Wie Sie sehen, können Sie mit fünf repräsentativen Nutzern im Mittel 85% der Nutzungsprobleme finden, mit zehn bereits 95%. Das sind doch mal konkrete Zahlen!
Update: FDA verlangt im Human Factors Engineering Guide explizit mindestens 15 Teilnehmer pro Benutzergruppe, für Hochrisikoprodukte sogar mehr.
4. Usability Validierungsplan
In den Usability Validierungsplan müssen laut IEC 62366-1 die gefährdungsbezogenen Benutzungsszenarien einbezogen werden. Der Validierungsplan muss auch die Akzeptanzkriterien für die Usability Validierung bestimmen. Das Akzeptanzkriterium sollte immer die korrekte durchführung einer jeweiligen Aufgabe bzw. Teilaufgabe ohne Benutzungsfehler oder Benutzungsschwierigkeiten sein. Sobald ein Fehler oder eine Schwierigkeit beobachtet wird, muss die Ursache analysiert und eine Risikobewertung nach ISO 14971 durchgeführt werden.
Akzeptanzkriterien wie das folgende sind nicht zielführend: „X% der Nutzer müssen in maximal Y Minuten eine Aufgabe erledigt haben“. Weshalb nur X% mag man sich fragen, und nicht alle? Dass es nicht alle schaffen, ist doch mehr als ein Hinweis auf ein Gebrauchstauglichkeitsproblem. Und weshalb gerade Y Minuten? Woher kommt diese Zahl?

Für das Risikomanagement bedeutet das Erreichen eines Zeitziels noch nichts. Denn es kann sein, dass bei Nichterreichen trotzdem ein akzeptables Gerät (aus Risikomanagementsicht!!) entwickelt wurde. Umgekehrt, kann es sein, dass selbst bei Einhalten der Ziele ein nicht-akzeptables Risiko verbleibt.
Mangelnde Benutzbarkeit führt nur über eine Ursachenkette zu Schäden. Die FDA würde daher auch keine Usability-Ziele kommentieren, aber Ziele, die das Risiko betreffen. Mit dem Usability-Engineering-Prozess wird man auf potenzielle Risiken (hoffentlich) aufmerksam. Und diese gilt es dann im Risikomanagement zu bewerten.
Wie Sie sinnvolle Gebrauchstauglichkeitsziele festlegen und schnell eine auditsichere Gebrauchtauglichkeitsakte erstellen, erfahren Sie beim Seminar „Usability, Requirements und IEC 62366“ mit Thomas Geis.
Verfahren zur Usability Verifizierung und Usability Validierung
Es gibt verschiedene Verfahren zur Prüfung der Gebrauchstauglichkeit (Usability). Man unterscheidet dabei die folgenden:
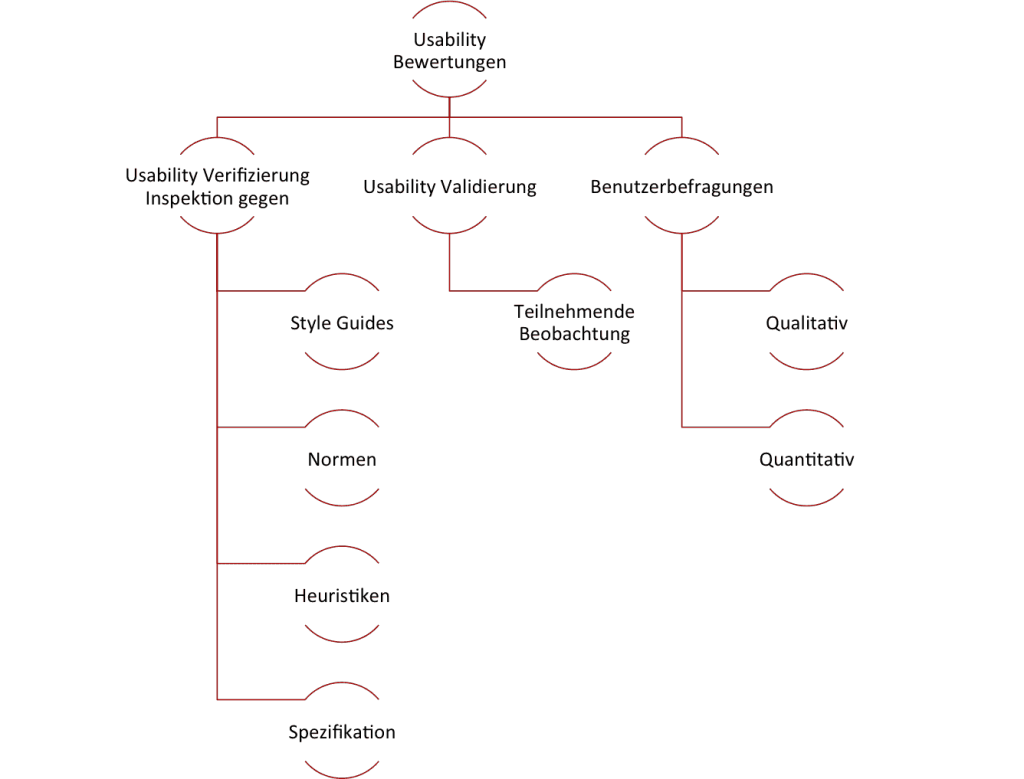
Usability Verifizierung: Inspektion
Die Verifizierung der Gebrauchstauglichkeit wird Ihnen mit einer Inspektion gelingen. Das ist ein Prüfverfahren, bei dem ein oder mehrere Experten Ihr Produkt darauf prüfen,
- ob die spezifizierten Anforderungen, wie man sie auch in Style Guides und Normen formuliert findet, umgesetzt sind oder/und
- ob das Produkt (prinzipiell) in der Lage ist, die Nutzungsanforderungen zu erfüllen. Wenn die Nutzungsanforderung lautet, der Arzt muss die Patienten mit einem zu niedrigen Hämoglobinwert erkennen können, und das System zeigt den Hämoglobinwert nicht an, dann ist diese Anforderung nicht erfüllt.
Es gibt mehrere Verfahren zur Verifizierung wie z.B. die Cognitive Walkthroughs.
Usability Validierung: Teilnehmende Beobachtung
Doch die Inspektion alleine genügt nicht. Sie müssen im Rahmen einer teilnehmenden Beobachtung echte Nutzer in einer tatsächlichen oder in einer simulierten Gebrauchsumgebung die Kernaufgaben durchlaufen und die sicherheitskritischen Funktionen ausführen lassen. Nur wenn die Nutzer tatsächlich in der Lage sind, die Nutzungsziele zu erreichen und damit die Nutzungsanforderungen als erfüllt nachzuweisen, haben Sie die Gebrauchstauglichkeit Ihres Produkts auch validiert.
Dies setzt voraus, dass Sie alle Kernaufgaben kennen. Diese führen Sie zu den häufig benutzen Funktionen. Weiter müssen Sie alle sicherheitskritischen Funktionen kennen. Diese ergeben sich aus der Risikoanalyse.
Benutzerbefragungen
Und für was bedarf es dann noch der Benutzerbefragungen? Im Sinn der IEC 62366-1 eigentlich gar nicht. Setzen Sie Fragenbögen ein, um Produkte oder Entwicklungsstände quantitativ zu vergleichen. Und setzen Sie Interviews ein, um Beschwerden zu objektivieren.
Formative und summative Evaluierung der Usability
Was die FDA bereits umgesetzt hat, wird nun auch in die zweite Ausgabe der IEC 62366-1 Einzug halten: Die Begriffe Verifizierung und Validierung der Gebrauchstauglichkeit werden durch die Begriffe formative (entwicklungsbegleitende) und summative (abschließende) Bewertung „ersetzt“. Doch ist das wirklich ein Ersetzen?

Eigentlich haben die beiden Begriffspaare wenig mit einander zu tun – abgesehen davon, dass sie alle mit der Prüfung der Gebrauchstauglichkeit in Verbindung stehen. Die beiden Begriffspaare beziehen sich vielmehr auf unterschiedliche Dimensionen: Usability Validierung und Usability Verifizierung unterscheiden sich in der Zielsetzung der Prüfung. Hingegen unterscheiden die Begriffe formative und summative Evaluierung den Zeitpunkt der Prüfung.
Beispielsweise wäre die Prüfung eines GUI Prototyps während der Entwicklung eine Validierung und eine formative Evaluierung. Eine Prüfung der Gebrauchstauglichkeit des fertigen Produkts mit repräsentativen Nutzern in einer repräsentativen Gebrauchsumgebung wäre ebenfalls eine Validierung, aber eine summative Evaluierung.
Mit was Sie die Usability Validierung nicht verwechseln sollten
„Klassische“ System-/Produkt-Validierung versus Usability Validierung
In einem weiteren Beitrag finden Sie den Unterschied zwischen diesen Verfahren beschrieben.
Usability Validierung versus klinische Studien
Ich bin über einen Artikel in der „European Medical Device Technology“ zum Thema Gebrauchstauglichkeit gestoßen. (Der Link http://www.donawa.com/medical-device/files/EMDT%20Jun11%20Usability.pdf ist leider nicht mehr verfügbar.) Darin weist die Autorin auf einen Absatz der IEC 60601-1-6 hin, der mir als sehr wichtig erscheint:
It should be noted that clinical investigations conducted according to ISO 14155-1 and usability testing for verification or validation according to this standard are two fundamentally different activities and should not be confused.
In anderen Worten:
- Die Usability Studie hat zum Ziel zu validieren, ob die spezifizierten Nutzer im spezifizierten Nutzungskontext die spezifizierten Nutzungsziele effektiv und effizient erreichen können. Eine Voraussetzung für die Validierung der Usability sind repräsentative Nutzer.
- Die klinischen Studien haben hingegen das Ziel nachzuweisen, dass das Produkt ein positives Nutzen-Risiko-Verhältnis hat. Voraussetzung für eine klinische Studie sind Patienten.
Obwohl beide Untersuchungen ggf. in der Klinik „in Echtbedingungen“ durchgeführt werden, sind die Zielsetzungen dennoch unterschiedlich, wenn auch nicht überschneidungsfrei. Oft ist es hilfreich, die Prüfungen voneinander zu trennen.
Usability Validierung versus Feldtest
Einer meiner Lieblingskunden kam auf die Idee, seine Software im Feldtest zu validieren, um so die entsprechenden gesetzlichen Forderungen nach Validierung zu erfüllen. Dabei hätte er sich um ein Haar strafbar gemacht.
Sein Gedanke war eigentlich gut, im Feld zu prüfen, ob die Zweckbestimmung und Nutzungsanforderungen erfüllt sind. Schließlich fordert die IEC 62366-1 sogar, dass man „echte“ Benutzer involviert. Die Anwendung aber unkontrolliert in einem Feldtest zu prüfen, entspricht einer Inverkehrbringung. Das ist strafbar.
Der richtige Ansatz wäre gewesen, diese Prüfung entweder in einer simulierten Umgebung wie einem Usability Lab oder in einer streng abgegrenzten klinischen Prüfung durchzuführen. An die klinischen Prüfungen sind aber einige Auflagen erfüllt.
Gerade für Software bedarf es derer aber häufig nicht. Aus diesem Grund empfehle ich das Usability Lab. Wer einmal Hersteller beobachtet hat, wie sie betroffen, ungläubig und fassungslos die Benutzer mit Ihrer Software arbeiten sehen, wird eines nicht mehr vermuten: Dass ein Usability Lab nicht geeignet sei, Nutzungsprobleme zu identifizieren. Schneller und preisgünstiger erfährt man nicht, was viele bei einer Validierung eigentlich gar nicht wissen wollen: Die nackte und oft brutale Wahrheit über ihr Produkt.
Weitere Informationsquellen
Seminar „Usability, Requirements & IEC 62366“
Wie Sie eine solche Validierung (in Form einer teilnehmenden Beobachtung) planen und durchführen lernen Sie im Seminar „Usability, Requirements und IEC 62366“ mit meinem Usability-Guru Thomas Geis. Es wird Ihren Blick auf die eigenen Produkte radikal ändern. Sie werden verstehen lernen, weshalb
- es zwischen Ihrer Entwicklungsabteilung und dem Produktmarketing immer Reibereien gibt,
- Ihre Kunden scheinbar ständig neue Wünsche haben,
- Ihr Unternehmen sich schwerer tut, als Apple,
- Sie noch kein Millionär sind.
Sie lernen aber nicht nur die Ursachen zu verstehen, sondern v.a. den Weg kennen, um genau diese Schwierigkeiten zu meistern. Für mich war und ist das Seminar wegweisend.
Wenn Sie dabei sein wollen, empfehle ich Ihnen, sich gleich einen Termin im nächsten Jahr zu sichern. Ich konnte Thomas Geis nur dreimal dafür gewinnen, nach Konstanz zu kommen. Nutzen Sie diese seltene Chance.
Usability Lab
Wir verfügen auch über ein Usability-Lab, in dem wir Kundenprodukte testen und verschiedene Verfahren demonstrieren. Vom Cognitive-Walkthrough bis zur Experten-Evaluation über Usability-Tests.

Wir haben verschiedene Produkte validiert und erkannt, welche zum Teil katastrophalen Mängel diese Anwendungen haben.
Links zum Thema Usability
- Die Bundesanstalt für Arbeitsschutz und Arbeitsmedizin hat auch unter Mitwirkung von benannten Stellen das Ergonomiekompendium „Anwendung Ergonomischer Regeln und Prüfung der Gebrauchstauglichkeit von Produkten veröffentlich.
- Aus dem FDA-Umfeld stammt die ANSI/AAMI HE75:2009 — Human factors engineering – Design of medical devices
Beide Dokumente konzentrieren sich nicht auf Software. Dafür enthalten sie konkrete Vorgaben zur Spezifikation der Gebrauchstauglichkeit von Produkten – im Gegensatz zur IEC 62366-1, die eine Prozessnorm ist. Und noch etwas ist beiden Dokumenten gemein: ein Umfang von mehreren hundert Seiten.



Hallo,
danke für den Beitrag!
Etwas verwirrend erscheint allerdings das hierarchische Modell der Usability-Validierung. Demnach müsste die Usability-Verifizierung ein Teil der Usabiliy-Validierung sein, da diese im Beitrag als Inspektion dargestellt wird, welche wiederum in der Hierarchie ein Teil der Validierung ist?
Ist es nicht eher so, dass Validierung und Verifizierung ebenbürtig und auf einer Ebene stehen?
Anbei eine Abbildung meiner Gedankengänge:
http://ovh.to/QsjmMYi
Beste Grüße
Markus R.
Sie haben absolut Recht, das war ein Fehler. Ich wollte Usability-Bewertung geschrieben haben, hatte es aber Usability-Validierung genannt. Den Fehler habe ich behoben. Danke für den Hinweis!
Hallo,
Ich wurde letzthin mit der Frage konfrontiert, ob man vor einer klinischen Studie (mit einem neu entwickelten Device) eine summative Studie machen muss.
Nach meinem Verständnis würde ich die summative Studie erst nach einer klinischen Untersuchung machen. Auch während einer klinischen Studie könnten ja z.B. Anwendungsfehler beobachtet werden, welche dazu führen, dass man das Design nochmals anpasst…
(Auf jeden Fall würde ich vor der Studie formative Usability Tests durchführen, damit ich die sichere Anwendung während der klinischen sicherstellen kann.)
Wie sehen Sie das? Wird es irgendwo regulatorisch/gesetzlich verlangt, dass vor einer klinischen Studie eine summative Usability Validierung durchführt?
Vielen Dank und freundliche Grüsse
Marika M.
Sehr geehrte Frau Buratti,
besten Dank für Ihre spannende Frage!
I.d.R. muss man zuerst die summative Bewertung durchführen und damit die Einhaltung der grundlegenden Anforderungen soweit als möglich gewährleisten, bevor man Menschen dem Produkt aussetzt.
Ihre Argumentation, dass bei der klinischen Prüfung auch noch Hinweise auf Gebrauchstauglichkeitsprobleme liefern kann, ist stichhaltig. Eine Ethik-Kommission wird aber darauf bestehen, dass das Gerät so sicher wie möglich ist.
Wenn bei der klinischen Prüfung noch neue Hinweise auf Usability-Probleme auftauchen, dann war die summative Bewertung möglicherweise nicht gut geplant bzw. durchgeführt. Zudem können auch nach der Inverkehrbringung solche Probleme auftauchen. Auch dann ist der Hersteller verpflichtet, diese zu bewerten und ggf. das User Interface zu ändern.
Die regulatorische Anforderung, nach der Sie fragen, findet sich z.B. in der MPKPV §3.
Melden Sie sich bei weiteren Fragen gerne.
Mit herzlichen Grüßen, Christian Johner
Guten Tag,
meine Frage gliedert sich an den vorheigen Beitrag an: Wie kann ich Usability Tests durchführen, wenn der Anwender gleichzeitig der Patient ist, wie es zum Beispiel bei Geräten die zuhause benutzt werden oder Prothesen der Fall ist. Normalerweise dürfte man doch mit dem Produkt ohne CE Kennzeichen nicht an den Patienten außer bei klinischen Studien, oder?
Wie kann ich in diesem Fall einen Usability Test durchführen? Immer als Teil einer klinischen Studie?
Vielen Dank und viele Grüße
Gabriella H.
Sehr geehrte Frau H.,
es tut mir leid, dass ich Sie nicht mit ganzem Namen ansprechen darf.
Gerne beantworte ich Ihre Frage: Es gibt bei Produkten, bei denen der Patient der Anwender ist, durchaus Usability Tests, die nicht einer klinischen Prüfung entsprechen. Das ist immer z.B. dann der Fall, wenn die Nutzung während des Tests keine klinische Prüfung darstellt. Von einer klinischen Prüfung spricht man nur dann, wenn die Untersuchung (des Geräts) an einem Menschen stattfindet und sie die Ziele verfolgt, das Produkt bezüglich Sicherheit und Leistungsfähigkeit zu untersuchen.
Wenn ein Patient eine App ausprobiert, wäre das keine klinische Prüfung. Hingegen wäre ein Patient, der eine Prothese „ausprobieren“ soll, Teil einer klinischen Prüfung. In dem letzteren Fall lassen sich der Usability Test und die klinische Prüfung nur dann trennen, wenn z.B. nur die Gebrauchsanleitung geprüft würde.
Viele Grüße, Christian Johner
Lieber Herr Prof. Johner,
ich habe leider noch keinen Beitrag dazu gefunden, ob man, wenn man eine App abschließend testen möchte, mit beiden Betriebssystemen (iOS & Android) testen muss oder ob das eher empfohlen wird, aber nicht verpflichtend ist. Können Sie mir dazu ein Feedback geben?
LG und vielen Dank!
Sehr geehrte Frau Schmitt,
danke für Ihre heutige Anfrage!
Mit Ihrer Beobachtung haben Sie absolut Recht, dass dieser Beitrag fehlt. Sie merken das nur bei der Person an, die am meisten Beiträge veröffentlicht hat :-).
Eine generelle Antwort auf Ihre Frage kann es nicht geben. Das Vorgehen muss das Folgende sein:
Erstellen Sie eine Risikoanalyse. Finden Sie heraus, ob es Risiken gibt, die spezifisch für das Betriebssystem (und auch die damit verbundene Hardware) sind. Wenn es diese gibt, müssen sie Maßnahmen ergreifen und deren Wirksamkeit verifizieren. Das bedingt i.d.R. entsprechende Tests.
Meine sehr starke Vermutung wäre, dass Sie nicht nur Tests auf diesen Betriebssystemen und Betriebssystemversionen benötigen, sondern auch in verschiedenen Hardware-Konfigurationen. Die MDR ist in dieser Hinsicht sogar noch eindeutiger (s. Anhang II).
Mit den besten Grüßen, Christian Johner
Unter „Usability Validierung versus klinische Studien“ steht
(1) Genauso ist es! Bei der Validierung der Gebrauchstauglichkeit geht man davon aus, dass …
(2) Die Validierung der Gebrauchstauglichkeit prüft hingegen, ob …
Bei (1) und (2) steht „Validierung der Gebrauchstauglichkeit“? Ist dies korrekt, oder sollte bei (1) stehen „Verifizierung der Gebrauchstauglichkeit“, oder etwas anders – was? -, um sich von (2) zu unterscheiden.
Freundliche Grüsse
P.S. Vielen Dank für diesen tollen Service.. ihre tolle Homepage mit all diesen kurzen Fachberichten!
Guten Tag,
erstmal vielen Dank für das positive Feedback! Das freut uns sehr!
Sie haben recht, der Abschnitt ist ein wenig verwirrend. Wir haben den entsprechenden Absatz nun überarbeitet und die beiden Passagen gestrichen. Relevant ist vor allem die folgende Aussage weiter unten:
„1. Die Usability Studie hat zum Ziel zu validieren, ob die spezifizierten Nutzer im spezifizierten Nutzungskontext die spezifizierten Nutzungsziele effektiv und effizient erreichen können. Eine Voraussetzung für die Validierung der Usability sind repräsentative Nutzer.
2. Die klinischen Studien haben hingegen das Ziel nachzuweisen, dass das Produkt ein positives Nutzen-Risiko-Verhältnis hat. Voraussetzung für eine klinische Studie sind Patienten.“
Ich hoffe, der Abschnitt liest sich nun verständlicher.
Vielen Dank, dass Sie uns darauf aufmerksam gemacht haben!
Herzliche Grüße
Anja Segschneider | Redaktion
Liebes Johner Institut Team,
ich wollte mir gerade Ihre wertvolle Arbeit zu nutze machen und für mich kurz aufzeichnen was alles zur Produktvalidierung gehört und wie sich die einzelnen Bestandteile voneinander unterscheiden (z.B. Usability Validierung ist keine klinische Evaluation bzw. sollte beide Aktivitäten getrennt voneinander geplant und durchgeführt werden).
Unter der Überschrift „Klassische“ System-/Produkt-Validierung versus Usability Validierung wird auf einen weiteren Artikel verwiesen.
Trotz mehrmaligem Lesen des verlinkten und der darin verlinkten Artikel, ist mir nicht klar, was denn nun eine „klassische“ Produktvalidierung enthält und worin diese sich von der Usability Validierung bzw. klinischen Evaluation unterscheidet.
Könnten Sie den Punkt nochmal kurz aufgreifen und erklären?
Mit freundlichen Grüssen,
Bruno Beerendt
Lieber Herr Beerendt,
vielen Dank für Ihre Frage!
Der Begriff „klassische“ Validierung ist nicht definiert. Wir verwenden ihn, um folgenden Unterschied klar zu machen:
Unter klassischer Validierung verstehen wir den Nachweis, dass das Produkt seine Zweckbestimmung erreichen kann. Diese klassische Validierung stellt nicht notwendigerweise Usabilityaspekte in den Fokus und grenzt sich somit von der summativen Usabilityevaluierung ab. Zugegeben, sind die Grenzen hier fließend.
In unserem Artikel Verifizierung und Validierung haben wir genauer beschrieben, was wir unter klassischer Validierung verstehen:
„Klassische Validierung: Das ist die Prüfung, ob man mit dem Medizinprodukt das Nutzungsziel überhaupt erreichen kann.
Die klinische Bewertung ist ein Beispiel für eine solche Validierung. Für In-vitro-Diagnostika führt man eine klinische Leistungsbewertung durch.
Die Nutzungsziele finden sich in der Zweckbestimmung beschrieben.
Die klinische Bewertung bzw. Leistungsbewertung sind Teil der Validierung und müssen nachweisen, dass die Nutzungsziele erreicht werden, d. h., dass das Produkt sicher, leistungsfähig und wirksam ist.“
Ich hoffe, meine Antwort hilft Ihnen weiter. Ansonsten fragen Sie gerne nach.
Herzliche Grüße
Nils Becker