Eine der häufigsten Abweichungen bei Audits hat einen Bezug zur sogenannten „nachgelagerten Phase“.
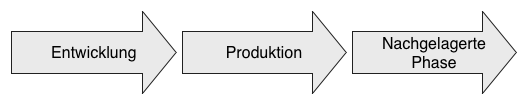
1. Ziele der nachgelagerten Phase
Die nachgelagerte Phase dient mit Bezug zum Risikomanagement mehreren Zwecken:
- Bisher nicht identifizierte Gefährdungen sollen anhand neuer Daten gefunden werden.
- Bereits gefundene Gefährdungen sollen bezüglich der Wahrscheinlichkeit und der Schwere daraus resultierender Schäden neu bewertet werden, d.h. Risiken sollen neu analysiert werden.
- Die Akzeptanz von Risiken muss neu überdacht werden. Beispielsweise kann ein veränderter Stand der Technik dazu führen, dass bisher akzeptable Risiken nun inakzeptabel sind.
- Man muss prüfen, ob es neue, das Risikomanagement betreffende Regularien gibt.
- Es sollen Maßnahmen ergriffen werden, um die Risiken zu minimieren, um Fehler zu beseitigen und diesen vorzubeugen.
Daneben soll die nachgelagerte Phase auch dabei unterstützen,
- schnellstmöglich auf Fehler in Medizinprodukten reagieren zu können,
- z.B. durch die Trendanalysen Hinweise zur kontinuierlichen Verbesserung des QM-Systems und damit der eigenen Prozesse zu erhalten und
- zu überprüfen, ob man den eigenen Qualitätsansprüchen gerecht geworden ist.
2. Nachgelagerte Phase: Regulatorische Anforderungen
Gleich mehrere Normen und Gesetze stellen Anforderungen an die nachgelagerte Phase.
a) ISO 14971 Kapitel 9
Die ISO 14971 nennt das Kapitel 9 „Informationen aus der Herstellung und der Herstellung nachgelagerten Phasen“. Darin fordert die Norm, dass Informationen aus dieser nachgelagerten Phase gesammelt und ausgewertet müssen, und zwar mit den oben genannten Zielen.
Die dritte Ausgabe der ISO 14971 (ISO 14971:2019) hat die Nummerierung geändert und dieses Kapitel umbenannt. Es heißt jetzt „Aktivitäten in der Herstellung und der Herstellung nachgelagerten Phasen“. Es wurde um drei Unterkapitel ergänzt:
- 10.1 Informationssammlung
- 10.2 Informationsüberprüfung
- 10.3 Maßnahmen
Mit diesen Ergänzungen stellt die Norm die Bedeutung der nachgelagerten Phase noch weiter heraus.
b) IEC 62304 Kapitel 9.6
Auch die IEC 62304 endet mit ihren Forderungen nicht beim Ende der Entwicklung. Vielmehr müssen Hersteller „eine Analyse durchführen, um bei Problemberichten Trends zu entdecken“. Auch das deckt sich mit den bereits oben genannten Zielen.
c) ISO 13485 Kapitel 8
Ebenso verlangt die ISO 13485, dass die „Organisation dokumentierte Verfahren zur Ermittlung, Erfassung und Analyse von Daten“ festlegt (z.B. von Rückmeldungen), mit dem Ziel das QM-System kontinuierlich zu verbessern und Schwachstellen zu identifizieren.
d) ISO 24971 und nachgelagerte Phase
Die ISO 14971 fordert in Kapitel 9, das Risikomanagement auch in den der Entwicklung nachgelagerten Phasen fortzuführen. Die ISO 24971, ein „Technical Report“, gibt weitere Hinweise zu diesem „Production and post-production feedback loop“. Die ISO 24971 empfiehlt im Rahmen der nachgelagerten Phase drei Schritte:
- Informationen sammeln
- Informationen bewerten
- Handeln
Zu diesen drei Schritten finden Sie im nächsten Kapitel Informationen zur praktischen Umsetzung.
3. Nachgelagerte Phase: Praktische Umsetzung
a) Schritt 1: Welche Informationen Sie berücksichtigen sollten
Zu den Informationen, die Hersteller sammeln sollten, zählen Informationen und Rückmeldungen
- aus der Entwicklungsabteilung oder von Entwicklungspartnern (Bei Software würde man hier auch die Release-Notes und Bug-Reports der SOUP-Hersteller berücksichtigen.),
- aus dem Service, von der Installation, vom Training,
- von Anwendern (z.B. Beschwerden, Ergebnisse von Umfragen, Anregungen),
- von Mitbewerbern (z.B. über die Fehlerdatenbanken der Behörden wie vom BfArM oder die MAUDE-Datenbank der FDA),
- von klinischen Studien, aus der entsprechenden Fachliteratur und sonstigen Veröffentlichungen,
- von Gesetzgebern und Standardisierungsorganisationen (z.B. neue oder geänderte Normen).
Die ISO 24971 erwähnt aber nicht nur die Quellen, sondern betont auch, dass diese Informationen neutral und auf einem zuverlässige Weg gesammelt und zum Hersteller zurückgeleitet werden sollten.
b) Schritt 2: Wie Sie die Informationen aus der nachgelagerten Phase bewerten sollten
Bei der Bewertung sollen die Hersteller die folgenden Fragen beantworten:
- Ist die Beobachtung relevant für die Sicherheit (Safety)?
- Stimmen diese Beobachtungen mit den Annahmen im Risikomanagement überein oder gilt es die Risikomanagementakte entsprechend zu überarbeiten?
- Müssen Maßnahmen ergriffen werden?
Im Auditgarant lernen Sie, Risikomanagementakten schnell und konform mit der ISO 14971 zu schreiben und aktuell zu halten – ganz den Forderungen der nachgelagerten Phase entsprechend.
c) Schritt 3: Handeln in der nachgelagerten Phase
Die Handlungsoptionen in der nachgelagerten Phase betreffen entweder das Produkt oder die Organisation bzw. Prozesse.
Beispiele für Handlungen mit Produktbezug:
- Produkt zurückziehen
- Produkt verbessern
- Zweckbestimmung des Produkts einschränken
- Informationen über das Produkt verbessern
- Kunden im Umgang mit dem Produkt schulen
Beispiele für Handlungen mit Bezug zur Organisation und zu Prozessen:
- Prozesse verbessern, SOPs ändern
- Anforderungen systematischer erheben
- System und Software-Architektur konsequenter und vor der Produktrealisierung einfordern
- Interne Audits und Reviews stärken
- Produkte systematischer testen
- Produktionsverfahren ändern
- Mitarbeiter schulen
- Lieferanten besser prüfen oder sorgfältiger auswählen
- Geeignetere Werkzeuge nutzen
- Bessere Infrastruktur und Arbeitsbedingungen sicherstellen
Die nachgelagerte Phase und die Post-Market-Surveillance (PMS) gehen Hand in Hand. Lesen Sie hier mehr zum PMS-Plan.
4. Nachgelagerte Phase und SOUP
Die ISO 14971 verlangt ein kontinuierliches Risikomanagement – auch nach der Entwicklung und Produktion von Medizinprodukten. Für uns Software-Entwickler zählt dazu, die Bug-Listen der SOUP-Hersteller zu untersuchen und die dort beschriebenen Fehler zu bewerten. Das bedingt natürlich, dass man überhaupt eine Liste aller SOUPs hat.
Das Johner Institut empfiehlt dazu eine Tabelle mit folgenden Spalten:
- Name der SOUP
- Version der SOUP
- Hersteller
- Links z.B. zum Download bzw. zu Bug-Listen
- Sicherheitsklassifizierung (die ist bei jeder SOUP spezifisch für jedes Medizinprodukt!!)

Die Firma Roche hat uns schön gezeigt, dass sie diese Form des Risikomanagements betreibt und in der BfArM-Meldung vom 15.02. auf ein Sicherheitsproblem durch eine fehlerhafte Komponente (SOUP) der Firma Oracle aufmerksam gemacht. Vorbildlich!
PS: Wenn Auditoren Risikomanagementakten prüfen, schauen sie häufig zuerst auf das Datum der letzten Änderung. Dann wissen sie, ob die nachgelagerte Phase gelebt wird.