Wenn die ANVISA-Registrierung nicht mehr ausreicht
Vor dem Verkauf Ihres Medizinprodukts in Brasilien müssen Sie als Hersteller einige Hürden nehmen. Die bekannteste ist die Registrierung bei ANVISA. Darüber hinaus benötigen Sie für Ihr Produkt gegebenenfalls auch eine Zertifizierung durch INMETRO oder ANATEL.
Hersteller sollten wissen, in welchen Fällen sie die INMETRO- oder ANTEL-Zertifizierung vorweisen und weitere Anforderungen erfüllen müssen. Andernfalls drohen bei der Zulassung böse Überraschungen: Der Zulassungsprozess verlängert sich und ungeplante Kosten entstehen.
In diesem Artikel erfahren Sie,
- unter welchen Umständen welche Behörden außer der ANVISA Ihr Produkt prüfen und
- wie Sie die notwendigen Prüfungen planen können.
Am besten lesen Sie zuerst den Artikel zur Zulassung von Medizinprodukten in Brasilien. Dort erfahren Sie auch, wie Sie Ihre Medizinprodukte in Brasilien klassifizieren und bei der ANVISA registrieren.
1. INMETRO- und ANATEL-Zertifikate als Teil der Zulassungsunterlagen
Bestimmte Produkte dürfen in Brasilien nur mit einer Zertifizierung durch INMETRO oder ANATEL vermarktet werden. Diese beiden Behörden sind für die Prüfung und Zertifizierung verantwortlich.
Hersteller dürfen die Registrierung für solche Medizinprodukte bei ANVISA erst dann beantragen, wenn sie das INMETRO- bzw. ANATEL-Zertifikat vorlegen können. Diese Zertifikate müssen bei ANVISA zusammen mit der Produktdokumentation eingereicht werden.
2. Die INMETRO-Zertifizierung
a) Wer die INMETRO ist
INMETRO ist das nationale Institut für Messtechnik, Qualität und Technologie. Die Behörde ist nicht nur für Medizinprodukte zuständig, sondern allgemein für Produkte, die zur Sicherheit und – im Fall von Medizinprodukten – zur Gesundheit von Menschen beitragen. Neben den Medizinprodukten zählen dazu beispielsweise Haushaltsgeräte, Räder, Reifen und Leuchten.
Durch die Prüfung wird gewährleistet, dass betroffene Produkte bestimmte Mindeststandards einhalten. Typischerweise sind dies nationale Versionen von internationalen Normen wie der ABNT NBR IEC 60601-1:2010 + Emenda 1:2016 oder ABNT NBR IEC 60601-1-2:2017.
Die Anforderungen an die INMETRO-Zertifizierung legt die Resolution 384/2020 fest. Es unterliegt jedoch nicht jedes Medizinprodukt der Prüfung durch INMETRO.
b) Welche Produkte betroffen sind
Medizinprodukte, die ein INMETRO-Zertifikat benötigen, sind unter anderem:
- Elektrische Geräte
- Sterile Injektionsspritzen zum Einmalgebrauch
- Brustimplantate
- Chirurgische und nicht-chirurgische Handschuhe aus Kautschuk
- Kondome
Die komplette Produktliste, die größtenteils Nicht-Medizinprodukte enthält, können Sie hier einsehen.
Ob eine INMETRO-Zertifizierung notwendig ist, ist unabhängig von der Klassifizierung Ihres Medizinprodukts. Auch für Klasse-I-Produkte kann eine Zertifizierung erforderlich sein.
c) Wie man zum INMETRO-Zertifikat gelangt
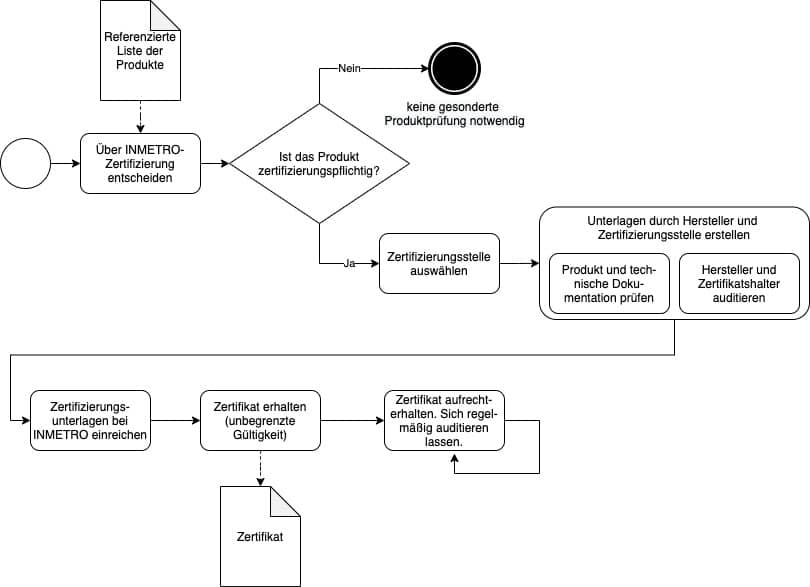
Auswahl einer geeigneten Zertifizierungsstelle
Die Prüfung und das zugehörige Zertifikat können von INMETRO selbst ausgestellt werden oder von einer Stelle, die die INMETRO anerkennt.
Für die Beantragung der Zertifizierung benötigen Sie eine brasilianische Firma als Bevollmächtigten. Das bedeutet, dass Sie ohne Sitz in Brasilien einen brasilianischen Zertifikatshalter benötigen. Hier bietet sich Ihr Zulassungspartner an, mit dem Sie die ANVISA-Registrierung planen. Dieser lokale Partner sollte Sie bei der Auswahl einer geeigneten Zertifizierungsstelle unterstützen.
Die Zertifizierung selbst besteht aus zwei Teilen:
- Produktprüfung inklusive Prüfung der technischen Dokumentation
- Audit des Herstellers und des brasilianischen INMETRO-Zertifikathalters
Zertifizierung (Teil 1): Produktprüfung
Für die Produktprüfung müssen Sie u. a. folgende Unterlagen einreichen:
- Risikomanagementakte
- Gebrauchstauglichkeitsakte
- Dokumentation zutreffender QM- und Herstellprozesse
- Testberichte (sofern vorhanden)
Wurde Ihr Produkt bereits geprüft, ist es möglich, bestehende Testberichte für die INMETRO-Zertifizierung heranzuziehen. Die genauen Voraussetzungen hierfür sollten Sie mit Ihrer Zertifizierungsstelle abstimmen.
Oftmals werden Testberichte akzeptiert, die die folgenden Bedingungen erfüllen:
- Der Bericht bildet den aktuellen technischen Stand des Produkts ab.
- Er wurde von einer ILAC-zertifizierten Stelle erstellt.
- Es wurde gegen die von INMETRO und ANVISA anerkannten Normen(versionen) geprüft.
Beachten Sie, dass nur eine ILAC-zertifizierte Stelle die Produktprüfungen durchführen darf. Andernfalls müssen die Produkttests wiederholt werden.
ILAC ist eine internationale Vereinigung von Akkreditierungsstellen, der beispielsweise die DAkkS angehört.
Auf der INMETRO Webseite finden Sie eine Liste von INMETRO-akkreditierten Stellen.
Anmerkung:
Die anerkannten Normen(versionen) finden Sie in sogenannten normativen Anweisungen (Instrução Normativa):
- IN 29/2018
- IN 22/2017
- IN 4/2015
Verfügen Sie noch nicht über Testberichte, wird Ihr Produkt im Rahmen der INMETRO-Zertifizierung geprüft. Die Zertifizierung kann sich dadurch verlängern. Entsprechend steigen auch die Kosten für die Zertifizierung.
Zertifizierung (Teil 2): Audits
Fokus der Audits ist die Überprüfung der Einhaltung von INMETRO-Vorgaben. Dazu zählen Anforderungen an das QM-System nach ISO 13485 (z.B. Design und Entwicklung, Produktion) und Anforderungen an 100% Prüfungen (z.B. Leckstrom oder Erdung gemäß IEC 60601-1).
Beim brasilianischen Zertifikats-Halter müssen ebenfalls Audits durchgeführt werden, die genau wie die Hersteller-Audits die Überprüfung bestimmter Kriterien der ISO 13485 (u.a. Dokumentenlenkung, nicht-konforme Produkte, Korrekturmaßnahmen) im Fokus haben.
d) Wie lange der Prozess zum INMETRO-Zertifikat dauert und was er kostet
Die Zertifizierung durch INMETRO kann mehrere Monate in Anspruch nehmen. Das Zertifikat ist seit Dezember 2020 unbegrenzt gültig, solange Sie durch Audits die Überprüfungen zur Aufrechterhaltung durchführen lassen.
Beachten Sie, dass für die Aufrechterhaltung des INMETRO-Zertifikats – und somit auch Ihrer Produktzulassung bei ANVISA – alle 15 Monate ein Audit durch die Zertifizierungsstelle notwendig ist. Das Audit erfolgt im Rahmen einer Dokumentenprüfung oder eines Vor-Ort-Audits.
Für die Aufrechterhaltung müssen Sie Kosten zwischen 2.500 USD und 5.000 USD veranschlagen. Hinzu kommen die Kosten Ihres lokalen Zertifikathalters.
Die genauen Kosten für die INMETRO-Zertifizierung hängen von der jeweiligen Zertifizierungsstelle und den durchzuführenden Tests ab. Oftmals bieten brasilianische Stellen eine günstige Zertifizierung an. Sie arbeiten dann jedoch mit Auditoren im Herkunftsland des Herstellers zusammen, wodurch die Preise je nach Land variieren können.
3. Die ANATEL-Zertifizierung
a) Wer die ANATEL ist
ANATEL ist die nationale Telekommunikationsbehörde Brasiliens. Sie verlangt, dass alle Telekommunikationsprodukte, die in Brasilien verkauft werden, über ein Konformitätszertifikat verfügen. Diese Pflicht gilt auch für entsprechende Medizinprodukte. Folglich ist für diese Produkte bei ANVISA das ANATEL-Zertifikat einzureichen.
Ebenso wie beim INMETRO-Zertifikat hängt es nicht von der Produktklasse ab, ob es notwendig ist, ein ANATEL-Zertifikat einzureichen: Hersteller benötigen auch für bestimmte Klasse-I-Produkte ein ANATEL-Zertifikat.
Beachten Sie, dass von ANATEL nur brasilianische Produkttests anerkannt werden. Das bedeutet, dass Sie Ihr Produkt u. U. zusätzlich für den brasilianischen Markt prüfen lassen müssen.
Die allgemeinen Anforderungen an die ANATEL-Zertifizierung sind in der Resolution 715/2019 festgehalten.
b) Welche Produkte betroffen sind
Alle Produkte, die über ein Funkmodul verfügen, benötigen eine Zertifizierung durch ANATEL. Dies betrifft zum Beispiel Produkte mit einer Bluetooth- oder WIFI-Schnittstelle.
Betroffene Produkte müssen ein Konformitätsbewertungsverfahren durchlaufen. Dieses schließt die Produktprüfung in Brasilien und eine Prüfung der technischen Dokumentation ein.
c) Wie man zum ANATEL-Zertifikat gelangt
In den Zertifizierungsprozess sind verschiedene Akteure eingebunden:
- Der Hersteller des Medizinprodukts
- Ein lokaler Repräsentant (Rep) in Brasilien
- Ein Prüflabor
- Eine Zertifizierungsstelle (OCD)
- ANATEL
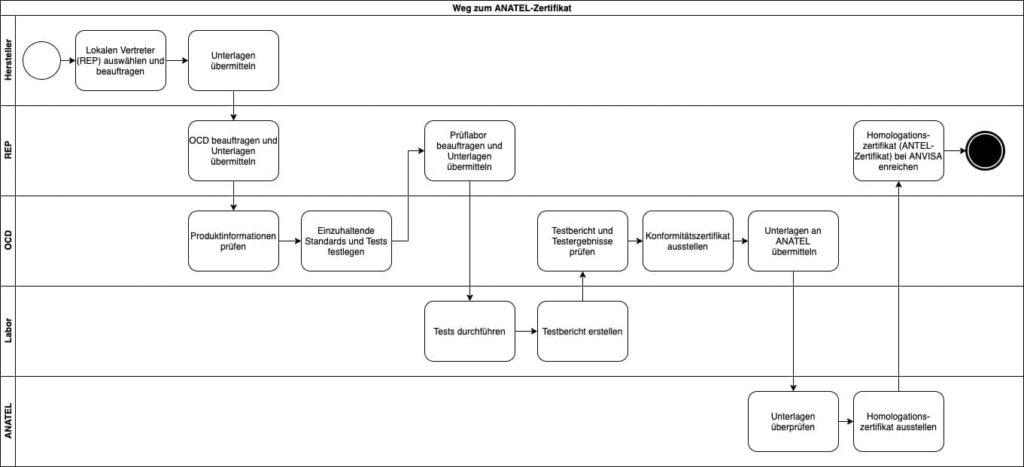
Im ersten Schritt benötigt ein Hersteller ohne Niederlassung in Brasilien einen lokalen Repräsentanten (Rep), da es nur brasilianischen Unternehmen möglich ist, eine Zulassung durch ANATEL zu beantragen.
Der lokale Repräsentant wird in Zusammenarbeit mit dem Hersteller eine Zertifizierungsstelle beauftragen, eine sogenannte OCD (Organismo de Certificação Designado). Die OCD ist dafür verantwortlich, die einzuhaltenden Standards und notwendigen Tests zu ermitteln.
Hierzu erhält sie vom Hersteller technische Produktinformationen, z. B.:
- Spezifikationen
- Zeichnungen
- Produktkennzeichnung
Auf der ANATEL Webseite finden Sie eine Liste der von ANATEL anerkannten OCDs.
Im Anschluss beauftragt der lokale Repräsentant ein Prüflabor mit der Durchführung der notwendigen Produkttests.
Die OCD prüft nach Abschluss der Tests die vorliegenden Prüfberichte, stellt ein Konformitätszertifikat aus und übermittelt die Daten an ANATEL.
Im letzten Schritt prüft ANATEL die übermittelten Daten und stellt bei Erfüllung der Anforderungen ein Homologationszertifikat aus. Dieses ANATEL-Zertifikat ist notwendig für die Produktzulassung bei ANVISA.
d) Wie lange der Prozess zum ANATEL-Zertifikat dauert und was er kostet
Die Kosten und die Dauer der Zertifizierung hängen maßgeblich von den folgenden Faktoren ab:
- Verfügbarkeit der Testlabore
- Testaufwand
- Zu prüfende Technologie
So ist beispielsweise die Prüfung für ein Produkt, das über eine Bluetooth-2.0-Schnittstelle verfügt, weniger zeit- und kostenaufwendig als die Prüfung eines Produkts mit 4G-Technologie.
Für den gesamten Zertifizierungsprozess sollten Hersteller etwa sechs Monate veranschlagen. Der Prozess beinhaltet die Produktprüfung, die bis zu drei Monate in Anspruch nehmen kann, sowie die anschließende Ausstellung des „Homologationszertifikats“.
Dieses Homologationszertifikat von ANATEL ist unbegrenzt gültig. Jedoch muss die OCD die von ihr ausgestellten Zertifikate überwachen. So ist alle 24 Monate eine Überprüfung der Dokumentation durch die OCD notwendig, um das ANATEL-Zertifikat und somit auch die Produktzulassung bei ANVISA aufrechtzuerhalten. Dabei prüft die OCD, ob die Spezifikationen gleich geblieben sind oder sich geändert haben. Bei Änderungen von Anforderungen prüft die OCD, ob die von ihr ausgestellten Zertifikate noch gültig sind. In diesem Fall ist auch die technische Dokumentation einzureichen. Unter Umständen wird bei Änderungen des Produkts eine neue Prüfung notwendig.
4. Fazit
Bei einigen Produkten müssen Sie als Hersteller spezifische Anforderungen erfüllen und ein INMETRO- und ANATEL-Zertifikat vorweisen. Dennoch sind die Hürden für die Produktzulassung in Brasilien nicht unüberwindbar. Für diese Zulassung benötigen Sie als ausländischer Hersteller einen lokalen Repräsentanten. Daher ist dessen umsichtige Auswahl die wohl wichtigste Voraussetzung für eine erfolgreiche Zulassung.
Wenn Sie zudem alle geltenden Anforderungen erfüllen sowie die Aufwände für die Zertifizierungen kennen, können Sie Ihre Zulassung erfolgreich planen und durchführen.
Wenn Sie Hilfe bei der Zulassung in Brasilien wünschen, z. B. bei der Klassifizierung, bei der INMETRO- und ANATEL-Zertifizierung oder bei der ANVISA-Registrierung, dann melden Sie sich. Sie können dazu unser Kontaktformular nutzen. Die Berater:innen des Johner Instituts helfen Ihnen gerne. Dies tun sie im Rahmen des Micro-Consulting sogar kostenlos.




Hallo Frau Seidenfaden,
ich hätte eine kurze Frage da ich aus der Liste der INMETRO-pflichtigen Devices nicht ganz schlau werde. Sind AIMD INMETRO-pflichtig? Es werden ja nur lapidar elektrische Geräte genannt und als einziges Implantate habe ich nur Brustimplantat gefunden.
Ich vermute zwar, dass dies so ist, hätte aber gern Ihre Bestätigung.
Vielen Dank bereits vorab für eine kurze Info.
Viele Grüße,
Joachim Schneider
Sehr geehrter Herr Schneider,
herzlichen Dank für Ihre Rückfrage.
Ja, Sie haben recht, dass diese Anforderung sehr allgemein formuliert ist. Nach meinem Kenntnisstand sind sämtliche elektrische Medizinprodukte von dieser Anforderung betroffen. Wenn Sie nun ein aktives Implantat haben, wird hierfür eine INMETRO-Zertifizierung notwendig sein. Kontaktieren Sie im ersten Schritt Ihren Repräsentanten in Brasilien, um eine INMETRO-akkreditierte Stelle zu wählen und das weitere Vorgehen zu planen.
Herzliche Grüße,
Margret Seidenfaden