Regulatory Intelligence halten viele Firmen für so wichtig, dass sie dafür eigene Rollen und Abteilungen schaffen.
Dieser Artikel klärt, was Regulatory Intelligence ist, welchen Nutzen Firmen davon haben und wo Tools unterstützen können. Er enthält einen Podcast, in der eine Führungskraft aus dem Bereich Regulatory Intelligence Einblick in ihren Arbeitsalltag gibt.

Dieser Artikel hat als Schwerpunkt das Medizinprodukte-Ökosystem, aber die Aussagen lassen sich fast ausnahmslos auf die Regulatory Intelligence bei Pharmafirmen übertragen.
1. Was ist „Regulatory Intelligence“?
Regulatory Intelligence ist ein systematischer Prozess des Sammelns, Analysierens und Verbreitens von Informationen über regulatorische Anforderungen, Strategien und Richtlinien, die sich auf die Entwicklung, die Herstellung, den Vertrieb sowie die Überwachung und Regulierung von Medizinprodukten auswirken.
Quelle: Johner Institut
Dazu gehört das Sammeln und Analysieren von Informationen über gesetzliche Vorschriften aus verschiedenen Quellen, darunter Aufsichtsbehörden, Branchenverbände und Fachpublikationen.
„Intelligence“ ist nicht nur mit „Intelligenz“ zu übersetzen, sondern auch mit „Information“ und „Erkenntnis“.
Das ist vergleichbar mit der CIA, die im Deutschen nicht als „Intelligenzbehörde“ bezeichnet würde. Sie sammelt und bewertet Informationen und gibt ihre Erkenntnisse an relevante Empfänger weiter.
2. Was ist das Ziel von Regulatory Intelligence?
Das Ziel von Regulatory Intelligence bei Herstellern ist es, den Führungskräften fortlaufend die neusten Informationen zur Verfügung zu stellen. Diese benötigen sie, um in den folgenden Bereichen fundierte Entscheidungen zu treffen:
- Über zu entwickelnde Medizinprodukte entscheiden
- Festlegen, in welche Märkte die Produkte gebracht werden und in welcher Reihenfolge
- Die aktuellen und künftigen regulatorischen Anforderungen in diesen Märkten bestimmen
- Entscheiden, ob man bei geplanten regulatorischen Vorgaben mitwirken oder Einwände erheben will
- Aufwände, Dauern und Kosten abschätzen, um die regulatorischen Anforderungen zu erfüllen
- Sicherstellen, dass die notwendigen Personen mit den benötigten Qualifikationen und Kompetenzen bereitstehen
- Weitere Ressourcen einplanen und organisieren (Dienstleister, Tools, finanzielle Mittel)
Hersteller sind dazu verpflichtet, die regulatorischen Anforderungen systematisch zu erfassen. Die ISO 13485 enthält diese Forderung z. B. im Kapitel 5.2.
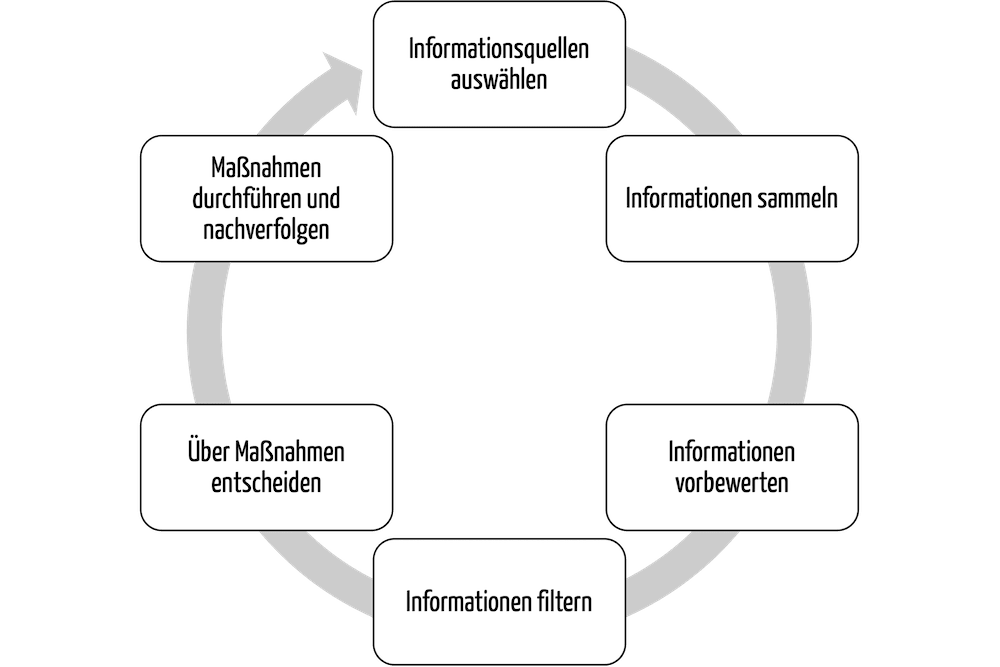
3. Wem nützt Regulatory Intelligence?
Regulatory Intelligence ist für eine Vielzahl von Akteuren wichtig, die an Entwicklung, Herstellung, Vertrieb, Überwachung und Regulierung von Medizinprodukten beteiligt sind. Dazu gehören Hersteller von Medizinprodukten, Fachleute für regulatorische Angelegenheiten, klinische Forscher und Gesundheitsdienstleister (s. Tabelle 1).
| Rolle, Akteure | Anspruch an die Regulatory Intelligence |
| Hersteller | Siehe Liste im Abschnitt 2 |
| Gesundheitsdienstleister | – Über den Einkauf von Medizinprodukten entscheiden – Produkte gesetzeskonform betreiben – Patienten gesetzeskonform informieren – Sicherheit, Leistungsfähigkeit und Verfügbarkeit von Medizinprodukten abschätzen |
| Behörden, Benannte Stellen | – Eigene Mitarbeitende auf künftige Vorgaben vorbereiten – Hersteller über diese Vorgaben informieren – Konformität der Produkte und Hersteller bei der Zulassung und während der Marktüberwachung sicherstellen |
| Klinische Forscher | – Regulatorische Anforderungen verstehen – Märkte für klinische Studien auswählen – Klinische Studien gesetzeskonform planen und durchführen |
| Gesetzgeber | – Eigene Vorhaben mit anderen Gesetzgebern abstimmen – Auswirkungen der Regulierung modellieren und antizipieren (s. Regulatory Science) |
ROCHE’s „Head Translational Policy – Global Regulatory Policy and Intelligence“ berichtet im Podcast über die Bedeutung der Regulatory Intelligence für seinen Konzern.
Diese und weitere Podcast-Episoden finden Sie auch hier.
4. Welche Daten werden wo gesammelt?
a) Inhalte
Um die o. g. Ziele zu erreichen, müssen alle regulatorisch relevanten Inhalte gesammelt werden:
- Neue Vorgaben oder neue Versionen von regulatorischen Vorgaben wie Normen, Gesetze, Leitlinien, Verordnungen, Richtlinien, Best Practices usw.
- Art der Änderungen
- Datum der Gültigkeit und Übergangsfristen
- Ankündigung von regulatorischen Änderungen
- Aufrufe zur Kommentierung oder Erstellung von regulatorisch relevanten Dokumenten
b) Quellen
Zu den Quellen zählen inzwischen vornehmlich:
- Webseiten und dort publizierte Dokumente
- webbasierten Datenbanken
- Newsletter
- Online-Foren
- Social Media
Seltener sind Veröffentlichungen in gedruckten Publikationen wie Zeitschriften. Physische Rundschreiben und Aushänge sind die Ausnahme.
Einige Informationen sind nicht offiziell, sondern lassen sich nur über persönliche Kontakte in Erfahrung bringen.
5. Gibt es Tools für Regulatory Intelligence?
Für Medizinprodukte gibt es Dienstleistungen und Software-Anwendungen, die das Sammeln und Bewerten von regulatorischen Informationen unterstützen.
Diese Services übernehmen für die Auftraggeber (z. B. für Hersteller) viele Aufgaben wie das Sammeln, das (Vor)bewerten und das Filtern der Informationen. Sie unterstützen auch beim Ableiten der notwendigen Maßnahmen.
Diese Maßnahmen umzusetzen, ist immer die Aufgabe des jeweiligen Auftraggebers (s. Tabelle 2).
| Aufgabe | Dienstleister | Auftraggeber (Hersteller, Behörde, Benannte Stelle) |
| Informationen sammeln | X | |
| Informationen (vor)bewerten | X | |
| Informationen für Auftraggeber filtern | X | |
| Über Maßnahmen entscheiden | X | X |
| Maßnahmen umsetzen | (X) | X |
| Umsetzung nachverfolgen | (X) | X |
Beispiele für Maßnahmen sind:
- Verfahrensanweisungen und andere Vorgabedokumente anpassen
- Gap-Analysen durchführen, um die Konformität der Produkte und der Organisation mit aktuellen Versionen regulatorischer Dokumente zu prüfen
- Regulatorische Strategien aktualisieren (z. B. Reihenfolge von Zielmärkten)
- Mitarbeitende und Lieferanten informieren oder/und qualifizieren
Service-Anbieter wie das Johner Institut helfen mit maßgeschneiderten Dienstleistungen und Software, um die Umsetzung der Maßnahmen nachzuverfolgen und sicherzustellen.
6. Fazit und Zusammenfassung
Insgesamt spielt der Bereich Regulatory Intelligence eine entscheidende Rolle, um der Pflicht gerecht zu werden,
- die Beteiligten über die gesetzlichen Anforderungen und Änderungen in der Medizinproduktebranche auf dem Laufenden zu halten und
- die notwendigen Maßnahmen zu ergreifen.
Durch den Zugang zu regulatorischen Informationen und Analysen helfen die Tools den Beteiligten, fundierte Entscheidungen über die Entwicklung von Medizinprodukten, die Einhaltung von Vorschriften und den Marktzugang zu treffen und so Wettbewerbsvorteile zu erlangen.
Für die meisten Organisationen ist es wirtschaftlich sinnvoll, Fleißarbeiten an Dienstleister auszulagern und so vom „Leverage“ und einer höheren Güte der Suchergebnisse zu profitieren.
Hunderte Hersteller nutzen den Regulatory Radar, den Regulatory Intelligence Service des Johner Instituts. Dieser überwacht mehr als 8500 regulatorisch relevante Dokumente.
Melden Sie sich, um zu erfahren, wie Sie mit dem Regulatory Radar Zeit und Geld sparen und Ihre Compliance sichern.




