Auf die Frage, was ein Design Review sei, bekommt man häufig unterschiedliche Antworten — abhängig davon, ob man einen Entwickler oder einen Qualitätsmanager fragt. Genau diese unterschiedlichen Sichten können im Audit zum Problem werden.
Begriffsdefinition: Was versteht man unter einem Design Review?
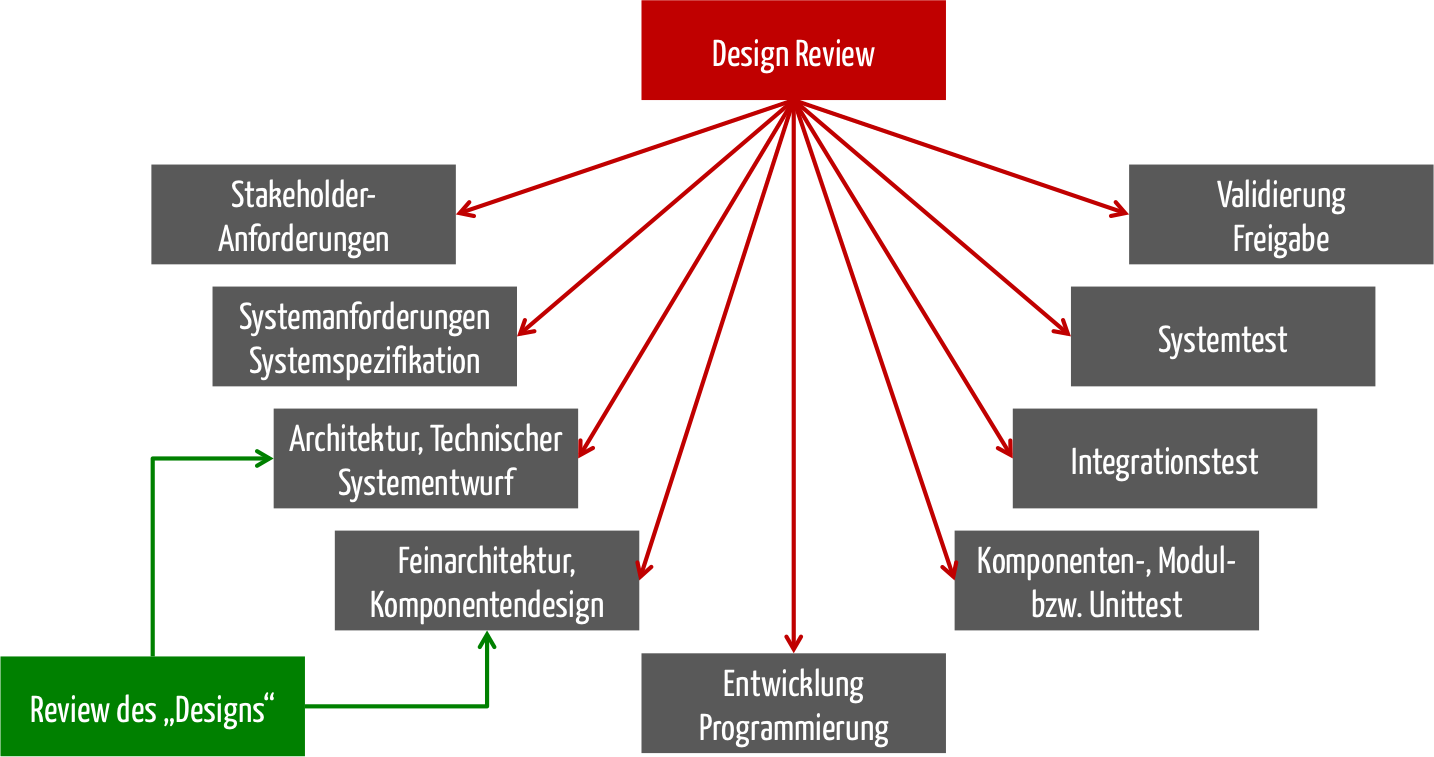
Viele Entwickler „missverstehen“ unter dem Begriff Design Review ein Review des Designs. Bei einer eigenständigen Software entspräche letzteres dem, was die IEC 62304 mit der Verifizierung der Architektur bzw. des detaillierten Designs meint. Das entspricht aber nicht dem Design Review im Sinne der ISO 13485 und der FDA (21 CFR part 820.30(e)).
Beide Regularien meinen mit dem Design Review die Bewertung der Entwicklung. Diese Bewertung sollte mehrfach während bzw. nach der Entwicklung stattfinden.
Ziele des Design Reviews
Das Design Review hat zum Ziel, innezuhalten und zu prüfen, ob man noch auf dem richtigen Weg ist. Das betrifft Fragen wie:
- Haben wir die richtigen Anforderungen unserer Kunden identifiziert?
- Sind die (bisherigen) Entwicklungsergebnisse geeignet, die Anforderungen zu erfüllen?
- Gibt es neue Erkenntnisse, die die Beteiligten kennen sollten?
- Wird das Produkt so entwickelt, dass es später problemlos produziert werden kann?
- Sind die Risiken im Sinn der ISO 14971 konsequent analysiert, den Beteiligten bekannt, und sind geeignete Maßnahmen gefunden und implementiert?
- Ist das Projekt auf Spur? Liegt es im Zeitplan?
- Sind alle Dokumente erstellt, die zu diesem Projektfortschritt vorliegen sollten?
Es geht also um weit mehr, als nur darum eine System- oder Software-Architektur zu bewerten. Vielmehr soll dieses Design Review das Team synchronisieren und den ganzen Entwicklungsprozess kritisch hinterfragen.
Benötigen Sie Unterstützung dabei, ein ISO 13485 oder/und FDA-konformes QM-System zu etablieren oder zu verbessern? Unser Expertenteam unterstützt Sie gerne! Nehmen Sie einfach Kontakt auf.
Design Review: Regulatorische Anforderungen
Forderungen der ISO 13485 an die „Designbewertung“
Die ISO 13485 übersetzt in Kapitel 7.3.5 „Design and Development Review“ als Entwicklungsbewertung. Die Norm verlangt diese Bewertungen „in geeigneten Phasen“ mit dem Ziel, die Fähigkeit zu beurteilen, ob die Design und Entwicklungsergebnisse die Anforderungen erfüllen und um Probleme zu erkennen sowie um notwendige Maßnahmen vorzuschlagen.
Forderungen der FDA an das „Design Review“
Die FDA definiert ein „Design Review“ als eine dokumentierte, vollständige und systematische Untersuchung des Designs mit dem Ziel zu prüfen, ob die Anforderungen an das Design adäquat sind, ob das Design diese Anforderungen tatsächlich erfüllt, und um Probleme zu identifizieren. Der CFR part 820.30(e) formuliert die Anforderungen an das Design Review:
- Each manufacturer shall establish and maintain procedures to ensure that formal documented reviews of the design results are planned and conducted at appropriate stages of the device’s design development.
- The procedures shall ensure that participants at each design review include representatives of all functions concerned with the design stage being reviewed and an individual(s) who does not have direct responsibility for the design stage being reviewed, as well as any specialists needed.
- The results of a design review, including identification of the design, the date, and the individual(s) performing the review, shall be documented in the design history file (the DHF).
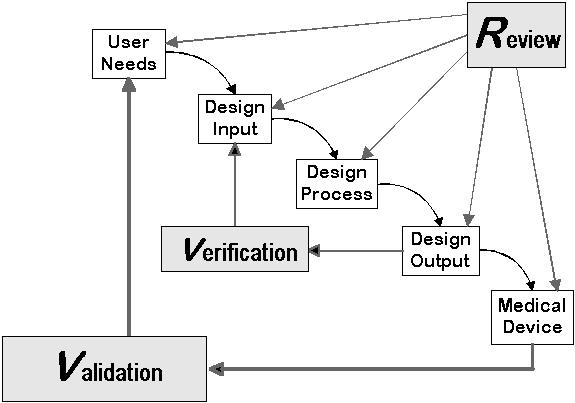
Vergleich der Anforderungen der FDA und ISO 13485
Beide Regularien sehen als Ziele des Design Reviews:
- Prüfen, ob das Design die Anforderungen an das Produkt bzw. dessen Design erfüllt.
- Probleme identifizieren.
Weiter fordern beide
- Reviews (Plural), also mehrere dieser Prüfungen,
- die Beteiligung der notwendigen Vertreter
- die Design Reviews gemäß eine dokumentierten Verfahrens durchzuführen und die Ergebnisse ebenfalls zu dokumentieren.
Beide Regularien sind somit nahezu deckungsgleich.
Ein Design Review planen und durchführen
Ein Design Review muss ein dokumentiertes Verfahren sein. Damit muss im QM-System festgelegt werden,
- wann das Design Review stattfinden muss. Das kann z.B. zu bestimmten Zeitpunkten oder zum Ende bestimmter Phasen oder Meilenseine sein.
- welche Rollen an diesem Review teilnehmen. Wir empfehlen zumindest den Entwicklungsleiter, Qualitätsmanager, Risikomanager, Produktmanager und Projektleiter.
- welche Aspekte beim Review zu prüfen und
- wie die Ergebnisse zu dokumentieren sind.
Wenn Sie Hilfe benötigen, eine ISO 13485-konforme Verfahrensanweisung (SOP) „Design Review“ zu erstellen, wenn Sie Templates oder Checklisten benötigen oder Unterstützung wünschen, um Ihr QM-System mit wenigen Tagen unserer Hilfe vollständig und auditsicher zu etablieren, dann melden Sie sich bei uns.
Ein Design Review auditieren
Ein Auditor würde im Rahmen eines internen Audits oder externen Audits beispielsweise folgende Aspekte prüfen:
- Bei welchen Meilensteinen oder zu welchen Zeitpunkten prüft der Hersteller das Design?
- Wie erweitert sich der Schwerpunkt des Design Reviews, die später im Entwicklungsprozess stattfinden, auf die Verifizierung und Validierung der Medizinprodukte?
- Kann der Hersteller zeigen, auf welche Abweichungen oder Probleme er dabei gestoßen ist und welche Maßnahmen ergriffen wurden?
- Welche Personen bzw. Rollen nahmen an den Reviews teil? Welche Spezialisten wurden ggf. hinzugezogen?
- Hat der Hersteller sowohl die Verfahrensanweisung als auch die Ergebnisse der Design Reviews sowie die getroffenen Maßnahmen dokumentiert? Beziehen sich die Ergebnisse auf eine eindeutige Version eines Produkts? Ist die Verfahrensanweisung gelenkt?
Unser Team besteht auch ISO 13485 Lead-Auditoren, die Ihnen bei Fragen gerne zur Verfügung stehen. Auch kostenlos.



