Die ISO 9001 ist eine Norm, die Anforderungen an QM-Systeme stellt ähnlich wie die ISO 13485 dies tut. Die ISO 9001 ist zwar nicht für die EU-Medizinprodukteverordnungen (MDR, IVDR) harmonisiert, sie kann aber in Einzelfällen dennoch hilfreich oder sogar notwendig sein.
Die Übersichtsseite zu QM-Systemen verschafft einen schnellen Einstieg und Überblick und verweist auf weitere Fachartikel.
1. Zusammenspiel von ISO 9001 und ISO 13485
a) Gemeinsame Historie
Beide Qualitätsnormen waren viele Jahre fast buchstabengleich. Die Kapitelstruktur („High-level Structure“) war sogar völlig identisch.
Nach vielen Jahren, in denen es nur redaktionelle Änderungen gab, erschien im September 2015 die ISO 9001:2015 ineiner grundlegend überarbeiteten Version. Die Unterschiede auch zur neusten Version der ISO 13485 sind groß, was eine gemeinsame Zertifizierung nach beiden Normen deutlich erschwert.
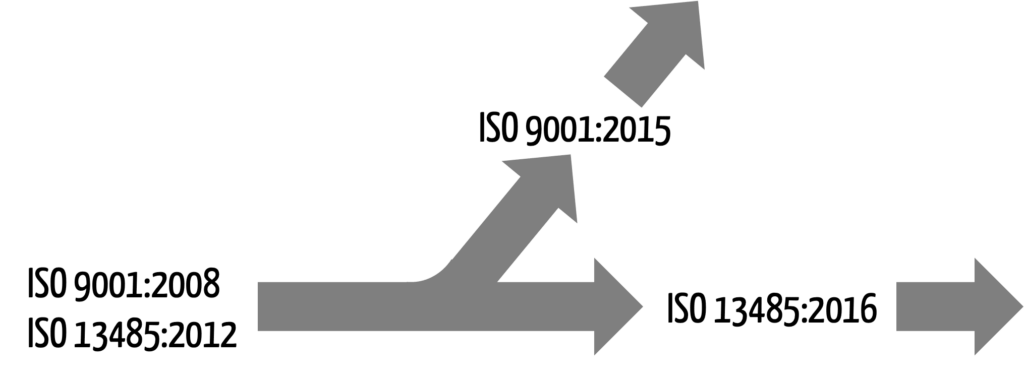
b) Unterschiedliche Zielsetzungen
Die ISO 9001:2015 ist eine „echte Qualitätsmanagementnorm“: Bei ihr steht die Kundenzufriedenheit absolut im Zentrum.
Die ISO 13485 nimmt dies zwar auch für sich in Anspruch. Aber die eigentliche Zielsetzung ist eine andere: Die Norm möchte sicherstellen:
- Die regulatorische Konformität der Hersteller und deren Produkte mit den gesetzlichen Anforderungen
- Die Sicherheit dieser Medizinprodukte.
2. Anforderungen der ISO 9001
a) Übersicht
Die ISO 9001 hat weiterhin viele gemeinsame Anforderungen mit der ISO 13485:
- Verpflichtung der Leitung
- Planung eines QM-Systems
- Sicherstellung der notwendigen Ressourcen
- Sicherstellung des Bewusstseins für die Bedeutung des QM-Systems
- Verfahrensanweisungen z.B. für die Entwicklung und Produktion
- Kontinuierliche Messung und Verbesserung inklusive interne Audits und Management Reviews
Sie können sich die Mindmap als Teil des Starter-Kits im XMind-Format und als PDF herunterladen.
Eine preiswerte Version der Norm finden Sie bei der Standardisierungsorganisation Estlands.
b) Nennenswerte Unterschiede zwischen den beiden QM-Normen
Der offensichtlichste Unterschied bestand schon immer darin, dass die ISO 9001 „branchenneutral“ ist, wohingegen der Anwendungsbereich der ISO 13485 sich ausschließlich auf Medizinprodukte beschränkt.
Seit der Version 2015 der ISO 9001 sind die Unterschiede größer geworden. Die Norm …
- hat eine andere (logischere) Kapitelstruktur,
- fordert kein QM-Handbuch,
- verlangt im Gegensatz, dass die Unternehmenschancen und -risiken systematisch bewertet werden und Eingang in die Qualitätsziele und Gestaltung der Prozesse der finden,
- legt einen Wert auf das Bewusstsein über die Qualitätsziele, die Bedeutung des QM-Systems und die notwendigen Kompetenzen,
- beschreibt genauer als die ISO 13485 die Anforderungen an die Kommunikation mit Kunden und Lieferanten,
- nimmt die Führungsebene noch stärker in die Pflicht und
- legt expliziter Wert auf eine kontinuierliche Verbesserung des QM-Systems als die ISO 13485.
3. Relevanz der ISO 9001 im Kontext der Medizinprodukte
Für die MDR und die IVDR ist nur ISO 13485 harmonisiert. Damit ist die ISO 9001 wenig(er) hilfreich beim Nachweis, dass die Anforderungen an ein QM-System erfüllt sind, welche die MDR und IVDR im jeweiligen Artikel 10 und Anhang IX formulieren.
Dennoch kann unter Umständen eine Zertifizierung nach ISO 9001 für einige Unternehmen sinnvoll sein:
- Das Unternehmen ist nicht nur im Medizinproduktebereich tätig und möchte sein Qualitätsbewusstsein zum Ausdruck bringen. Das gelingt mit der bekannteren „9001“ besser.
- Es gibt Unternehmen, die zwar im Kontext der Medizinprodukte arbeiten, deren Tätigkeiten aber nicht oder nicht ausschließlich in den Anwendungsbereich der ISO 13485 fallen (z.B. Beratungsunternehmen) oder für welche die Benannten Stellen nicht akkreditiert sind.
- Die Unternehmen haben nicht nur die Konformität des eigenen Unternehmens und der eigenen Produkte im Fokus, sondern wollen explizit auch Forderungen nach einem Unternehmensrisikomanagement umsetzen.
- Die Unternehmen benötigen die ISO 13485 Zertifizierung nicht, die ihnen auch zu teuer und aufwändig ist.
Die Erfahrung zeigt, dass die Auditoren Benannter Stellen strenger als die Prüfer anderer Zertifizierungsunternehmen urteilen, selbst bei identischen normativen Anforderungen.
5. Fazit und Zusammenfassung
Die ISO 9001:2015 stellt im Vergleich zu ihrer Vorgängerversion eine wirkliche Verbesserung dar. Umso bedauerlicher ist es, dass die ISO 13485 ab der Version 2016 dem nicht gefolgt ist.
Die Aufwände, um zusätzlich die Anforderungen ISO 13485:2016 zu erfüllen, sind noch beherrschbar. Das liegt u.a. an Folgendem:
- Die Auditoren der Benannten Stellen haben ihren Schwerpunkt auf der ISO 13485. Sie sind darauf viel gründlicher geschult als auf die ISO 9001:2015.
- Die neuen und zusätzlichen Anforderungen der ISO 9001:2015 sind überschaubar.
- Teilweise wurden sogar Anforderungen entfernt.
Firmen, die „nur“ nach ISO 9001:2015 zertifiziert sind, werden sich deutlich schwerer tun, auch ein ISO-13485-Audit zu bestehen als umgekehrt. Das liegt zum einen an den höheren Anforderungen der ISO 13485 und zum anderen an den meist strengeren Auditoren.
Haben Sie noch Fragen, beispielsweise zum Aufbau eines QM-Systems? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Team des Johner Instituts hilft Ihnen beim Aufbau von QM-Systemen und bei der Vorbereitung auf Audits durch Benannte Stellen.
Gerne übernehmen wir auch die Rolle des externen Qualitätsmanagementbeauftragten (QMB).
Änderungshistorie
- 2023-04-17: Artikel komplett überarbeitet
- 2016-11-08: Erste Version erstellt




Hallo Herr Johner,
sind die von Ihnen genannten Deltas das „einzige“ was zu tun ist, um ein ISO 9001 Audit parelell zu einem ISO 13485 Audit zu bestehen?
1.) Chancen und Risiken (SWAT-Analyse)
2.) Wissensmanagement
3.) Kommunikationswege
4.) Qualitätspolotik (Wer macht was bis wann?)
5.) Bedingungen, unter denen die Mitarbeiter arbeiten
Liebe Grüße,
Philipp Ott
Lieber Herr Ott,
die genannten Punkte sind mit die wichtigsten. Es gibt noch einige mehr. Allerdings sind die Auditoren in erster Linie ISO 13485-Auditoren und keine ISO 9001-Auditoren. Die meisten denken eh noch in der alten ISO 9001-Welt (also vor Version 2015), weshalb ich es noch nicht erlebt habe, dass eine Firma wegen der ISO 9001 im Audit Probleme hatte.
Viele Grüße
Christian Johner
Sehr geehrter Herr Johner,
die MDR fordert in Artikel 9 die kontinuierliche Verbesserung des QMS.
Das tut die ISO 13485 im Gegensatz zur ISO 9001 bekanntlich nicht.
Sind diese Forderungen trotzdem in das QMS zu integrieren, um eine Zertifikat ISO 13485 zu erhalten, obwohl die Norm an dieser Stelle nicht die Erfüllung regulatorischer Anforderungen fordert? Und wenn nicht, gilt das für alle zusätzlichen Anforderungen der MDR, wenn die Norm nicht ausdrücklich auf die zusätzlichen regulatorischen Anforderungen verweist?
Sehr geehrter Herr Lauf,
danke für die spannende Frage!
Ich vermute, dass Sie sich auf Artikel 10 (9) beziehen.
Da primär die Anforderungen der MDR für die Konformitätsbewertung relevant sind und da die MDR, wie Sie richtig schreiben, die kontinuierliche Verbesserung des QMS fordert, sollten Sie diese Anforderung nach kontinuierlicher Verbesserung erfüllen.
Generell können Gesetze (hier MDR) über die Anforderungen von harmonisierten Normen hinausgehen, genauso können Normen Anforderungen stellen, die so nicht im Gesetz verankert sind. Diese Zuordnung finden Sie i.d.R. in den Z-Anhängen der Normen.
Abgesehen davon verweisen die Normen nicht auf regulatorische Anforderungen, da diese i.d.R. lokale Anforderungen sind, die Normen aber international sind.
Viele Grüße
Christian Johner
Guten Abend,
kann man sich nach ISO 13485 zertifizieren lassen auch wenn man keine Medizinprodukte herstellt?
Beste Grüße
V. Engels
Hallo,
Sie können die Norm auch anwenden, wenn Sie keine Medizinprodukte herstellen, sondern anderweitig am Produktlebenszyklus beteiligt sind. Die Norm schreibt dazu: „Diese Internationale Norm legt Anforderungen an ein Qualitätsmanagementsystem fest, das durch eine Organisation angewendet werden kann, die an einer oder mehreren Stufen des Lebenszyklus eines Medizinprodukts beteiligt ist, einschließlich Entwicklung, Produktion, Lagerung und Vertrieb, Installation, Instandhaltung und endgültige Außerbetriebnahme und Entsorgung von Medizinprodukten sowie Entwicklung oder Bereitstellung von damit zusammenhängenden Tätigkeiten (z. B. technischer Support).“ Auch als Lieferant oder Dienstleister im Medizinprodukteumfeld, kann die Norm sinnvoll anwendbar für Sie sein. Die Anforderungen sind insgesamt auf die Sicherstellung von Sicherheit und Leistungsfähigkeit der Medizinprodukte, sowie regulatorische Sicherheit ausgelegt.
Herzliche Grüße,
Claudia Volk