Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen.
Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Sie finden in diesem Beitrag auch ein Template zum Download.
1. QM-Handbuch: Ziel und Zweck
Das QM-Handbuch soll als zentraler Einstiegspunkt für Personen dienen, die das ganze QM-System kennenlernen wollen wie Mitarbeitende, Auditoren und Kunden. Das Handbuch soll vermitteln:
- Übersicht über die Inhalte und den Aufbau des QM-Systems
- „Philosophie“, die Werte und die Qualitätspolitik des Unternehmens
- Zusammenspiel der Prozesse
Da das QM-Handbuch noch keine Betriebsgeheimnisse wie konkrete Verfahren beschreibt (sondern diese nur referenziert), geben manche Firmen das QM-Handbuch an Kunden weiter.
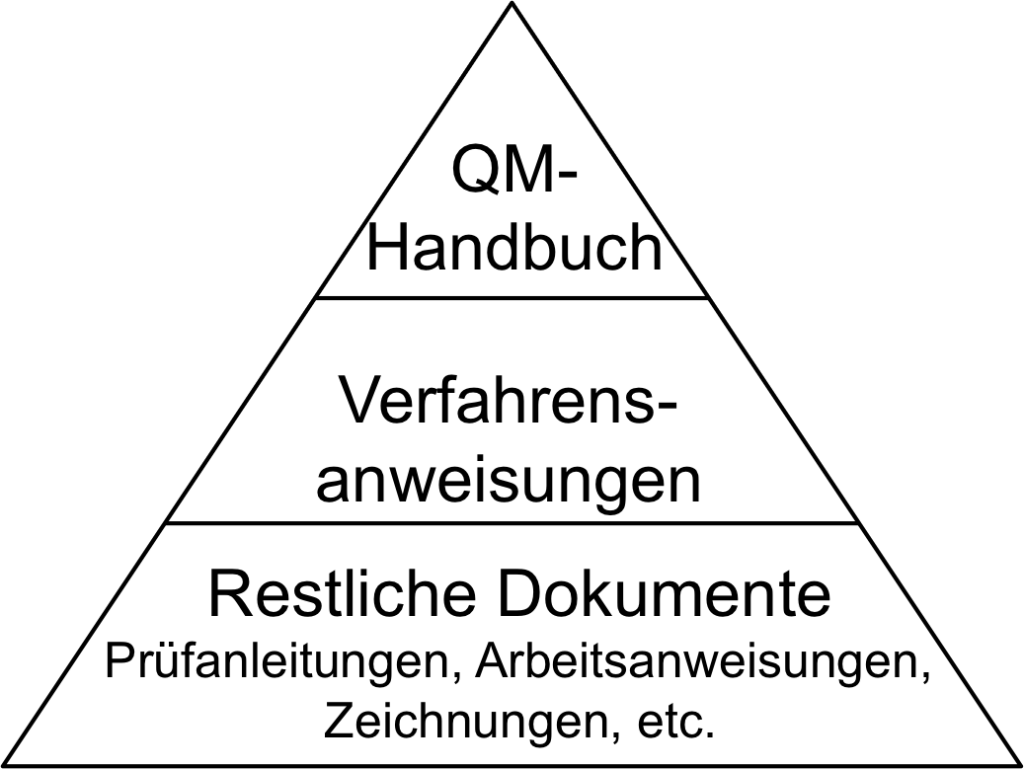
2. Inhalt des QM-Handbuchs
a) Übersicht
Das QM-Handbuch enthält typischerweise globale Festlegungen insbesondere die Qualitätspolitik und die Qualitätsziele. Es gibt zudem eine Übersicht über
- die Organisationsstruktur der Firma
- die Dokumentenstruktur des QM-Systems
- die Rollen, die im Rahmen dieses QM-Systems besetzt sind (nennt aber keine konkreten Personen).
In einigen Fällen integrieren die Firmen die Verfahrensanweisungen in das QM-Handbuch.
Lesen Sie hier einige Argumente für und wider der Integration von Verfahrensanweisungen in das QM-Handbuch und hier mehr zum Schreiben einer firmenspezifischen Qualitätspolitik sowie Qualitätszielen.
b) Beispiel für Kapitelstruktur
Das Johner Institut nutzt in seinen Kundenprojekte regelmäßig die folgende Kapitelstruktur für das QM-Handbuch seiner Kunden:
- Zweck
- Anwendungsbereich, Verantwortung & Ausschlüsse
- a) Anwendungsbereich
- b) Verantwortung
- c) Anwendbare Normen, Richtlinien & Gesetze
- d) Ausschlüsse & Nicht-Anwendung
- Über uns
- a) Unsere Firma
- b) Unsere Qualitätspolitik und Qualitätsziele
- c) Unsere Organisation & Rollen
- Aufbau der QM-Dokumentation
- a) Qualitätsmanagementhandbuch
- b) Verfahrens- und Arbeitsanweisungen
- c) Weitere Vorgabedokumente
- d) Aufzeichnungen
- Prozesse
- a) Prozessübersicht & -interaktion
- b) Führungsprozesse
- c) Kernprozesse
- d) Unterstützende Prozesse
- Generelle Regeln
- a) Interne Kommunikation
- b) Eigentum des Kunden
- Anhang
- a) Relevante Dokumente
- b) Glossar
Sie können sich einen Ausschnitt eines QM-Handbuchs hier als Template herunterladen.
3. Regulatorische Anforderungen
a) MDR, IVDR
Die EU-Medizinprodukteverordnungen MDR und IVDR fordern in den Anhängen IX (z.B. im Abschnitt 2.2) ein Qualitätsmanagementhandbuch:
Durch die Umsetzung des Qualitätsmanagementsystems wird die Einhaltung dieser Verordnung sichergestellt. Alle Einzelheiten, Anforderungen und Vorkehrungen, die der Hersteller für sein Qualitätsmanagementsystem zugrunde legt, werden in Form eines Qualitätshandbuchs und schriftlicher Grundsätze und Verfahren wie etwa Qualitätssicherungsprogramme, -pläne und -berichte systematisch und geordnet dokumentiert.
MDR Anhang IX, Abschnitt 2.2.
b) ISO 13485
Auch die ISO 13485 besteht im gleichnamigen Kapitel 4.2.2 („Qualitätsmanagement-Handbuch“) auf einem solchen. Es muss regeln:
- Anwendungsbereich (auch Ausschlüsse)
- Verfahren (kann auch durch Verweise erfolgen)
- Beschreibung der Wechselwirkungen der Prozesse
- Struktur der Dokumentation
4. Tipps zum QM-Handbuch
a) Typische Fehler vermeiden
„Nein, das glaube ich nicht“ antworten manche QM-Beauftrage auf die Frage, ob sie glaubten, dass Handbuch würde jemals gelesen.
Damit ist das Qualitätsmanagement zu einer völlig nutzlosen, sogar die eigentliche Arbeit behindernden Institution geworden. Ein Blick in das QM-Handbuch lässt verstehen, weshalb dieses Handbuch niemals jemand lesen möchte.
- Nichtssagende QM-Ziele
Die Firma will zufriedene Kunden!? Wirklich!? Das sollte selbstverständlich sein. Aber was macht diese Firma wirklich aus? Was kann sie besser als Ihre Konkurrenz? Was schätzen die Kunden tatsächlich an ihr? - Unspezifisch und unvollständig
Bei den Geschäftsaktivitäten steht, dass medizinische Software entwickelt würde. Das ist bei einer Firma, die medizinische Software entwickelt nicht überraschend. Gibt es auch einen Support? Betreibt sie die Anwendung selbst? Führt sie Schulungen durch? Installationen beim Kunden? Wenn die Firma nicht einmal genau weiß oder beschreibt, was sie tut, was soll dann im Handbuch stehen? - Unkonkret
Das QM-Handbuch übernimmt die Normenforderungen weitgehend unverändert. Jede praktische Anleitung fehlt. Keine Templates, keine Werkzeuge, keine Qualitätsmetriken. Das gleiche Handbuch hätte man auch für ein Logistikunternehmen oder eine Reinigungsfirma gelten können.
Solche Handbücher sind absolut wertlos.
Im Artikel zur Qualitätspolitik und den Qualitätszielen finden Sie praktische und spezifische Beispiele und Anregungen.
b) Top-Down vorgehen
Das Problem bei der Erstellung ist aber meist nicht (nur) der QM-Beauftragte, sondern die Führungsebene. Denn QM funktioniert auch Top-Down:
- Die Führung muss ganz präzise klar machen, was die Firma ausmacht. Was ihre Philosophie und Ziele sind. Nennen Sie das auch Vision und Strategie.
- Daraus leiten Sie die Qualitätspolitik ab. Wenn eine Firma der Kostenführer sein will, ist das eine andere Politik als bei einer Firma, bei der die Patientensicherheit wirklich im Vordergrund steht.
- Aus der Qualitätspolitik ergeben sich die Qualitätsziele. Zu jedem Qualitätsziel definiert man eine oder mehrere Metriken. Und für jede dieser Metriken einen Zielwert.
- Dann bestimmt und beschreibt man die Geschäftstätigkeiten, speziell die für den Kunden erbrachten Dienstleistungen und Produkte.
- Dann beschreibt man die (internen) Prozesse, um diese Dienstleistungen und Produkte zu erstellen. Beispielsweise gehören zur Erstellung von medizinischer Software sicher Prozesse dazu wie das Risikomanagement, das Usability Engineering und die Softwareentwicklung.
c) Weitere Informationen berücksichtigen
Wenn Sie unsicher sind, wie man ein wirkungsvolles QM-System etabliert, dann fragen Sie uns.
Kontakt mit den QM-Experten des Johner Instituts aufnehmen
Änderungshistorie
- 2023-08-16: Kapitel mit regulatorischen Vorgaben eingefügt. Redaktionelle Änderungen
- 2018-05: Erste Version erstellt





test
Guten Tag Herr Johner,
gemäß ISO 13485 Abschnitt 4.1.1 muss die Organisation die Rollen, die von der Organisation unter den anwendbaren regulatorischen Anforderungen übernommen werden dokumentiert werden. Wir würden diese Rollen im QM-Handbuch festlegen. Jedoch bin ich mir unsicher welche Rollen auf uns zutreffen. Z.B. haben wir Produktionsstandorte in Brasilien. Auf dem Labelling dieser Produkte sind wir als gesetzlicher Hersteller angegeben. Da die Produkte über unseren österreichischen Standort direkt an Krankenhäuser geliefert werden, würde ich uns die Rollen Hersteller, Importeur und Vertriebspartner zuordnen.
Ist das richtig so? Ich bin mir unsicher, da unter der MDR die Definition der Wirtschaftsakteure anders ist.
Vielen Dank im Voraus.
Schöne Grüße,
Karl Heinz
Sehr geehrter Karl Heinz,
Ich sehe das genauso wie Sie: Sie scheinen Hersteller und Händler zu sein. Wenn das aber zusammenfällt, erübrigen sich die entsprechenden Forderungen der MDR weitestgehend. Ob Sie ein Importeur im Sinne der MDR sind, glaube ich eher nicht. Mir sieht es eher so aus, dass Sie einen ausgelagerten Prozess (Produktion) in Brasilien haben.
Beste Grüße, Christian Johner