Abweichungen, Nichtkonformitäten, Fehler, Findings und weitere Begriffe werden fälschlicherweise oft synonym verwendet. Sogar Normen widersprechen sich bei der Definition einzelner Begriffe explizit.
Dieser Artikel klärt,
- wie die Begriffe zu verstehen sind,
- was die Ursachen und Folgen von Nichtkonformitäten sind und
- wie Medizinprodukthersteller diese Abweichungen und Nichtkonformitäten vermeiden können.
1. Nichtkonformitäten: Die Grundlagen
1.1 Definitionen
1.1.1 Nichtkonformität
Die ISO 9000:2015 definiert den Begriff Nichtkonformität mit „Nichterfüllung einer Anforderung“. Sie setzt diesen Begriff mit dem Begriff „Fehler“ gleich. Dem widerspricht die ISO 13485.
Die Norm verwendet bewusst den Begriff „Nichtkonformität“ und nicht den Begriff „Fehler“. Beide Begriffe sind nicht inhaltsidentisch. „Fehler“ ist ein juristisch geprägter Begriff, der in der Sachmängelgewährleistung und der Produkthaftung eine Rolle spielt. Die „Nichtkonformität“ weicht hiervon insofern ab, als die herstellereigenen Spezifikationen weiter oder anders sein können als diejenigen, welche mit dem Kunden vereinbart wurden oder vom Markt erwartet werden.
Quelle: ISO 13485:2021
Die FDA definiert den Begriff ähnlich wie die ISO 9000:
Nonconformity means the nonfulfillment of a specified requirement.
Quelle: 21 CFR part 820.3(q)
1.1.2 Abweichung
Den Begriff Abweichung definieren weder die ISO 9000 noch die ISO 13485. Umgangssprachlich wird er meist synonym mit Nichtkonformität verwendet.
Der Begriff stammt eher aus dem Automobilbereich um die IATF 16949. Diese Norm verwendet zwar auch den Begriff „Nichtkonformität“. Allerdings nutzt das ergänzende Regelwerk (Rules for achieving and maintaining IATF Recognition IATF Rules 5th Edition) auch den Begriff „Abweichung“ und unterscheidet dabei zwischen Haupt- und Nebenabweichung.
Im Medizinprodukte-Ökosystem werden diese Haupt- und Nebenabweichungen mit den Major Nonconformities und Minor Nonconformities bei Audits gleichgesetzt.
Im Englischen wird konsistent von “nonconformity” gesprochen.
1.1.3 Findings
Regelmäßig hört man die Aussage, dass es bei einem Audit ein Finding gab. Gemeint ist eine Nicht-Konformität. Diese umgangssprachliche Verwendung deckt sich nicht mit der Definition des Begriffs:
results of the evaluation of the collected audit evidence against audit criteria
Quelle: ISO 9001:2015
Auditfeststellungen, also “Ergebnisse der Beurteilung der zusammengestellten Auditnachweise gegen Auditkriterien”, sind somit bei Audits zwangsläufig. D. h. nicht, dass Findings automatisch etwas Negatives sind, was es zu vermeiden gilt. Bei Abweichungen bzw. Nichtkonformitäten ist das anders.
1.1.4 Mangel
Auch der Begriff Mangel sollte nicht mit dem Begriff Nichtkonformität gleichgesetzt werden.
“Die Unterscheidung zwischen den Begriffen Mangel und Nichtkonformität ist wegen ihrer rechtlichen Bedeutung wichtig, insbesondere derjenigen, die im Zusammenhang mit Produkt- (3.7.6) und Dienstleistungshaftungsfragen (3.7.7) steht.”
Quelle: ISO 9000:2015
1.1.5 Weitere Begriffe
Selbst die FDA ist nicht ganz konsistent. Sie nutzt im Kontext von Inspektionen weitere Begriffe wie Deviation, Nonconformance, Observation und Violation, ohne diese zu definieren. Beispiele dafür finden sich im Compliance Program Guidance Manual, Inspection of Medical Device Manufacturers, im QSIT und im Investigations Operations Manual.
1.2 Beispiele für Nichtkonformitäten
Nichtkonformitäten finden sich sowohl bei Produkten als auch bei Prozessen.
1.2.1 Nichtkonforme Prozesse
Beispiele für nichtkonforme Prozesse sind
- Prozesse, die überhaupt nicht gelebt oder nicht gemäß dokumentierter Verfahrensanweisungen durchgeführt werden.
Beispiel: Es hat keine Bewertung der Kompetenz der Mitarbeiter stattgefunden. - Prozesse, die nicht definiert sind.
Beispiel: Es fehlt ein Prozess, um Nichtkonformitäten zu bewerten und zu beheben. - Prozesse, die die Vorgaben einer Norm oder einer gesetzlichen Vorgabe nicht erfüllen.
Beispiel: Die Verfahrensanweisung verlangt nicht, dass Reklamationen daraufhin bewertet werden müssen, ob eine Reklamation ein meldepflichtiges Vorkommnis darstellt.
Diese Nichtkonformitäten werden typischerweise bei Audits und Inspektionen festgestellt.
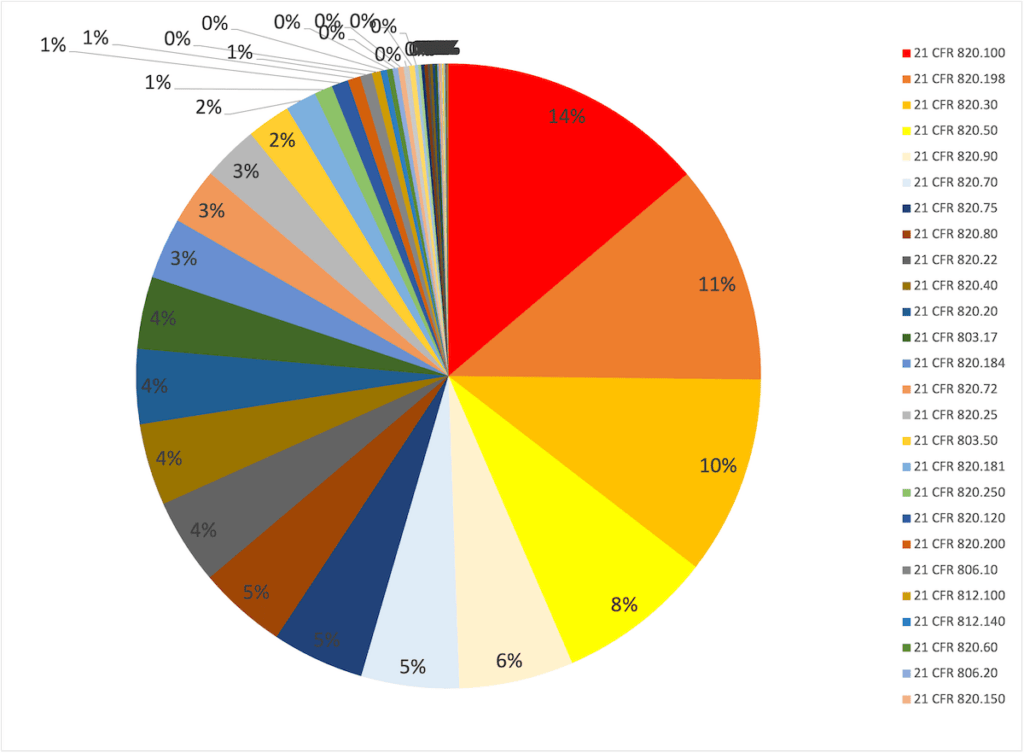
Fast die Hälfte der Nichtkonformitäten, welche die FDA im Jahr 2023 bei Inspektionen festgestellt hat, sind:
| Regulatorische Anforderung | Beschreibung | Anteil |
| 21 CFR 820.100 | Corrective and preventive actions | 14 % |
| 21 CFR 820.198 | Complaint handling | 11 % |
| 21 CFR 820.30 | Design control | 10 % |
| 21 CFR 820.50 | Supplier | 8 % |
| 21 CFR 820.90 | Handling of non-conforming products | 6 % |
| Rest | 51 % |
1.2.2 Nichtkonforme Produkte
Beispiele für nichtkonforme Produkte sind:
- Produkte, deren Gebrauchstauglichkeit nicht nachgewiesen wurde
- Medizinische-elektrische Geräte mit zu hohen Ableitströmen
- Produkte, die die ausgelobte Spezifikation nicht erfüllen
- Produkte, deren medizinischer Nutzen nicht nachgewiesen wurde und/oder bei denen dieser Nutzen nicht die Risiken überwiegt
- Instrumente, welche toxische Substanzen an den Körper abgeben
2. Folgen von Nichtkonformitäten
Die Folgen von Nichtkonformitäten hängen von den möglichen Folgen dieser Nichtkonformitäten ab:
- Beschlagnahmung oder/und Vernichtung der Produkte durch die Behörde
- Verpflichtung zum Rückruf der Produkte durch den Hersteller
- Zertifikatsentzug
- Warning Letters
- Strafverfolgung
- Importstopp
- Behörden-Inspektion
- Bußgelder
- Pflicht zur Behebung der Nichtkonformitäten und deren Ursachen (Corrective Actions)
Beispielsweise gibt das MPDG der Behörde die folgenden Rechte:
Die zuständige Behörde ist insbesondere befugt, im Geltungsbereich dieses Gesetzes
1. das Inverkehrbringen oder die Inbetriebnahme des Produktes zu verbieten oder einzuschränken,
2. die Bereitstellung eines Produktes auf dem Markt zu verbieten oder einzuschränken,
3. Maßnahmen anzuordnen, die gewährleisten, dass ein Produkt erst in den Verkehr gebracht oder auf dem Markt bereitgestellt wird, wenn geeignete und leicht verständliche Sicherheitshinweise in der Kennzeichnung oder in der Gebrauchsanweisung aufgeführt werden,
4. die Rücknahme oder den Rückruf eines auf dem Markt bereitgestellten Produktes anzuordnen,
5. das Betreiben oder Anwenden des betroffenen Produktes zu verbieten oder einzuschränken,
6. anzuordnen, dass die Öffentlichkeit vor den Risiken gewarnt wird, die mit einem auf dem Markt bereitgestellten Produkt verbunden sind; die zuständige Behörde kann selbst die Öffentlichkeit warnen, wenn der Wirtschaftsakteur nicht oder nicht rechtzeitig warnt oder eine andere ebenso wirksame Maßnahme nicht oder nicht rechtzeitig trifft.
MPDG § 74, Verfahren zum Schutz vor Risiken, Abschnitt 2
Die MDR berechtigt die Behörden zu folgenden Maßnahmen:
Die zuständigen Behörden können Produkte, die ein unvertretbares Risiko darstellen, oder gefälschte Produkte beschlagnahmen, vernichten oder auf andere Weise unbrauchbar machen, wenn sie dies im Interesse des Schutzes der öffentlichen Gesundheit für erforderlich erachten.
MDR, Artikel 93, Absatz 5
3. Ursachen von Abweichungen bzw. Nichtkonformitäten
Die Ursachen sind vielfältig. Allerdings lassen sie sich meist auf einen der folgenden Gründe zurückführen:
- Den Verantwortlichen sind die gesetzlichen und normativen Vorgaben nicht bekannt.
- Die gesetzlichen und normativen Vorgaben wurden nicht richtig verstanden und umgesetzt.
- Die gesetzlichen und normativen Vorgaben wurden wissentlich ignoriert.
- Die eigenen, firmeninternen Vorgaben sind zu kompliziert.
- Das Management hat die Wichtigkeit und den Sinn der Vorgaben nicht an die Mitarbeitenden vermittelt.
4. Abweichungen finden und vermeiden
4.1 Abweichungen finden
Hersteller sollten selbst nach Abweichungen suchen, indem sie:
- Interne Audits durchführen (Pflicht der ISO 13485)
- Tests durchführen zum Auffinden von Nichtkonformitäten, eventuell auch automatisiert
- Inspektionen und Reviews von Produkten sowie Dokumenten durchführen
Für diese Prüfungen können Hersteller externe Expertise heranziehen, beispielsweise für interne Audits und Mock-Inspektionen.
Die Expertinnen und Experten des Johner Institut führen diese Audits und Mock-Inspektionen durch. Dabei identifizieren sie nicht nur mögliche Nichtkonformitäten, sondern geben konkrete Hilfestellungen, um diese Nichtkonformitäten zu beseitigen und künftig zu vermeiden.
4.2. Abweichungen vermeiden
Ein umfassendes Qualitätsmanagement setzt den Fokus nicht nur auf das Finden von Nichtkonformitäten, sondern auch auf das Vermeiden dieser Nichtkonformitäten.
- Hersteller sollten ihre Prozesse so gestalten, dass diese verständlich, sinnvoll und schlank sind. Auf diese Weise lassen sich Abweichungen von vornherein vermeiden.
- Hersteller können externe Expertise heranziehen, um sich die Vorgaben und deren Auslegung durch die Prüfer und Behörden erklären zu lassen.
- Hersteller sollten Methoden/Werkzeuge bzw. Tools nutzen, um Abweichungen zu vermeiden, beispielsweise durch automatisierte Workflows, elektronische Formulare mit Prüfung, Systeme zur Schulung und Dokumentation der Schulung von Mitarbeitenden.
5. Fazit und Zusammenfassung
Der Begriff Abweichung wird nur umgangssprachlich genutzt. Daher empfiehlt es sich, von Nichtkonformitäten zu sprechen, auch wenn die FDA verschiedene Begriffe verwendet, vermischt und nicht definiert.
Gleich, ob Abweichung oder Nichtkonformität: Hersteller müssen diese Defizite vermeiden oder zumindest identifizieren und eliminieren. Denn die Folgen sowohl für Hersteller als auch für Einzelpersonen sind weitreichend und schließen Strafverfolgung und das Aus der Firma ein.
Herstellern, deren Behörde oder Benannte Stelle Nichtkonformitäten festgestellt hat und mit Konsequenzen droht, springt das Johner Institut mit seinem Remediation Service zur Seite.


