Bei vielen Konformitätsbewertungsverfahren müssen die Hersteller Benannte Stellen beteiligen und dafür einen Antrag auf Zertifizierung einreichen.
Beim Erstellen dieses Antrags sollten Hersteller sehr sorgfältig vorgehen, weil die Benannte Stelle eine Ablehnung in der EUDAMED dokumentieren muss. Solch eine Ablehnung kann ein Signal sein für andere Benannte Stellen.
1. Ablauf der Antragstellung
Die Benannten Stellen müssen „eine öffentlich zugängliche Beschreibung des Antragsverfahrens, über das Hersteller von ihr eine Zertifizierung erhalten können“ publizieren. Dieser Pflicht kommen die Benannten Stellen nach, wenn sie diese Beschreibung auf ihren Webseiten veröffentlichen.
Hersteller sollten dann eine Anfrage stellen, um beispielsweise die Vertragsmodalitäten zu erfahren. Sie dürfen mehrere Benannte Stellen anfragen.
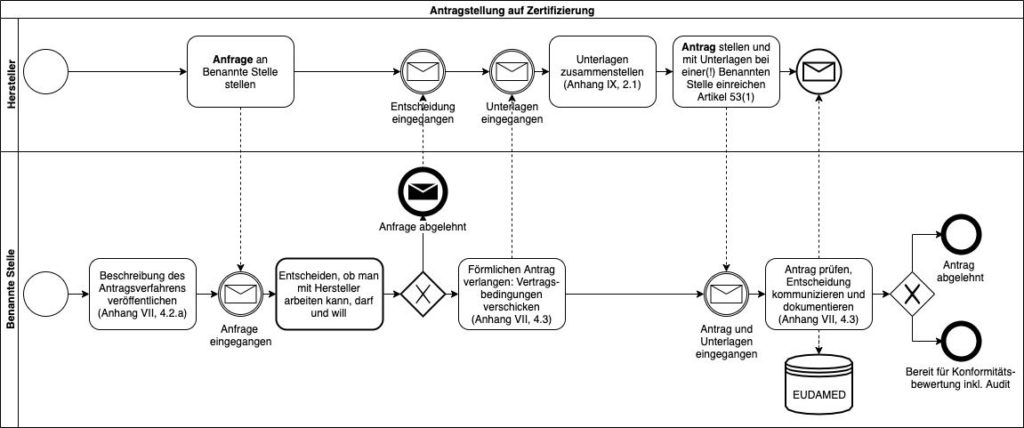
In dem Moment, in dem der Hersteller die Verträge bzw. das Angebot der Benannten Stelle unterschrieben zurücksendet (und es damit annimmt), liegt ein offizieller Antrag vor.
Der Hersteller darf gemäß MDR Artikel 53 nur bei einer(!) Benannten Stelle einen Antrag einreichen.
Wenn dem Antrag nicht alle notwendigen Informationen beiliegen, muss die Benannte Stelle den Antrag ablehnen. Sie ist verpflichtet, in der EUDAMED (und damit für andere Benannte Stellen zugänglich) zu dokumentieren, dass sie den Antrag abgelehnt oder der Hersteller den Antrag zurückgezogen hat.
Beachten Sie: Sowohl die Ablehnung eines Antrags als auch das Zurückziehen des Antrags müssen in der EUDAMED erfasst werden. Ein Eintrag in der EUDAMED könnte andere Benannte Stellen veranlassen, die Annahme eines neuen Antrags desselben Herstellers zu verweigern: Es ist zu vermuten, dass die EU-Kommission diese Fälle besonders genau untersuchen wird. Hersteller sollten also sicherstellen, dass die geforderten Unterlagen vollständig beiliegen.
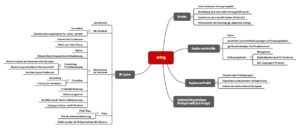
2. Unterlagen, die dem Antrag auf Zertifizierung beiliegen müssen
Übersicht
Welche Unterlagen die Hersteller in Verbindung mit einem Antrag auf Zertifizierung bei der Benannten Stelle einreichen müssen, geben die Anhänge der MDR vor (z.B. Anhang IX Absatz 2.1) sowie die Benannten Stellen selbst. Der Artikel 53(4) berechtigt sie, „die Vorlage aller Informationen oder Daten zu verlangen, die zur ordnungsgemäßen Durchführung des gewählten Konformitätsbewertungsverfahrens erforderlich sind.“
Die einzureichenden Unterlagen sind sehr umfangreich:
- Formales: Antrag, Bestätigungen
- Angaben zum Hersteller
- Angaben zu den Produkten
- Auf Anfrage: die technischen Dokumentationen oder Auszüge daraus
- Qualitätsmanagementsystem, insbesondere die Verfahrensanweisungen
Unterlagen, die nicht zwingend beiliegen müssen
Angesichts des großen Umfangs an einzureichenden Informationen stellt sich die Frage, welche Dokumente nicht einzureichen sind.
Dem Antrag müssen üblicherweise nicht beiliegen:
- Aufzeichnungen aus dem QM-System, z.B. von erfolgten internen Audits oder Managementbewertungen
- Technische Dokumentation: Zu diesen Unterlagen müssen die Hersteller nur Zugang gewähren. Es ist trotzdem empfehlenswert, viele Informationen zu den Produkten beizulegen, damit die Benannte Stelle die Klassifizierung des Produkts überprüfen kann.
- Unterlagen, die noch nicht vorliegen dürfen, weil die Konformitätsbewertung noch nicht abgeschlossen ist und daher das Produkt nicht in Verkehr gebracht werden darf
3. Prüfung des Antrags auf Zertifizierung
Die Benannte Stelle prüft den Antrag daraufhin, ob
- der Antrag schriftlich und förmlich vorliegt,
- der Vertrag mit dem Hersteller schriftlich und förmlich vorliegt,
- alle von der MDR z.B. gemäß Anhang IX Absatz 2.1 geforderten Dokumente beiliegen,
- die Produkte überhaupt Medizinprodukte sind,
- die Medizinprodukte richtig klassifiziert wurden,
- der Hersteller das richtige Konformitätsbewertungsverfahren gewählt hat,
- sie selbst befugt ist, für diese Produkte und dieses Konformitätsbewertungsverfahren die Konformität zu bewerten, und
- ob sie selbst über ausreichende und ausreichend qualifizierte Ressourcen verfügt.
Diese Vorgaben sind beispielsweise in Anhang VII („Von der Benannten Stelle zu erfüllende Anforderungen“) zu finden, siehe Kapitel 4 („Verfahrensanforderungen“) und Unterkapitel 4.3. („Überprüfung des Antrags und Vertragsbedingungen“).
Die Prüfung des Antrags ist nicht zu verwechseln mit der Konformitätsbewertung. Allerdings ist ein erfolgreich geprüfter Antrag eine unverzichtbare Voraussetzung für die Konformitätsbewertung und das damit verbundene Audit und Zertifikat.
Fazit
Hersteller sollten Anfrage und Antrag nicht verwechseln. Ab dem Moment, in dem der förmliche Antrag gestellt ist, wird „scharf geschossen“. Weil die Benannten Stellen ihre Entscheidung in der EUDAMED hinterlegen und damit anderen Benannten Stellen offenbaren müssen, sollten Hersteller ihre Anträge vor Abgabe sehr sorgfältig prüfen.
Die ZLG wird bei der Prüfung der Benannten Stelle die Antragsprüfung besonders unter die Lupe nehmen. Dennoch bleibt zu hoffen, dass die Benannten Stellen mit Augenmaß vorgehen und ein fehlendes oder suboptimales Dokument nachfordern und nicht gleich den Antrag ablehnen.
Ideal wäre es, wenn die Benannten Stellen den Herstellern die Checklisten zur Verfügung stellten, mit denen sie die Anträge auf Zertifizierung bzw. auf Konformitätsbewertung überprüfen. Das würde es den Herstellern erleichtern, die erste Hürde erfolgreich zu nehmen.



