Die European Medical Device Nomenclature (EMDN) ist neben Universal Medical Device Nomenclature System (UMDNS) eines von mehreren Systemen, um Medizinprodukte zu kodieren. Genau wie MDA/MDN-Codes (s. EU-Durchführungsverordnung (EU) 2017/2185) werden diese Systeme bei regulatorischen Prozessen benötigt, z. B. bei Registrierung und Vigilanz.
Dieser Artikel stellt die Kodiersysteme und deren gesetzlich vorgeschriebene Anwendung vor.
1. Anwendungsbereiche der EMDN-, GMDN-, UMDNS-, CND- und MDA-Codes
a) Registrierung der Produkte beim BfArM (DMIDS)
Bisherige und noch gültige Pflichten
Das Medizinproduktegesetz verlangte in § 25, dass man als „Verantwortlicher [, … der] Medizinprodukte […] erstmalig in den Verkehr bringt, dies vor Aufnahme der Tätigkeit unter Angabe seiner Anschrift der zuständigen Behörde anzuzeigen hat“. Das Nähere würde die entsprechende Verordnung regeln. Dies war die DIMDI-Verordnung.
Die DIMDI-Verordnung wiederum schrieb in § 2: „Für die Bezeichnung von Medizinprodukten ist eine vom Deutschen Institut für Medizinische Dokumentation und Information mittels des zentralen Erfassungssystems vorgegebene Nomenklatur zu verwenden.“ Dies sind zurzeit die UMDNS-Codes.
Allerdings, so schrieb das DIMDI auf seiner Webseite, sollen die „UMDNS und EDMS zukünftig durch die Global Medical Device Nomenclature (GMDN) ersetzt werden. Die EU-Kommission beabsichtigt, die GMDN in die Sprachen der Mitgliedsstaaten zu übersetzen, um eine einheitliche Bezeichnung von Medizinprodukten sicherzustellen“.
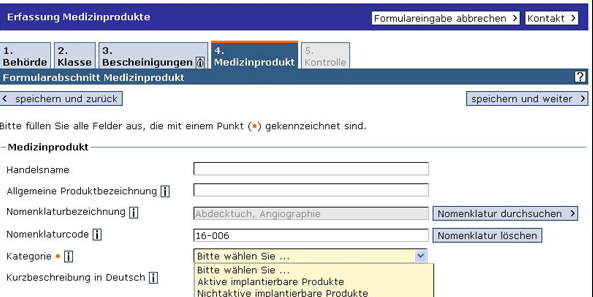
Solange die EUDAMED nicht ausreichend funktionsfähig ist, besteht die Pflicht, die Inverkehrbringung über das DMIDS (Deutsches Medizinprodukte-Informations- und Datenbanksystem) anzuzeigen.
b) Meldung von Zwischenfällen beim BfArM
Früher laut MPG und MPSV, heute laut MPAIMV sind Hersteller verpflichtet, Zwischenfälle und Vorkommnisse beim BfArM zu melden.
Wer Produkte beruflich oder gewerblich betreibt oder anwendet, hat dabei aufgetretene mutmaßliche schwerwiegende Vorkommnisse unverzüglich der zuständigen Bundesoberbehörde zu melden. Satz 1 gilt entsprechend für Ärzte und Zahnärzte, denen in Ausübung ihrer beruflichen Tätigkeit mutmaßliche schwerwiegende Vorkommnisse bekannt werden.
MPAIMV § 3
Diese Bundesoberbehörde verlangt, dass die Meldungen in ihrem Online-System erfasst werden:
(1) Die Meldungen nach § 3 erfolgen zur zentralen Erfassung über das Deutsche Medizinprodukteinformations- und Datenbanksystem nach § 86 des Medizinprodukterecht-Durchführungsgesetzes. Die Meldungen nach § 4 Satz 2 können zur zentralen Erfassung über das Deutsche Medizinprodukteinformations- und Datenbanksystem nach § 86 des Medizinprodukterecht-Durchführungsgesetzes erfolgen.
MPAIMV § 6
Dabei wird ein Code gemäß einer Nomenklatur erwartet:
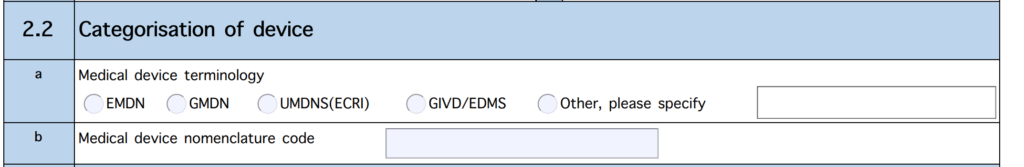
Als Nomenklaturen dürfen die Hersteller zwischen EMDN, GMDN und UMDNS sowie EDMS (bei IVD) wählen.
c) Meldungen und Registrierung in der EUDAMED
Auch die MDR verlangt den Einsatz von Nomenklaturen in der EUDAMED. Diese müssen sogar kostenlos zur Verfügung gestellt werden, wie Artikel 26 besagt:
„Um das Funktionieren der in Artikel 33 genannten Europäischen Datenbank für Medizinprodukte (Eudamed) zu erleichtern, stellt die Kommission sicher, dass Herstellern und anderen natürlichen oder juristischen Personen, die gemäß dieser Verordnung eine international anerkannte Nomenklatur für Medizinprodukte verwenden müssen, diese Nomenklatur kostenfrei zur Verfügung steht.“
Diesen Code müssen die Hersteller bei der Registrierung der Produkte zusammen mit der UDI-DI und anderen Angaben zum Produkt wie Risikoklasse und Handelsnamen eingeben.
Die EU hat entschieden, als Basis für die „European Medical Device Nomenklature“ (EMDN) die italienischen CND-Codes zu verwenden. Das sind dann die Codes, die bei der Registrierung von Produkten in der Eudamed zu verwenden sind.
Lesen Sie hier mehr zum Thema Unique Device Identification (UDI) und EU-Medizinprodukte-Verordnung MDR.
d) Auditierung: Anzahl der zu prüfenden technischen Dokumentationen
Die MDR nutzt die Begriffe „generic device group“ und „category of devices“. Dies impliziert eine Hierarchie von Gerätetypen, die auch die GMDN aufgreift. Konkret legt die MDR fest, wie viele technische Dokumentationen beim Audit zu prüfen sind:
- Manufacturers of class IIb devices […] shall be subject to a conformity assessment […] including an assessment of the technical documentation […] of at least one representative device per generic device group.
- Manufacturers of class IIa devices […] shall be subject to a conformity assessment […] including an assessment of the technical documentation […] of at least one representative device for each category of devices.
Dies setzt voraus, dass Medizinprodukte tatsächlich eindeutig in „Generic Device Groups“ und „Categories of Devices“ eingeteilt werden können. Die MDR definiert nicht einmal die Begriffe. Dazu weiter unten mehr.
e) Weitere Anwendungsbereiche
Der Artikel zu den generischen Produktgruppen und Produktkategorien nennt weitere Anwendungsbereiche wie die Periodic Safety Update Reports (PSUR), die die Hersteller gemäß Artikel 86(1) „nur“ pro Produktgruppe bzw. Produktkategorie erstellen müssen.
2. Die EMDN-Codes
Für die Registrierung von Produkten in der EUDAMED hat sich die European Nomenclature on Medical Devices (EMDN) durchgesetzt. Diese basiert auf dem italienischen System der CND-Codes. CND steht für Classificazione Nazionale dei Dispositivi medici, zu deutsch Nationale Klassifizierung von Medizinprodukten. Das hat das Guidance-Dokument der Medical Device Coordination Group MDCG 2019-13 so bestimmt.
a) Die Historie und die italienische Version
Die Europäische Kommission hat einen Leitfaden herausgegeben, der Hintergrundinformationen über die italienische Nomenklatur CND gibt. Die Nomenklatur ist auch auf der Webseite des italienischen Gesundheitsministeriums öffentlich zugänglich. Sie teilt Medizinprodukte in bis zu sieben Ebenen ein.

Weil die Seite und damit auch die Begriffe nur auf italienisch bereitstehen, ist ein Übersetzungsprogramm hilfreich. Allerdings stellt das Ministerium die Übersetzung der CDN-Codes als PDF und als Excel-Datei zur Verfügung.
Mit 355 Seiten ist dieses Dokument sehr umfangreich. Wie vollständig und granular diese Ontologie Medizinprodukte klassifiziert, wird sich erweisen. Das Dokument kennt zumindest über 150 Produkte, in denen der Begriff „Software“ enthalten ist.
Die Taxonomie kennt fast 7.000 Kategorien, davon
- 22 Codes auf der ersten Ebene,
- 146 Codes auf der zweiten Ebene,
- 724 Codes auf der dritten Ebene,
- 1.681 Codes auf der vierten Ebene.
b) Die aktuelle Liste der EMDN-Codes
Die EU hat im vierten Quartal 2021 eine neue Version der EMDN Codes veröffentlicht. Neben redaktionellen Änderungen gibt es neue Codes unter den Ziffern J, W und Z. Das betrifft die aktiven Implantate, die IVD sowie Zubehör einschließlich Software.
Die Webseite enthält nicht nur einen Link zum Download dieser Taxonomie, sondern auch eine navigierbare Baumstruktur, die diese Taxonomie übersichtlich darstellt und die Suche nach Schlagworten erlaubt.

Die Codes der vierten Ebene hat die MDCG als die generischen Produktgruppen definiert.
Lesen Sie hier mehr zum Thema generische Produktgruppen und Produktkategorien.
Die fünfte und sechste Ebene dieser Taxonomie bilden aber nicht die Ebene, auf der die Basis-UDI-DI vergeben würde. Eine gemeinsame Basis-UDI-Di darf nur Produkte umfassen mit identischen „essential design and manufacturing characteristics“. Diese sind aber keine Klassifizierungsmerkmale bei der EMDN, weder auf der fünften noch auf der sechsten Ebene.
c) Weiterentwicklung der EMDN-Code
Die MDCG beschreibt in der Leitlinie (MDCG 2024-2) den Prozess, mit dem die EMDN-Codes aktualisiert werden sollen. Das soll künftig jährlich erfolgen. Sie erklärt aber nicht, nach welcher Logik die beteiligten Expertengruppen entscheiden werden, in welchen Fällen diese Codes wie angepasst werden.
3. Die UMDNS-Codes
a) Aufbau des UMDNS-Code-Systems
Die UMDNS-Codes können von der Seite des BfArM direkt heruntergeladen werden. Sie unterscheidet mehr als 5.000 Begriffe, die allerdings nicht hierarchisch gegliedert sind. Die Codes folgen keiner erkennbaren Systematik.
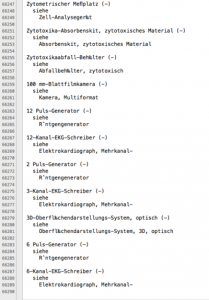
Die Datei enthält viele Querverweise auf Synonyme und verwandte oder spezifischere Begriffe. Details erfahren Sie im Video.
b) Beispiele mit Bezug zur Software
Die UMDNS kennt den Begriff „Software“ nicht, allerdings vergibt sie Codes für „Informationssysteme“ (Code 17-222) oder „Informationssystem, Kardiologie“ (Code 18-118).
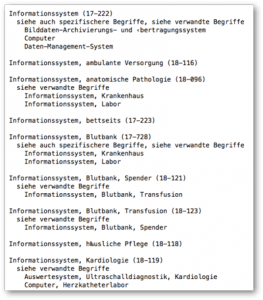
c) Fazit und Kritik an UMDNS
Das UMDN-System ist völlig veraltet. Es steht immerhin kostenfrei zur Verfügung. Die mangelnde Hierarchie (UMDNS ist keine Klassifikation, aber eine Taxonomie) erschwert das Suchen und systematische Auswerten. Dass das DIMDI mit UMDNS-Codes arbeitet und das BfArM die GMDN-Codes bevorzugt, sagt sowohl etwas über die Kodierungssysteme aus als auch über die Abstimmung zwischen den Behörden.
4. Die GMDN-Codes
a) Kosten
Im Gegensatz zum UMDNS standen die GMDN-Codes nicht kostenfrei zur Verfügung. Die GMDN Agency verlangte je nach Jahresumsatz eine jährliche Gebühr von bis zu 4.000 Euro. Jetzt stehen die Codes allen Zielgruppen kostenfrei zur Verfügung.
International sind die GMDN-Codes sehr etabliert. Deshalb bildet die Europäische Kommission die CND-Nomenklatur auf die Codes der Global Medical Device Nomenclature (GMDN) ab, um die Anforderungen der Medizinprodukterichtlinie (MDR) und der Richtlinie über In-vitro-Medizinprodukte (IVDR) zu erfüllen.
Danke an B. Reszel, J. Schmidt und Dr. K. Martins!“The GMDN Agency welcomes the recent announcement from the European Commission regarding its intention that the nomenclature used in the EU for naming and categorising medical devices will, in future, need to strongly align to the GMDN (https://ec.europa.eu/docsroom/documents/34264?locale=en).”
GMDN Agency
b) Aufbau 1: Überblick über das GMDN-Code-System
Das GMDN-System ist hierarchisch aufgebaut. Es stellt eine Taxonomie dar, wie hier am Beispiel von Computer/Software zu erkennen ist.

Genau genommen sind es sogar zwei Hierarchien: Eine nach Name und eine nach Anwendungsfall.
Jeder Begriff verfügt über folgende Attribute:
- Name
- Beschreibung
- Code
- Status (z. B. „Active“)
- Erstellungsdatum
- Datum der letzten Änderung
Einige der Begriffe sind übersetzt. Die Übersetzung betrifft den Namen und die Beschreibung. Die Übersetzungen haben auch ein Übersetzungsdatum.
c) Beispiele
Der Begriff „Clinical information system web-based application software“ ist wie folgt beschrieben:
“An application software program designed as an Internet-based information system to support the administrative, clinical, and quality control activities associated with the provision/utilization of healthcare within a specific clinical specialty (e.g., orthopaedics, general surgery, neurology, ophthalmology, oncology, rheumatology, dermatology). It can be available on any web-enabled interface (including mobile devices at point-of-care) and is intended for use by healthcare professionals in a clinical setting.”
d) Aufbau 2: Polyhierarchisches und polyaxiales System
Der Begriff befindet sich innerhalb der ersten Hierarchie (nach Namen):
- Computers and associated devices > Software Application program software > Web-based application software
Interessanterweise ist das keine monohierarchische und monoaxiale Hierarchie. Folglich gibt es weitere Hierarchiepfade:
- Computers and associated devices > Software Application program software > Information system software
- Information systems and associated devices > Information system software

Der Begriff “Information System Software” findet sich sowohl unter dem Hauptbegriff „Information systems and associated devices“ als auch unter dem Hauptbegriff „Computers and associated devices“.
Nicht ganz nachvollziehbar ist die Einteilung des Begriffs in die Hierarche “by use”:
- Orthopaedic devices > Implantable joint prostheses and associated devices
Der Aufbau der GMDN-Struktur besteht aus drei Ebenen:
- Device Category (z. B. “Computers and associated devices”)
- Generic Device Group (z. B. “Software Application program software”)
- Device Type (z. B. “Web-based application software”)
Diese drei Ebenen sind für die Auditierung bzw. das Review der technischen Dokumentation entscheidend, wie bereits oben angesprochen wurde.
e) Die Codes
Die Codes lassen keine Rückschlüsse auf die Hierarchie zu. Beispielsweise hat der Begriff „Information systems and associated devices“ den Code CT223 und der Unterbegriff „Information System Software“ den Code „CT1448“.
Die konkreten Ausprägungen – in unserem obigen Beispiel die „Web-based application software“ –, also die „Blätter“ in dieser Hierarchie, haben keinen eigenen Code.
5. Die MDA/MDN-Codes
a) Allgemeines
Die EU-Durchführungsverordnung (EU) 2017/2185 definiert die Produktkategorien. Das System der EU ist ebenfalls hierarchisch aufgebaut.

Die EU unterscheidet 71 Produktkategorien für Produkte, die unter die MDR fallen, und 79 Produktgruppen für IVD-Produkte.
Welche Bedeutung die Produktkategorien für die MDR bzw. IVDR haben, erläutert dieser Artikel.
b) Downloads
6. Das chinesische Code-System
Die chinesische Firma Zhixie stellt eine Suchmaske bereit, mit der nach den entsprechenden Codes gesucht werden kann. Dies ist insbesondere deshalb nützlich, weil so die Klasse der Produkte schnell bestimmt werden kann.
7. Fazit
Das GMDN-Kodiersystem war von der EU-Kommission bevorzugt und basierend auf der ISO 15225 in Auftrag gegeben. Die kommerziell agierende GMDN Agency verwaltet diese Begriffe aktiv. Sie sind besser gepflegt als die des UMDN-Systems. Große Chancen, als Standard für die EUDAMED genutzt zu werden, hat das öffentlich verfügbare italienische CND-System. Ein Mapping beider ist geplant.
Die Kodierungssysteme werden für folgende Zwecke benötigt:
- Produkte registrieren (derzeit bei DIMDI via UMDNS)
- Vorkommnisse melden (bevorzugt via GMDN)
- Produkte in EUDAMED Datenbank eintragen (künftig wahrscheinlich via GMDN)
- Entscheiden, wie viele technische Dokumentationen im Audit gemäß MDR geprüft werden müssen
Es bleibt zu hoffen, dass die Kodierungssysteme
- kostenlos zur Verfügung stehen,
- konsolidiert werden (also nur noch eines und nicht mehr drei oder mehrere parallel verwendet werden),
- eine komfortable Suche ermöglichen,
- stringent aufgebaut sind/bleiben und
- kontinuierlich weitergepflegt werden (inkl. kompetentem und raschem Support).
Wünschen Sie Unterstützung dabei, Ihr Produkt zu registrieren, einen Zwischenfall zu melden oder andere regulatorische Anforderungen zu erfüllen? Professor Johner und sein Team helfen gerne! Nehmen Sie Kontakt auf!
Änderungshistorie
- 2024-02-08: Kapitel zur EMDN neu geschrieben und wegen höherer Bedeutung noch oben geschoben. Regulatorische Verweise in Kapitel 2 aktualisiert.
- 2021-11-22: Abschnitt 4.b) eingefügt (Neue Version der EMDN-Codes, Verweis auf Webseite der EU)





Vielen Dank für den Beitrag, Herr Prof. Johner.
Als Alternative, falls man nur selten und wenige GMDN Code-Informationen benötigt, bietet das Unternehmen MDSS in Hannover
unter
http://www.mdss.com/DE/registrierung/GMDNCodes.htm
eine kostenpflichtige Recherche oder Information an,
die weitaus günstiger ist, als eine Mitgliedschaft bei der GMDN-Agency.
Da im Web frei auffindbare Codes oft veraltet sind, ist dies eine nützliche Variante.
Danke für den wertvollen Hinweis!!
Sehr geehrter Herr Prof. Dr. Johner,
Ich finde den Artikel über die UMDS und GMDN Numemrn sehr übersichtlich und verständlich geschrieben.
Im welchem Zusammenhang sehen Sie die GTIN Nummer, die ebenfalls für Medizinprodukte angeboten wird?
Mit freundlichen Grüßen
Martin Niggemann
Großartige Frage, lieber Herr Niggemann! Danke!
Die Global Trade Item Number (GTIN) dient der Identifizierung einzelner Produkte so wie etwa die ISBN bei Büchern. Bei den Medizinprodukten werden diese Nummernschema für die UDI notwendig sein. Die MDR sieht dafür vor:
„Until the Commission has designated, pursuant to Article 27(2), issuing entities, GS1, HIBCC and ICCBBA shall be considered to be designated issuing entities.“
Die GS1 ist die Institution, die die GTIN herausgibt.
Es gibt also einmal eine eindeutige Identifikation der Produkttypen bzw. Produkte (z.B. GTIN) und eine Klassifizierung der Produkte (UMDS, GMDNS). Beispielsweise hätte das Beatmungsgerät VentiPlus 3.2 eine GTIN. VentiPlus würde mit ähnlichen Produkten anderer Hersteller in die Klasse Beatmungsgeräte fallen, die über eine UMDS bzw. GMDNS bezeichnet ist.
Ist der GMDN verpflichtend, kann die Benannte Stelle diesen für ihre Anträge verlangen?
Nein, diese Nummer brauchen Sie eher für die Registrierung. Bei der benannten Stelle sind die NBOG-Codes entscheidender.
Guten Tag Herr Johner
was passiert mit all diesen Codes, sobald das EUDAMED UDI System operativ sein wird? Welche dieser Codes (NBOG, GMDN, UMDS, …) werden auch in Zukunft noch am Leben erhalten und erforderlich sein.
Und werden die bleibenden Code Systeme weiterhin von unabhängigen NPO bewirtschaftet und für die Nutzung i.d.R. eine kostenpflichtige Mitgliedschaft erfordern, oder werden sie/einige davon dann kostenfrei durch EU Gremien oder die EUDAMED zur Verfügung gestellt?
Sehr geehrter Herr Rohrbach,
die Antworten weiß derzeit noch niemand. Es gab gerade ein Treffen der NBOG, bei dem das Thema kostenfreies Klassifizierungssystem besprochen wurde. Sobald es Neues gibt, werde ich es in diesem Artikel ergänzen. Sie müssten dann vom System benachrichtig werden.
Viele Grüße, Christian Johner
Sehr geehrter Herr Professor Johner,
vielen Dank für Ihren hochspannenden Beitrag.
Die eindeutige Kennzeichnung per UDI und Speicherung in der Eudamed Datenbank ist verpflichtend. Wird somit automatisch die Angabe des GMDN-Codes auch für die Hersteller verpflichtend? Welche zukünftige Bedeutung hat aus Ihrer Sicht die Klassifizierung für Medizinprodukte nach eCl@ss, die im Vergleich zur GMDN-Klassifizierung häufig zu wenig ins Detail geht, um über diese Klassifizierung eine gute Vergleichbarkeit der Produkte zu erhalten. Hier geht GMDN deutlich tiefer.
Sehr geehrte Frau Winkels,
danke für Ihr Feedback und Ihre Frage!
Die UDI Expertengruppe hat gerade erst ein Papier veröffentlicht, dass die Anforderungen an eine Klassifikation für Medizinprodukte spezifiziert. D.h. wir wissen momentan nur, was diese Klassifikation leisten soll, aber nicht welche es sein wird.
Viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
Sie schreiben oben: „Der Aufbau der GMDN-Struktur besteht aus drei Ebenen […]“. Dies sei wichtig für die Auditierung der techn. Dokumentation.
Wenn ich für meine GMDN-Codes die Explorer Groups anschaue, weisen sie allerdings bis zu 5 Ebenen auf. Wie kann das sein?
Sehr geehrte(r) Kim Friedl,
besten Dank für Ihre Frage! Sie haben offensichtlich Recht: Sogar der Screenshot von mir zeigt fünf Ebenen. Interessanterweise gibt es zum gleichen Element auf fünfter Ebene („webbased calculators“) aber noch einen kürzen Weg, bei dem das Element auf der dritten Ebene liegt. Die Quelle, die ich nannte und vor der ich die Daten habe, scheint möglicherweise fehlerhaft zu sein. Weil es das Gesundheitsministerium Österreichs ist, hatte ich darauf vertraut. Ich muss dort nachfragen.
Es tut mir leid, dass ich ausnahmsweise keine abschließende Antwort geben kann.
Viele Grüße, Christian Johner
Sehr geehrte Prof. Johner, vielen Dank für diesen interessanten Artikel zum Thema GMDM. Wir befinden uns gerade in der Implementierungshase zu UDI und Ihre Hinweise hierzu haben Licht ins Dunkel gebracht.
Viele Grüße, Christoph Braun
Danke, Herr Braun! Ich freue mich über Ihre Rückmeldung!
Wir haben nur ein Medizinprodukt mit Klasse 1 registriert. Benötigen auch Klasse 1 Produkte einen GMDM code? Bisher sind wir sozusagen noch ohne diesen Code klargekommen.
Habe ich das richtig verstanden, dass es sozusagen eine „Selbsteingruppierung“ ist?
Sehr geehrte Frau Schunk,
es gibt keine Pflicht, den GMDN Code zu verwenden. Sie können auch den UMDNS-Code nutzen.
Die Gruppierung machen in der Tat Sie. Die Behörde kann aber Einspruch erheben.
Viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
erst letzte Woche habe ich auf einem Forum gelernt, dass die italienische Nomenklatur „CMD“ für EUDAMED ausgewählt wurde. Es solle eine Referenztabelle zwischen CMD und GMDN geben.
Wurde diese Entscheidung revidiert?
Beste Grüße,
Nadine Langguth
Sehr geehrte Frau Langguth,
hier scheint es leider widersprüchliche Meldungen zu geben. Ich weiß es auch nicht und melde es, sobald ich mehr weiß.
Beste Grüße, Christian Johner
Hallo,
Meines Wissens ist GMDN nicht kostenfrei. Die GMDN Agency hat dazu nichts verlautbart.
CND wurde zur offiziellen MDR Nomenklatur erklärt. Anbei der Link zur Meldung: https://ec.europa.eu/docsroom/documents/34264?locale=en
Lt. Unterlagen kann GMDN in Zukunft weiterhin verwendet werden, da die jeweiligen GMDN Codes mit den Codes der CND gemappt werden.
„the CND nomenclature, to be mapped to the GMDN nomenclature, will be made available in the future Eudamed.“
Viele liebe Grüße,
Poppy
Danke für den Hinweis! Dann scheinen die Meldungen der Österreichischen Regierung nicht korrekt gewesen zu sein. Schade…
Da war ich wohl etwas voreilig!
Am 1. April wurde doch noch ein neues Gebührenmodell veröffentlicht.
https://www.gmdnagency.org/Services/Prices
Liebe Grüße, Poppy Abeto Kiesse
Sehr geehrter Herr Prof. Dr. Johner,
Ich habe eine Verständinsfrage.
Ich fand heute den passenden GMDN code aus der GMDN Database für mein Produkt unter der Nutzung der Lizenz „Basic“, sprich kostenfrei.
„Kostenfrei“ bedeutet, dass ich keine Gebühren der GMDN Agency zahlen muss für die Verwendung des Codes für regulatorischen Zwecke (incl. der Eintragung-Nutzung des Codes in die EUDAMED). Ist das korrekt?
Viele Grüsse
Christos Freris
Sehr geehrter Herr Prof. Johner
Das italienische Gesundheitsministerium stellt zwar eine EN Übersetzung der CND Codes zur Verfügung, diese sind jedoch m.E. nicht immer sehr präzise.
Was raten Sie bei Abweichungen? Soll man sich auf das Original (ITA) stützen?
Besten Dank und freundliche Grüsse
A.Trepp
Sehr geehrte Frau Trepp,
das ist eine sehr gute Frage.
Ich würde das abhängig von der benannten Stelle machen. Ich vermute, dass keine deutsche Benannte Stelle die Codes auf Diskrepanzen prüft. Dann wären die englischen Code die relevanteren.
Bei solchen Findings würde ich auch das BfArM behelligen. Das sollte deren Job sein, die richtigen Ansprechpartner zu finden.
Viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
verstehe ich es richtig, dass die italienische Nomenklatur CND priorisiert verwendet werden soll bei der Registrierung der Medizinprodukte in der EUDAMED? Die GMDN-Codes könnten dann alternativ verwendet werden?
Bei den GMDN-Codes stellt sich für mich die Problematik dar, dass ich für wenige Produkte gar keine passende Beschreibung finde. Eine Anfrage in einer Basis-Mitgliedschaft dauert leider sehr lange. In der CND-Nomenklatur hingegen kann die Kategorie „Others“ gewählt werden, was die Zuordnung etwas einfacher macht.
Ich bedanke mich im Voraus für Ihre Antwort.
Mit freundlichen Grüßen
Christine Graß
Sehr geehrte Frau Graß,
es ist in der Tat so, dass die CND, die jetzt unter der Bezeichnung European Medical Device Nomenclature (EMDN) genutzt werden, als die bevorzugte Nomenklatur verwendet werden soll.
Das sagt u.a. die EU auf ihrer Webseite.
Viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
vielen Dank für Ihre schnelle Antwort.
Viele Grüße
Christine Graß
Guten Tag.
Ich habe eine Anfrage erhalten:
Ein Klasse I MP Hersteller möchte sein Produkt registrieren, erhält aber bei Angabe einer für ihn passenden GMDN eine für ihn unpassende EMDN. Auch alle weiteren EMDN Codes treffen auf sein Produkt nicht zu. Ich habe nun gelesen hier es sei ein UMDNS Code vergebbar alternativ? Was für Möglichkeiten hat der Hersteller noch sein Produkt einzugruppieren?
Muss man den Vorschlag der EUDAMED übernehmen? Ich denke nicht, da das Tool von der EU Kommission selbst als noch nicht ausgereift dargestellt wird.
Beeinflusst der EMDN andere Kodierungen von MP? UDI-DI? Meiner Meinung ist das wie Äpfel und Birnen und hat nichts miteinander zu tun.
Über Ihre Rückmeldung würde ich mich sehr freuen.
Sehr geehrte Frau Würtenbeger,
danke für Ihre Nachricht und Frage!
Ich bin noch nicht ganz sicher, ob ich Ihre Frage verstehe und von wo Sie eine unpassende EMDN für eine GMDN bekommen. Beide Kodierssysteme sind unabhängig, auch wenn es teilweise Mapping gibt.
Der EMDN Code ist wichtig, damit Ihre Benannte Stelle entscheiden kann, wie viele Produkte sie abhängig von der Klasse dieser Produkte beim Sampling berücksichtigen muss. Die UDI-DI ist davon unabhängig.
Viele Grüße, Christian Johner
Guten Tag.
Vielen Dank zunächst für Ihre Rückmeldung.
Ich habe rückwirkend gemerkt, dass der Zusammenhang auch nicht erschließbar war.
Anbei noch einmal der genaue Zusammenhang. Eine der 3 Fragen haben Sie nun bereits hinlänglich beantwortet.
Vielen Dank Ihnen schon einmal dafür.
Hier der Zusammenhang und die 2 noch offenen Fragen:
Das Unternehmen möchte für Ihre Klasse I-Produkte, für die es bereits einen GMDN-Code gibt, den passenden EMDN-Code bestimmen.
Gibt der Kunde bei EUDAMED „Playground“ den GMDN-Code für diese Klasse I-Produkte an, wird vom System ein EMDN-Code abgeleitet.
Doch weder die Angabe von EUDAMED auf Basis des GMDN-Codes noch alle weiteren EMDN-Codes der Europäischen Kommission treffen zu 100 Prozent auf seine Klasse I-Produkte zu.
Daher:
1) Hat die Angabe von EUDAMED auf Basis des GMDN-Codes bindenden Charakter oder ist es eher ein Vorschlag?
2) Ist es möglich, wie bei den GMDN-Codes, selbst einen passenden EMDN-Code zu beantragen? Die Nummerierung der EMDN-Codes lässt dies vermuten.
Sehr geehrte Frau Würtenberger,
ich freue mich, dass ich zumindest eine Frage beantworten konnte. Dann versuche ich mich mal an den beiden verbliebenen:
Viele Grüße, Christian Johner
Guten Abend.
Vielen, herzlichen Dank für Ihre Rückmeldungen. Damit sind meine Fragen vollumfänglich beantwortet.
Ich habe das Wording der Firma übernommen, muss ich gestehen. Der Begriff Tool passt wohl besser.
Ich wollte in dem Rahmen auch noch einmal Ihren Podcast loben, den ich sehr gerne verfolge und jedem weiterempfehlen möchte.
Mit freundlichen Grüßen,
Mira Würtenberger.
Kann man einem Medizinprodukt auch mehrere GMDN Codes zuweisen?
Sehr geehrte Frau Paulsen,
danke für die spannende Frage!
Derzeit werden die Produkte noch national, d.h. beim BfArM registriert. In diesem System können Sie nur einen Code angeben. Man sieht das in der „Gebrauchsanweisung“ für das System auf Seite 5. Dort gibt es einen „Radio-Button“, keine „Checkbox“. Auch spricht diese im Singular vom Code.
Ich habe keine aktuellen Schema-Dateien der Eudamed, vermute aber, dass es auch hier eine Kardinalität von 1 sein wird, sprich nur ein Code.
Beste Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
ich habe eine Nachfrage zum Thema Basis-UDI-DI und EMDN Codes. Sie schreiben in Ihrem Artikel, dass die 5. und 6. Ebene der EMDN Taxonomie nicht unbedingt für die Vergabe der Basis-UDI-DI genutzt werden kann, da durch Unterschiede in essentiellen Design und Fertigungs-Charakteristika durchaus mehrere Basis-UDI-DI trotz des gleichen EMDN Codes notwendig sein können. Dies ist für mich absolut verständlich. Ich kann nur keine Informationen dazu finden, ob es möglich ist, für Produkte die die gleiche Basis-UDI-DI haben sollen auch unterschiedliche EMDN-Codes zu vergeben.
Als Beispiel wären hier unsere Kieferhöhlenküretten und Stirnhöhlen-Löffel zu nennen. Wir haben diese Produkte innerhalb einer Basis-UDI-DI (Gleiche Zweckbestimmung, Risikoklasse, Fertigung, Design unterscheidet sich minimal im Arbeitsteil) müssten aber die EMDN Codes ENT Curettes und ENT Spoons (Ebene 4) nutzen. Ist das möglich? Oder sind dann automatisch 2 Basis-UDI-DI notwendig?
Ich bedanke mich im Voraus für Ihre Antwort.
Mit freundlichen Grüßen,
Sanaz Spitzley
Bei den EMDN/CDN codes ist oben noch ein veraltetes PDF verlinkt, indem z.B. die Kategorie Y03 noch existiert, aber Y05 noch nicht. Bitte updaten – der richtige Link führt vermutlich hierauf? https://webgate.ec.europa.eu/dyna2/emdn/
Vielen dank für diesen wertvollen Hinweis!
Wir haben die Links entsprechend geändert.
Herzliche Grüße
Anja Segschneider | Redaktion
Sehr geehrtes Johner-Team,
In der EU-Publikation „Fragen & Antworten – EMDN“ wird unter Punkt 6 beschrieben, „Die Nutzer müssen ihrem Produkt in der baumartigen Hierarchie der EMDN stets den detailliertesten und terminalsten Begriff (niedrigste Ebene im Baum) zuordnen.“
Wir haben Produkte rund um die Biopsy, darunter
– Biopsienadeln (Einmalprodukte in verschiedenen Dimensionen), dafür gibt es den EMDN-Code A0102010101 „shearing biopsy needles“
– Biopsiepistolen (wiederverwendbar), dafür gibt es den EMDN-Code A0102010102 „shearing biopsy guns“
– Biopsiegeräte (Einmalprodukte, Biopsienadeln fest verbunden mit Ihrer Biopsiepistole), hier würde der EMDN-CODE A01020101 „shearing biopsy kits“ perfekt passen. Er ist den beiden oben stehenden Codes übergeordnet. Damit ist er nicht die niedrigste existierende Ebene im Baum, aber die niedrigste passende Ebene.
Frage: Können wir diesen passenden Begriff und Code unseren Biopsiegeräten zuordnen, oder ist das nicht gestattet? Wenn nicht, müssten wir auch hier die „shearing biopsy needles“ wählen.
Wir hoffen, Sie können uns hier helfen.
Danke im Voraus und freundliche Grüße,
Maike Asendorf
Liebe Frau Asendorf,
Frau Schulze hat mir die folgende Antwort gegeben:
ich würde Ihnen hier Recht geben und die – Biopsiegeräte (Einmalprodukte, Biopsienadeln fest verbunden mit Ihrer Biopsiepistole) dem EMDN-CODE A01020101 „shearing biopsy kits“ zuordnen, weil dieser Code am besten passt.
Mit besten Grüßen
Astrid Schulze
Herzlichen Dank Frau Schulze und Frau Segschneider,
für die Auskunft! Dann ordnen wir diesen passenderen Code zu.
Freundliche Grüße,
Maike Asendorf
Zu dem Hinweis von „Jon Doe“ vom 28. Okt. 2021 habe ich noch eine Frage. Wie korrekt angegeben ist die Kategorie Y03 nicht mehr in der von der Kommission veröffentlichten Liste der EMDN Codes enthalten. Das ist für uns nun eine recht spannende Erkenntnis, denn das MDR Zertifikat das wir von unserer Benannten Stelle erhalten haben enthält unter anderem den Code Y030399, da wir Produkte haben, die in andere Codes nicht wirklich reinpassen.
Wissen Sie, ob die Kommission die EMDN Codes noch erweitern wird, damit alle Produkte die in der CDN abgebildet werden können (und auch real existieren) auch in der EMDN abgebildet werden können?
Guten Abend,
wir haben inzwischen (siehe vorangehende Korrespondenz in diesem Chat) den SANTE-EUDAMED-SUPPORT@ec.europa.eu kontaktiert und dort erfahren, dass wir den übergeordneten, passenden EMDN-Code nicht benutzen dürfen. Wir haben um die Erstellung eines passenden Codes gebeten, nach mehrfacher Darlegung der Sachlage und einigen Erinnerungsmails wurde uns bestätigt, dass daran gearbeitet wird und diese Mailadresse die richtige dafür sei. Ein Zieldatum für die Erledigung konnten die Mitarbeiter uns leider nicht nennen.
Vielleicht hilft diese Erfahrung hier weiter,
freundliche Grüße,
Maike Asendorf
Liebe Frau Asendorf, vielen Dank für diesen interessanten und hilfreichen Hinweis!
Mit besten Grüßen
Astrid Schulze
Seniorberaterin QM & RA
Guten Tag,
Können Sie mir sagen ob man Ihrer Meinung nach für ein System nach Artikel 20 regulatorische Codes (GMDN, UMDNS, MDA/N, EMDN) vergeben muss?
Vielen Dank.
Alexandra Smith
Sehr geehrte Frau Smith,
besten Dank für Ihre Frage. Ich helfe sehr gerne, bin aber unsicher, ob ich Ihre Frage verstanden habe.
Beim Artikel 20 geht es um die CE-Kennzeichnung. Ist Ihre Frage, ob man im Rahmen der CE-Kennzeichnung einen Code vergeben muss? Oder wollen Sie wissen, ob für Systeme und Behandlungseinheiten (Artikel 22) einen Code vergeben muss?
Wahrscheinlich stehe ich gerade auf dem Schlauch. Aber mit Ihrer Hilfe bekommen wir das schnell geklärt.
Viele Grüße, Christian Johner
Hallo Herr Johner,
da habe ich mich wohl im Artikel vertan, ich meinte tatsächlich Artikel 22, System. Benötigt dieses regulatorische Codes?
Und wo wir beim Thema System sind, vielleicht dürfte ich noch fragen: Artikel 22, Abschnitt 4 besagt ja dass wenn ich ein Produkt ohne CE-Kennzeichnung ins System mit einbeziehe (also z.B. ein Medizinprodukt welches zwar in einem anderen Land zugelassen ist jedoch keinem Konformitätsbewertungverfahren in der EU unterworfen war), dann muss man das gesamte System einem Konformitätsbewertungverfahren unterwerfen. Bedeutet das dann automatisch dass man eine „Gesamt“-Akte für das System erstellen muss? Im Gegenzug: wenn ich ein System zusammenstelle welches unter Artikel 22 fällt und alle Bedingungen erfüllt sind, dann benötige ich ja nicht unbedingt eine Akte sondern jedes Produkt darf ja eine eigene Akte haben, sehe ich das richtig? Besten Dank! Alexandra Smith
Sehr geehrte Frau Smith,
meine Kollegin hat mir zu Ihren Fragen folgende Antworten gegeben:
Das System benötigt nach Artikel 29 MDR eine eigene Basis-UDI-DI. Da in einem System ja ganz unterschiedliche Produkte vereint sein können, kann man keinen der von Ihnen genannten regulatorischen Codes (GMDN, UMDNS, MDA/N, EMDN) für das Gesamtsystem zuordnen. Diese Codes lassen sich nur auf die einzelnen Produkte des Systems anwenden, soweit es sich um Medizinprodukte handelt.
Es kann aber muss keine Gesamtakte erstellt werden. Im § 22(4) ist geregelt, dass Produkte eines Systems ohne CE-Kennzeichnung als eigenständiges Produkt behandelt und dem einschlägigen Konformitätsbewertungsverfahren gemäß Artikel 52 unterzogen werden müssen. Sie können für jedes Produkt eine eigene Akte erstellen. Das Medizinprodukt in Ihrem System muss darstellen, welche Produkte zum System gehören und den Nachweis durch Verifizierung und Validierung erbringen, dass die Produkte des Systems fehlerfrei und entsprechend der Zweckbestimmung zusammenwirken.
Herzliche Grüße
Laura Steinhauser | Redaktion
Guten Tag,
Meine Frage betrifft die Zuteilung von EMDN-Codes für Zubehör von Medizinprodukten. Bekommt Zubehör Ihrer Meinung nach eine eigene EMDN oder wird es der EMDN untergeordnet, die das Medizinprodukt trägt dem das Zubehör in erster Linie zugeordnet ist?
Ich habe diese Information einem Artikel von Obelis Group entnommen, konnte sie aber bisher nicht durch andere Quellen bestätigen.
„Every accessory will have the classification code of the medical device that it is associated with. If an accessory can be used with multiple medical devices belonging to several groups, it must be placed in the prevalent type.“
https://www.obelis.net/news/the-european-medical-device-nomenclature-emdn-background-and-generalities/
Freundliche Grüße
Karin Wiesinger
Liebe Frau Wiesinger, die Quelle für diesen Satz findet sich im Dokument „The CND Nomenclature ‘Classificazione Nazionale Dispositivi medici’“ auf Seite 7 unten.
Mit besten Grüßen
Astrid Schulze
Guten Tag,
meine Frage bezieht sich auf die EMDN Nomenklatur im Zusammenhang mit neurovaskulären Stents. Diese Nomenklatur wird im Falle der Produktregistrierung in EUDAMED benötigt. Allerdings kann ich keine vollkommen zutreffende Kategorie für mein zu registrierendes Produkt finden. Daher möchte ich wissen, ob es eine Möglichkeit gibt, die EMDN Nomenklatur um weitere Kategorien zu ergänzen? Oder ist es möglich, für die Registrierung eine ähnliche Kategorie zu wählen, welche das Produkt aber nicht vollkommen zutreffend beschreibt?
Des Weiteren gäbe es noch die Möglicheit, die Kategorie „OTHER“ zu wählen, welche das Produkt allerdings überhaupt nicht beschreibt.
Ich würde mich sehr über eine Antwort freuen und bedanke mich im Voraus.
Viele Grüße
Liebe Frau Russel,
vielen Dank für Ihre Frage zu den EMDN Codes. Eine Ergänzung des EMDN Codes durch die Hersteller ist nicht vorgesehen. Ich würde den Code wählen, der für Ihr Produkt am besten passt. OTHER würde ich nur wählen, wenn die vorhandenen Codes gar nicht passen.
Mit besten Grüßen
Astrid Schulze
Sehr geehrte Frau Russel und Frau Schulze,
dieses Problem haben wir auch, bei uns stehen für eine Produktgruppe nur Codes zur Verfügung, die schlicht falsch sind. Wir haben das an das help desk kommuniziert: SANTE-EUDAMED-SUPPORT@ec.europa.eu . (Man muss hartnäckig bleiben, um durch die ersten Standardantworten durchzudringen). Uns wurde schließlich bestätigt, dass daran gearbeitet wird, immerhin.
Es ist geplant, die EMDN-Code-Liste ca. 1x jährlich upzudaten, und wir hoffen, dass dann ein verwendbarer Code für uns dabei ist – unter GMDN gibt es einen exakt zutreffenden (und einige, die in etwa zutreffen).
Siehe auch die Kommunikation in diesem Chat von Nov 2021 bis Feb 2022.
Freundliche Grüße,
Maike Asendorf
Liebe Frau Asendorf,
vielen herzlichen Dank für diese super hilfreichen Einblicke in die Praxis. Ich denke auch, dass es wichtig ist, auf die von Ihnen geschilderte Weise auf die Weiterentwicklung der Codes hinzuwirken. Nochmals vielen Dank!
Herzliche Grüße
Astrid Schulze
Sehr geehrte Frau Dr. Reinhold,
sehr geehrter Herr Prof. Johner,
vielen dank für den sehr informativen Überblick über die Anforderungen an Nomenklaturssysteme für das EU-Beobachtungs- und Meldesystem auf Basis EUDAMED, den ich leider erst jetzt gelesen haben.
Folgende AnmerKung bzgl. UMDNS: Natürlich ist das UMDNS und die von emtec besorgte Übersetzung von 1996 nicht nur veraltet sondern in Teilen auch fehlerhaft. Aber das DIMDI hatte unter Verweis auf die „Verordnungs-Gültigkeit“ alle Versuche der Fortschreibung und Aktualisierung verweigert. Der UMDNS 2024 ist ( nicht zuletzt durch die gemeinsamen Nomenklaturarbeit am GMDN zu Beginn des Jahrtausend) wesentlich konsistenter.
Ein Nachteil ist sicher, das der UMDNS ein nicht hierarchisches Nomenklatursystem bzw. kein Klassifikationssystem ist und keine Codierung auf Ebene der Modelle (Gerätetypen) kennt. Auch die ersten Versionen des GMDN waren ja ebenfalls nicht-hierarchisch.
emtec e.V hat ja seit 1985 ein eigenes Klassifikationssystem (IMT) für die Medizintechnik entwickelt das in zahlreichen deutschen, österreichischen, schweizer, italienischen und spanischen Krankenhäuser und Universitätskliniken zum Management der Medizintechnik erfolgreich eingesetzt wird.
Vorteil des IMT ist u.a., dass alle bekannten Sicherheitsmeldungen vom BfArm und ECRI nach Modellen (Gerätetypen) kodiert archiviert sind, ebenso wie die entsprechenden Gebrauchsanweisungen und Produktdatenblätter.
Der IMT ist übrigens sowohl mit ECRIs UMDNS als auch mit dem CND gematcht.
Lieber Herr Wolf,
vielen Dank für Ihren wertvollen Beitrag.
Herzliche Grüße,
Manuela Reinhold