Wenn Benannte Stellen Abweichungen bei klinischen Bewertungen feststellen, dann betreffen diese in vielen Fällen die klinischen Endpunkte.
Es ist daher für Medizinproduktehersteller unerlässlich, die klinischen Endpunkte präzise zu spezifizieren und nachzuweisen, dass sie tatsächlich erreicht wurden.
Worauf Hersteller dabei besonders achten sollten, erläutert dieser Artikel.
1. Klinische Endpunkte: Die Grundlagen
a) Hintergrund und Zielsetzung
Hersteller sind verpflichtet, die Sicherheit, Leistungsfähigkeit und den klinischen Nutzen ihrer Medizinprodukte anhand von klinischen Daten nachzuweisen. Dazu müssen die Hersteller festlegen, mit welchen klinisch relevanten Ergebnisparametern („Endpunkten“) sie diesen Nachweis als erbracht sehen.
Wenn ein Hersteller behauptet, sein Medizinprodukt sei geeignet, Schmerzen zu lindern, dann kann er die Schmerzreduktion mit dem VAS-Score quantifizieren. Wenn die klinischen Daten zeigen, dass der Wert tatsächlich um den angegebenen Wert sinkt, ist der Nachweis des klinischen Nutzens erbracht.
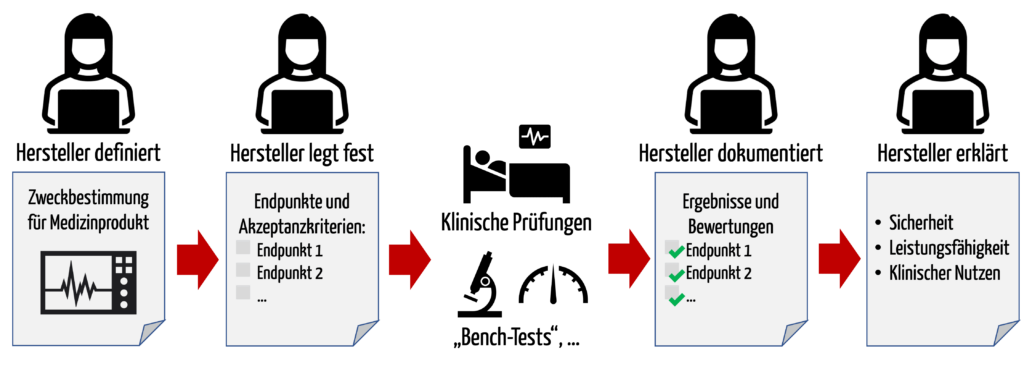
b) Definitionen und Synonyme
Endpunkte
Das DIMDI definiert (klinische) Endpunkte wie folgt:
Endpunkte sind Zielvariablen der Studie. Alle Endpunkte müssen vor Beginn der Studie bestimmt und im Studienprotokoll niedergeschrieben werden. Es muss definiert sein, welcher Parameter (WAS), zu welchem Zeitpunkt (WANN), mit welcher Methode, welchem Gerät oder Erhebungsinstrument etc. (WIE) erfasst wird.
Quelle: DIMDI
Die Definition der ISO 14155:2020:12 lautet ähnlich:
Endpunkt: <primärer> Hauptparameter, der herangezogen wird, um den Beweis für die klinische Leistungsfähigkeit (3.11), Wirksamkeit (3.20) oder Sicherheit in einer klinischen Prüfung (3.8) zu liefern
ISO 14155:2020:12, 3.22
Die klinischen Endpunkte bezeichnet man auch als klinisch relevante (Outcome) Parameter und im Englischen als Endpoints.
Primäre und sekundäre Endpunkte
Bei den Endpunkten unterscheidet man zwischen primären und sekundären Endpunkten.
Als primärer Endpunkt wird das Hauptziel der Studie bezeichnet, die Nebenziele sind die sekundären Endpunkte.
Quelle: DIMDI
Der primäre Endpunkt wird auch als „harter“ Endpunkt bezeichnet, da er objektiv und messbar sein muss.
Sekundäre Endpunkte sind „weichere Kriterien“, die verwendet werden, um die untersuchte Behandlung darüber hinaus zu charakterisieren. Dazu können etwa Daten zur Lebensqualität, Schmerzwahrnehmung, weiteren Eingriffen und Medikamenten herangezogen werden.
c) Bedeutung der klinischen Endpunkte bei klinischen Studien
Die Wahl der Endpunkte und Parameter ist auch bei der Planung einer Studie entscheidend: Studienendpunkte sind diejenigen Kriterien, die verwendet werden, um das Erreichen klinischer Forschungsziele zu messen, z. B. der Nachweis von Sicherheit, Leistung und patientenbezogenem Nutzen.
Soll die Sicherheit eines Produkts nachgewiesen werden, müssen im Prüfplan die Messgrößen festgelegt werden, die die Sicherheit dokumentieren und nachweisen sollen. Dies könnten beispielsweise die Anzahl schwerwiegender Komplikationen oder Anzahl und Dauer bestimmter Todesfälle oder Wiederaufnahmen ins Krankenhaus sein.
Diese Parameter sind objektiv und messbar.
In kontrollierten Studien (randomisierten kontrollierten Studien) werden in beiden Behandlungsgruppen die gleichen Parameter gemessen und miteinander verglichen.
Der Begriff „Parameter“ ist in diesem Kontext als Überbegriff des Begriffs „Endpunkt“ zu verstehen. Es gibt Parameter, die keine Endpunkte sind, z. B. die Materialbeständigkeit, die im Rahmen eines Bench-Tests bestimmt werden würden.
2. Regulatorische Anforderungen
Alle relevanten regulatorischen Anforderungen verpflichten die Hersteller dazu, die klinisch relevanten Endpunkte festzulegen. Allerdings unterscheiden sich die Regularien bei den Begriffsdefinitionen und der Granularität der Anforderungen.
a) Anforderungen der MDR
Die Bestimmung der klinisch relevanten Parameter wird in der MDR bei der Planung der klinischen Bewertung gefordert:
Sie schreibt:
MDR, ANHANG XIV, TEIL A – KLINISCHE BEWERTUNG
- detaillierte Beschreibung des angestrebten klinischen Nutzens für die Patienten mit relevanten konkreten Parametern für das klinische Ergebnis; [Englisch: „detailed description of intended clinical benefits to patients with relevant and specified clinical outcome parameters”]
- nichterschöpfende Liste und Spezifizierung der Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen und die Zweckbestimmung bzw. Zweckbestimmungen des Produkts;
- Der primäre Endpunkt muss für das Prüfprodukt sinnvoll und sollte klinisch relevant sein.
Benannte Stellen überprüfen in ihrem Clinical Evaluation Assessment Report (CEAR), ob eine Liste der Parameter aufgeführt und der klinische Nutzen mithilfe von Parametern evaluiert wird.
Oft wird die Sinnhaftigkeit dieser Parameter nicht überprüft! Viele Auditoren überprüfen nur, ob die Hersteller die Parameter festgelegt haben. Die Sinnhaftigkeit dieser Parameter hinterfragen sie hingegen nicht.
Hingegen bestehen die Auditoren darauf, dass die Wahl der Parameter dem Stand der Technik folgen MUSS. Das ergibt in einigen Fällen jedoch keinen Sinn, wie weiter unten (s. Surrogat-Endpunkte) ausgeführt wird.
Die Forderungen finden sich u. a. in
- MEDDEV, Kapitel 8.2 (current knowledge/ the state of the art […] justify the validity of surrogate endpoints (if used)
- MDR, Anhang XIV, Teil A 1a, Spiegelstrich 6
- MDCG 2020-13, Section C
Viele Hersteller sind sich nicht bewusst, dass die Anforderungen der MDR nach relevanten konkreten Parametern für das klinische Ergebnis gleichbedeutend sein können mit Endpunkten von Studien. Bezogen auf die klinischen Prüfungen schreibt die MDR:
„2.6. Die Endpunkte der klinischen Prüfung beziehen sich auf die Zweckbestimmung, den klinischen Nutzen, die Leistung und die Sicherheit des Produkts. Sie werden mithilfe wissenschaftlich fundierter Methoden festgelegt und bewertet. Der primäre Endpunkt muss produktspezifisch und klinisch relevant sein.“
ANHANG XV KLINISCHE PRÜFUNGEN KAPITEL I ALLGEMEINE ANFORDERUNGEN
b) Anforderungen der Leitlinie MDCG 2020-13
Benannte Stellen überprüfen Parameter anhand der Leitlinie MDCG 2020-13. Diese Leitlinie verlangt:
“Has the manufacturer adequately described an indicative list and specification of parameters used to determine, based on the state of the art in medicine, the acceptability of the benefit-risk ratio for the various indications and for the intended purpose or purposes of the device?“
MDCG 2020-13
Dass die Hersteller diese Parameter nicht ausreichend festlegen, zählt zu den häufigsten Punkten in Mängelberichten.
c) Anforderungen der MEDDEV 2.7/1 rev. 4
Auch die MEDDEV 2.7/1 rev.4 fordert, dass die Hersteller die Endpunkte festlegen:
c. Quantification of benefit(s) to the patients
MEDDEV 2.7/1 rev.4 A7.2.
- Defining specified endpoints is indispensable for setting up clinical investigations and properly performing the identification, appraisal, and analysis of the clinical data.
- Benefit(s) are often evaluated along a scale or according to specific endpoints or criteria (types of benefits), or by evaluating whether a pre-identified health threshold was achieved.
- The change in subjects’ condition or clinical management as measured on that scale, or as determined by an improvement or worsening of the endpoint, determines the magnitude of
- the benefit(s) in subjects. Variation in the magnitude of the benefit across a population may also be considered.
- The clinical relevance of these changes should be discussed and justified.
- Ideally, these parameters should be directly clinically relevant.
- In certain cases benefits can be assumed when validated surrogate endpoints are met (such as obtaining certain results with laboratory tests or measurements of anatomical or physiological properties).
- Based on the current state of medical knowledge, the evaluators shall justify and document the clinical relevance of endpoints used for the clinical evaluation of a device and demonstrate the validity of all surrogate endpoints (if surrogate endpoints have been used).
Allerdings enthält die MEDDEV 2.7/1 rev.4 weder eine Definition noch eine genauere Beschreibung dessen, was die Leitlinie unter einem Endpunkt versteht.
d) Anforderungen der ISO 14155:2020:12
Die ISO 14155, die Norm zu den klinischen Prüfungen, fordert ebenfalls spezifizierte Endpunkte:
c) Primäre und sekundäre Endpunkte mit der Begründung für deren Wahl und Messung. Kombinierte Endpunkte, sofern vorhanden, mit der Begründung für deren Wahl und Messung. […]
ISO 14155:2020:12
3. Auswahl der Endpunkte / Parameter
a) Herausforderung bei der Auswahl der klinischen Endpunkte
Herausforderung 1: Geeignete Endpunkte festlegen
Die MDR fordert nur, dass Parameter, die den klinischen Nutzen untermauern, klinisch relevant sein müssen und messbar sein sollten:
Der primäre Endpunkt muss für das Prüfprodukt sinnvoll und sollte klinisch relevant sein.
ANHANG XV KLINISCHE PRÜFUNGEN KAPITEL I ALLGEMEINE ANFORDERUNGEN
Welche Endpunkte als sinnvoll erscheinen, muss der Hersteller entscheiden.
Herausforderung 2: Interessenkonflikte
Bei der Auswahl der Endpunkte kann es zu Interessenkonflikten kommen.
| Rolle | Interesse |
| Hersteller | Produkt möglichst schnell in den Markt bekommen |
| Produktmanager | Möglichst viele Nutzen erklären |
| Für klinische Bewertung verantwortliche Person | Nutzen für Patienten nachweisen |
| Arzt, Ärztin | Eine (z. B. chirurgische) Methode verbessern |
Herausforderung 3: Medizinprodukte ohne medizinische Zweckbestimmung
Es gibt Medizinprodukte, die keine medizinische Zweckbestimmung haben oder bei denen klinische Daten keinen Sinn ergeben. Beispiele dafür sind Zubehör und einige Medizinprodukte der Klasse I:
- Phantom zum Kalibrieren eines CTs
- Arbeitsplatz, mit dem Untersuchungsergebnisse erfasst werden können
- Steckbeckenspülapparat zum Reinigen von Bettpfannen
- Turbinen für Dentalbohrer
- Leitsysteme für Dialysierflüssigkeit und Dialysewasser in Dialysezentren
In diesen Fällen müssen keine klinisch relevanten Endpunkte erhoben werden, sondern nur technische Parameter (Leistungsparameter). Deswegen spricht die MDR von Parametern und nicht von Endpunkten.
b) Vorgehen zur Auswahl der Endpunkte (allgemein)
Der Hersteller sollte aus dem Stand der Technik mithilfe einer systematischen Literaturrecherche ermitteln …
- … die relevanten konkreten Parameter, die das klinische Ergebnis beurteilen lassen
- … deren Akzeptanzkriterien
Die Akzeptanzkriterien legen die Grenzwerte fest, innerhalb derer der Endpunkt als erreicht gilt. Die Hersteller ermitteln diese aus der Literatur, aus Normen und sonstigen Standards.
| Beispiel für Produkt | Beispiel für versprochenen Nutzen | Beispiele für Parameter zur Messung dieses Nutzens | Beispiele für Akzeptanzkriterien für die Parameter |
| Kühlpack | Schmerzreduktion | Schmerzreduktion / Schmerzintensität mittels VAS-Score | -3,5 Punkte nach 6 Wochen oder -30 % nach 24 h |
| Kühlpack | Reduktion von Schwellungen | Zeit und Ausmaß zur Reduktion der Schwellung | Reduktion um 2 Punkte (von 10 auf 8) |
| Standalone-Software | Verbesserung der Schlafqualität | Objektive Schlafqualität: Effizienz Subjektive Schlafqualität: Pittsburgh Sleep Quality Index | 80 % 8,0 |
Hilfreich bei dieser Tätigkeit ist der Fachartikel zur systematischen Literaturrecherche.
c) Auswahl der klinischen Endpunkte (Parameter mit Bezug zum klinischen Nutzen)
Allgemeines
Laut Artikel 2 MDR muss die „klinische Leistung“ eines Produkts […] die vom Hersteller angegebene Zweckbestimmung erfüllen, sodass bei bestimmungsgemäßer Verwendung nach Angabe des Herstellers ein klinischer Nutzen für Patienten erreicht wird.
Die MDR definiert, was sie unter dem klinischen Nutzen versteht:
Bezeichnet die positiven Auswirkungen eines Produkts auf die Gesundheit einer Person, die anhand aussagekräftiger, messbarer und patientenrelevanter klinischer Ergebnisse einschließlich der Diagnoseergebnisse angegeben werden, oder eine positive Auswirkung auf das Patientenmanagement oder die öffentliche Gesundheit.
Der klinische Nutzen ist für jedes Produkt individuell zu betrachten.
Laut MDR Annex I, Kapitel III, 23.4 (c) muss der klinische Nutzen vom Hersteller in der Gebrauchsanweisung angegeben werden.
Beispiele für Parameter mit Bezug zum klinischen Nutzen (klinische Endpunkte)
Es gibt verschiedene Klassen von klinischem Nutzen und damit klinischen Endpunkten:
| Klinischer Nutzen, klinischer Endpunkt | Beispiele |
| Positive Auswirkungen auf das klinische Ergebnis | Reduzierte Wahrscheinlichkeit von unerwünschten Ergebnissen, z. B. Reduzierung von Blutverlust und dadurch reduzierte Mortalität, Morbidität; Verbesserung der beeinträchtigten Körperfunktion; Verkürzung der Operationsdauer |
| Lebensqualität des Patienten | Schnellere Genesung (erhebliche Verbesserungen, auch durch Vereinfachung der Pflege oder Verbesserung des klinischen Managements von Patienten, Verbesserung der Körperfunktionen, Reduktion von Symptomen) |
| Bessere Diagnose | Ermöglichung einer korrekten Diagnose; schnellere Diagnosestellung; Patienten identifizieren, die eher auf eine bestimmte Therapie ansprechen |
| Therapieerfolg und langfristige Wirksamkeit, Auswirkungen auf die öffentliche Gesundheit | Fähigkeit eines medizinischen Diagnosegeräts, eine spezifische Krankheit zu erkennen und somit deren Ausbreitung zu verhindern, um Phasen, Stadien, Orte zu identifizieren, Schwere oder Varianten der Krankheit; Vorhersage des zukünftigen Krankheitsbeginns |
Zwar sollten die Parameter angemessen und unmittelbar klinisch relevant sein. Aber in bestimmten Fällen kann von einem Nutzen ausgegangen werden, wenn validierte Surrogat-Endpunkte erfüllt sind (z. B. Erzielung bestimmter Ergebnisse bei Labortests oder Messungen anatomischer oder physiologischer Eigenschaften).
Bei Medikamenten wählt man als Klassen für klinische Endpunkte auch:
- Mortalität
- Morbidität
- Gesundheitsbezogene Lebensqualität
- Nebenwirkungen
d) Auswahl der Leistungs- und Sicherheitsparameter
Schritt 1: Entscheiden, für welche Parameter klinische Daten notwendig sind
Hersteller müssen auch Sicherheits- und Leistungsparameter bestimmen, die teilweise durch klinische Studien nachgewiesen werden.
| Parametertyp | Mit klinischen Daten nachzuweisen | Mit Bench-Tests nachweisbar |
| Leistungsparameter | Quality of Life (QOL) Bildqualität (Bench Tests) Messgenauigkeit bei Diagnoseprodukten (Bench Tests) Sensitivität und Spezifität von Tests (benötigt beides) | Bildqualität Messgenauigkeit bei Diagnoseprodukten Sensitivität und Spezifität von Tests (benötigt beides) Materialbeständigkeit Frühzeitige Fehlererkennung (Poka Yoke) |
| Sicherheitsparameter | Mortalität Fehlfunktion des Geräts pro Jahr Anzahl der unerwünschten Ereignisse pro Jahr | Gebrauchstauglichkeit Elektrische Sicherheit Biokompatibilität Reinigbarkeit Sterilität Alarmierung |
Nicht alle Parameter, die in der klinischen Bewertung für die Überprüfung der Sicherheit und Leistung eines Produkts erfasst werden müssen, sind klinisch relevant.
Zudem gibt es Sicherheit und Leistungsparameter, die nicht an Endpunkte einer klinischen Studie mit Patienten geknüpft sind, sondern andere experimentelle Studien erfordern. Diese sind dennoch wichtig für die Beweisführung in der klinischen Bewertung.
Schritt 2: Akzeptanzkriterien bestimmen
Für Parameter, für die klinische Daten notwendig sind, muss der Hersteller die Akzeptanzkriterien bestimmen. Wie bei den klinischen Parametern (Endpunkten) bedient er sich dazu der Literatur, Normen und sonstigen Standards.
| Parametertyp | Beispiel für Produkt | Beispiel für Parameter | Beispiele für Akzeptanzkriterien |
| Leistungsparameter | Kühlpack | Minimal erreichbare Hauttemperatur | < 13,6 °C |
| Leistungsparameter | Kühlpack | Halten der Temperatur über eine gewisse Zeit | 20 Minuten Applikationszeit |
| Leistungsparameter | Standalone-Software | Messung der Schlafdauer | 7 h |
| Sicherheitsparameter | Kühlpack | Rate unerwünschter Nebenwirkungen wie Kälteverbrennungen | 1 % Kälteverbrennungen |
| Sicherheitsparameter | Standalone-Software | Anzahl an Fehlfunktionen | 0,5 % |
| Sicherheitsparameter | Implantat | Rate an Infektionen | 2,5 % |
4. Häufige Fehler
Fehler 1: Unspezifische oder nicht messbare Endpunkte
Wenn klinisch relevante Outcome-Parameter nicht spezifisch und nicht messbar festgelegt sind, lässt sich weder eine Studie planen noch in einer klinischen Bewertung der Nachweis führen, dass diese Parameter erreicht sind.
| Parameter | Schlechtes Beispiel | Gutes Beispiel |
| Schmerzen | Lindert Schmerzen | Reduziert Schmerzen auf der numerischen Rating-Skala (NRS) um 10 % |
| Muskelaufbau | Fördert Muskelaufbau | Verbessert bei einer Muskelkraftmessung die „Mean Peak Toque“ um 30 % |
Fehler 2: Nicht relevante Endpunkte
Probleme mit nicht relevanten Surrogat-Endpunkten
Anstatt patientenrelevanter Endpunkte ermittelt man oft sogenannte Surrogat-Endpunkte. Diese lassen sich meistens schneller bestimmen.
Surrogat-Endpunkte sind oft physiologische oder biochemische Messwerte, die aber selbst nicht von unmittelbarer Bedeutung für den Patienten sind. Damit lässt sich jedoch oft die Fallzahl drücken, damit eine kleinere Patientenpopulation gewählt werden kann und die Kosten für die Studien sinken. Die ethische Vertretbarkeit ist aber fraglich.
Vorteile von patientenrelevanten Endpunkten
Patientenrelevante Endpunkte sind direkt für den Patienten erfahrbar. Darunter fallen Parameter wie Mortalität, Morbidität, Nebenwirkungen und gesundheitsbezogene Lebensqualität.
| Produkt, Methode | Surrogat-Endpunkt | Patientenrelevanter Endpunkt |
| Operationsmethode | Reduktion von Blutverlusten | Zeit bis zur Genesung oder eine Lebensqualität |
| Implantate | Krankenhausaufenthalt (Liegedauer des Patienten) | Anzahl der Regressionseingriffe |
| Autoinjektor (bspw. für Insulin) | Minimale Systemfehler, Fehlinjektionen | Adhärenz (Therapietreue) |
Die für die klinische Bewertung Verantwortlichen müssen die Endpunkte kritisch hinterfragen und aus dem Stand der Technik ermitteln.
Fehler 3: Endpunkte in der falschen Studienumgebung
Wenn das Design einer Studie nicht korrekt geplant ist, kann die Aussagekraft der gemessenen Endpunkte limitiert sein. Beispiele, die eine Ermittlung der Endpunkte beeinflussen, sind:
- Messung zum falschen Zeitpunkt oder an der falschen Patientenpopulation
- Zu geringe Fallzahl
- Falsche Statistik (Methode)
- Falsche Kontrollgruppe (Bias)
- Störfaktoren (wie die zusätzliche Gabe von Schmerzmitteln, obwohl die Schmerzreduktion durch das Produkt gemessen wird)
5. Unterstützung
Sie stehen noch am Anfang Ihrer klinischen Bewertung?
Unser Clinical Evaluation Jumpstart Kit hilft Ihnen, die ersten Schritte innerhalb der klinischen Bewertung Ihrer Medizinprodukte zu gehen und verschafft Orientierung, was konkret von Ihnen verlangt wird.
a) Klinische Strategie festlegen
Die klinischen Expertinnen und Experten des Johner Instituts helfen Ihnen dabei, die klinische Strategie festzulegen und in einem Clinical Evaluation Plan (CEP) zu formulieren. Dazu zählen:
- Stand der Technik ermitteln
- Klinisch relevante Parameter ableiten, um den klinischen Nutzen abzuleiten
- Akzeptanzkriterien festlegen
- Methode zum Nachweis bestimmen, dass dies Akzeptanzkriterien erfüllt sind
Damit haben Sie den notwendigen Input für die nächsten Schritte und gleichzeitig alle regulatorischen Anforderungen an den CEP erfüllt.
b) Beim Studiendesign unterstützen und Fallzahlplanung durchführen
Auf Basis der klinischen Strategie lässt sich die Studie planen („designen“). Dabei unterstützen Sie die Expertinnen und Experten der Johner Instituts. Sie berechnen dafür auch die Fallzahl und achten darauf, dass die Kosten für die Studie so gering wie möglich bleiben, aber so viele Patienten wie nötig eingeschlossen werden, um den klinischen Nutzen des Medizinprodukts zu beweisen.
Damit erhalten Sie einen klaren Fahrplan und können Dauer und Kosten der klinischen Prüfungen abschätzen. Sie vermeiden den Worst Case, nämlich dass eine Benannte Stelle oder Behörde nach Studienende die Ergebnisse als nicht ausreichend ablehnt.
Unterstützung
Nutzen Sie die Unterstützung des Johner Instituts, damit Sie schnell und gezielt zu einer präzisen klinischen Bewertung kommen und so die Voraussetzung für die rasche Vermarktung Ihrer Produkte schaffen.
Melden Sie sich gerne hier, um die nächsten Schritte dafür zu klären.
6. Fazit und Zusammenfassung
Die richtigen Parameter und Endpunkte zu bestimmen, ist herausfordernd. Daher überrascht es nicht, dass bei den vielen Prüfungen durch Benannte Stellen die Wahl dieser Endpunkte und deren Akzeptanzkriterien zu Mängelberichten führt. Das wiederum verzögert oder verhindert die Vermarktung vieler Medizinprodukte.
Ohne die Wahl relevanter Endpunkte lässt sich keine klinische Prüfung planen, die geeignet ist, den klinischen Nutzen, die Sicherheit und Leistungsfähigkeit von Medizinprodukten nachzuweisen.
Daher sollten Sie als Hersteller die dafür notwendige Zeit einplanen und die notwendigen Kompetenzen aufbauen oder hinzuziehen. Das sind Sie nicht nur sich und den Benannten Stellen, sondern v. a. Ihren Patienten schuldig.


