Eine FDA-Inspektion ist für viele Hersteller von Medizinprodukten mit großem Stress verbunden. Viele Firmen kennen die möglichen Konsequenzen wie einen öffentlichen Warning Letter und gar eine strafrechtliche Verfolgung. Aber sie wissen oft nicht, wie sie diese Konsequenzen sicher vermeiden können, ohne tagelang das ganze Unternehmen stillzulegen.
Dieser Artikel zeigt, wie
- eine FDA-Inspektion verläuft,
- Sie Ihr Unternehmen vorbereiten können und
- Sie sich bei einer Inspektion verhalten sollten.
So wird eine FDA-Inspektion für Sie zum Erfolg!
1. FDA Inspection: Die Grundlagen
1.1. Definition
Eine FDA-Inspektion ist ein strukturiertes Verfahren, bei dem die FDA die Konformität von Organisationen mit den Anforderungen des 21 CFR (Code of Federal Regulation) prüft, insbesondere mit den Qualitätsanforderungen des 21 CFR part 820. Dieses Gesetz wird auch QSR genannt, Quality System Regulations.
Mit FDA-Inspektionen müssen alle Organisationen rechnen, die unter die Regelungen des 21 CFR fallen. Das sind neben den Medizinprodukteherstellern auch Pharmafirmen und die Lebensmittelindustrie.
Die FDA führt Inspektionen weltweit durch, d. h. vor Ort bei den zu prüfenden Organisationen.
1.2 Abgrenzung von Inspektionen und Audits
Im Gegensatz zu einem Audit hat eine Inspektion nicht das Ziel, Verbesserungspotenziale zu identifizieren. Hier geht es „nur“ um Gesetzesverstöße.
- Ein Audit führt bei Erfolg zu einem Zertifikat (oder dessen Verlängerung) und bei Misserfolg im schlimmsten Fall zum Zertifikatsentzug.
- Bei einer nicht erfolgreichen FDA-Inspektion drohen hingegen schwerwiegendere Konsequenzen (siehe unten).
1.3 Inspektionstypen
Abhängig vom Anlass unterscheidet die FDA verschiedene Inspektionstypen.
1.3.1 Pre-Approval Inspections
Bei Hochrisiko-Medizinprodukten, die ein Pre-Market Approval (PMA) durchlaufen, führt die FDA im Rahmen des Zulassungsverfahrens bei Bedarf eine Pre-Approval Inspection durch. Eine erfolgreiche Inspektion ist die Voraussetzung für die Vermarktung der Produkte in den USA.
1.3.2 For-cause Inspections
For-cause Inspections beziehen sich immer auf einen Anlass. Sie finden insbesondere dann statt, wenn aktuelle Vorkommnisse mit dem eigenen Produkt oder Konkurrenzprodukten oder sonstige Hinweise auf einen Gesetzesverstoß vorliegen.
1.3.3 Follow-up Inspections
Wenn die FDA bei erfolgten Inspektion Abweichungen festgestellt hat, kann sie Follow-up Inspections durchführen. Dabei prüft die Behörde, ob die Organisation die geplanten Korrekturmaßnahmen tatsächlich durchgeführt und die Verstöße behoben hat.
1.3.4 Routine Inspections
Der häufigste Inspektionstyp sind die Routine Inspections. Die Häufigkeit dieser Routine-Inspektionen hängt u. a. ab von:
- Produkttyp
- Risiko bzw. Klasse des Produkts
- Ergebnisse bisheriger Inspektionen (Probleme)
- Datum der letzten Inspektion
- Ergebnisse von Inspektionen/Audits anderer Behörden oder Stellen (z. B. MDSAP)
In den „Corona-Jahren“ führte die Behörde anfänglich keine dieser Inspektionen außerhalb der USA durch. Sie kehrt jetzt wieder zum ursprünglichen Muster zurück.
Die FDA hat Leitfäden zu ihren Inspektionen veröffentlicht. Allerdings sind diese Informationen teilweise 25 Jahre alt und nicht mehr in allen Fällen aktuell.
2. Ablauf von Inspektionen
Eine FDA-Inspektion verläuft aus Herstellersicht in mehreren Phasen (s. Abb. 1).
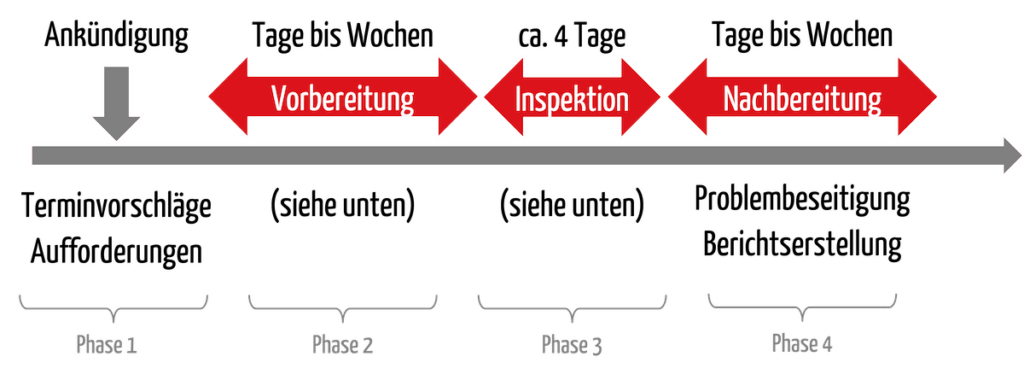
2.1 Phase 1: Ankündigung und Abstimmung
Das Verfahren beginnt damit, dass sich die Behörde meldet, in der Regel per E-Mail. In diesem Schreiben informiert die FDA darüber, dass eine Inspektion stattfinden wird. Sie schlägt Termine vor, von denen die Unternehmen nach Möglichkeit einen annehmen sollten.
Die FDA fordert die Unternehmen üblicherweise auf, ihr QM-Handbuch an die Behörde zu schicken. Nicht alle Verfahrensanweisungen, aber das Handbuch. Damit bereitet sich die FDA vor. Sie wird noch weitere Informationen anfordern, wie die Liste der aktuell in den USA vermarkteten Produkte und ob bei Inspektionen im Ausland Übersetzer zur Verfügung stehen.
Unternehmen mit Sitz in den USA haben oft nur wenige Tage Zeit zwischen Ankündigung der Inspektion und der Inspektion selbst. In Europa haben die Unternehmen meistens einen bis drei Monate Zeit.
2.2 Phase 2: Vorbereitung
In dieser Phase sollten die Unternehmen ihr Qualitätsmanagementsystem auf Konformität mit den Anforderungen des 21 CFR part 820 prüfen. Dabei helfen ein internes Audit oder eine Mock-Inspektion (oft mit externer Hilfe). Mögliche Nichtkonformitäten werden beseitigt.
Befolgen Sie die Empfehlungen zur Vorbereitung in Abschnitt 4.1 dieses Artikels!
2.3 Phase 3: Durchführung
Die Inspektion findet statt. Eine Routine-Inspektion dauert im Regelfall vier Tage.
2.3.1 Beginn
Ähnlich wie bei einem Audit beginnt die Inspektion mit einem Eröffnungsgespräch. Dabei wird u. a. die Agenda besprochen. Das Unternehmen sollte im Eröffnungsgespräch sich und seine Produkte kurz vorzustellen. Es kann einen Firmenrundgang vorschlagen, damit der Inspektor einen Eindruck vom Unternehmen bzw. der Betriebsstätte erhält.
2.3.2 Prüfung mit dem QSIT-Verfahren
Die eigentliche Inspektion führt die FDA im QSIT-Verfahren durch. QSIT steht für Quality System Inspection Technique, einen Top-Down-Ansatz. Die FDA startet mit einzelnen Prozessen und arbeitet sich von dort vor bis hin zu einzelnen Aufzeichnungen. Der Inspektor muss dabei eine gewisse Anzahl Stichproben ziehen. Die Anzahl gibt die QSIT vor.
2.3.3 Dokumentation von Beobachtungen
Abweichungen, d. h. die Inspectional Observations, notiert der Inspektor auf einem sogenannten 483er. Das ist die Nummer des entsprechenden Formulars der FDA. Zusätzlich vermerkt der Inspektor discussion items, also diskussionswürdige Punkte, die aber nicht zwingend eine Abweichung darstellen. Diese werden nicht auf dem 483er dokumentiert, sondern landen im finalen Bericht. Dieser heißt Establishment Inspection Report oder kurz EIR.
2.3.4 Abschluss
Am Ende der Inspektion erklärt der Inspektor dem Unternehmen die von ihm gefundenen Abweichungen sowie discussion items.
2.4 Phase 4: Nachbereitung
Nach der Inspektion müssen sich die Unternehmen – falls notwendig – um die Beseitigung der Probleme kümmern. Sie sollten unverzüglich beginnen, erste Probleme zu beseitigen und der FDA einen präzisen Maßnahmeplan vorstellen. Auf das 483er erwartet die FDA innerhalb von 15 Werktagen eine Antwort.
Die FDA stellt den Bericht fertig. Die Dauer bis zur Finalisierung und Übermittlung des Berichts ist abhängig vor allem von den möglichen Konsequenzen (siehe Abschnitt 3). Sind keine regulatorischen Maßnahmen geplant, können Unternehmen innerhalb von ca. 30 bis 50 Tagen mit dem Bericht und dem Abschluss des Verfahrens rechnen.
Unser FDA-Experte Luca Salvatore gibt im Gespräch mit Prof. Johner Tipps, wie man sich auf eine Inspektion vorbereitet und wie man sich während einer Inspektion am besten verhält.
Er nennt auch die häufigsten Gründe, die zu Problemen bei Inspektionen führen und beschreibt, wie Hersteller diese Probleme vermeiden können.
Diese und weitere Podcast-Episoden finden Sie auch hier.
3. Ergebnisse der Inspektion
Die Konsequenzen bzw. die Aufgaben für ein Unternehmen hängen vom Ergebnis der Inspektion ab.
3.1 No Action Indicated NAI
No Action Indicated ist der Idealfall. Dann hat das Unternehmen alles richtig gemacht. Es gab keine Findings bzw. Gesetzesverstöße und die FDA plant keine Maßnahmen.
3.2 Voluntary Actions Indicated VAI
Die nächste Stufe sind die Voluntary Actions Indicated. In diesem Fall hat die FDA Abweichungen fest- und einen 483er ausgestellt. VAI erfolgen bei Abweichungen, die unter dem Schwellenwert für ernste regulatorische Maßnahmen liegen. Dennoch kann die FDA eine schriftliche Antwort des Unternehmens anfordern und Korrekturmaßnahmen empfehlen. Diese sind allerdings freiwillig.
3.3 Official Action Indicated OAI
Größere Abweichungen führen zu einer Official Action Indicated. Es liegt ein wirkliches Problem vor, um das sich das Unternehmen dringend kümmern muss.
Im schlimmsten Fall haben diese großen Abweichungen weitere Konsequenzen, z. B.:
- FDA Warning Letter
- Import-Stopp
- Beschlagnahmung der Produkte
- Strafverfolgungsmaßnahmen
Ob es zu dieser Eskalation kommt, hängt davon ab, wie und wie schnell das Unternehmen reagiert und etwaige Korrekturmaßnahmen umsetzt.
4. Praxistipps für FDA-Inspektionen
4.1 Tipps für die Ankündigungs- und Vorbereitungsphase
Legen Sie sofort los und nutzen Sie die Zeit bis zur Inspektion, um sich bestmöglich vorzubereiten. Gehen Sie wie folgt vor:
4.1.1 Vorbereitung planen
- Informieren Sie sofort die Geschäftsleitung und die Bereichsverantwortlichen. Die müssen Bescheid wissen und ggf. Ressourcen freischaufeln.
- Sorgen Sie dafür, dass alle Personen, die für die Inspektion notwendig sind, an den Inspektionstagen verfügbar sind. Das sind neben der Geschäftsleitung natürlich der QMB, jemand aus Regulatory Affairs sowie die Prozessverantwortlichen.
- Bereiten Sie die notwendige Technik vor, z. B. für die Kommunikation und Protokollierung, und prüfen Sie diese vor der Inspektion.
4.1.2 Konformität prüfen
Dann heißt es, die Konformität Ihres QM-Systems zu prüfen, falls das noch nicht geschehen ist. Dazu führt man typischerweise ein internes Audit durch. Intern heißt aber nicht, dass das nicht eine externe Person machen darf. Es ist sogar zu empfehlen, eine externe Person mit hoher Kompetenz und einem neutralen Blick einzubeziehen.
Nutzen Sie unsere Experts für FDA und QM, um Nichtkonformitäten zuverlässig zu erkennen und zur Zufriedenheit der FDA zu beseitigen. Unsere Experts haben schon alles gesehen. Also scheuen Sie sich nicht, sich zu melden.
Als Ergebnis dieser Prüfungen liegt Ihnen eine Liste mit Abweichungen bzw. Verbesserungsmaßnahmen vor.
Die Top 3 der Abweichungen umfassen das CAPA-System, die Reklamationsbearbeitung und das Vigilanzsystem oder Meldewesen. Überprüfen Sie daher diese Prozesse besonders intensiv.
4.1.3 Plan zur Beseitigung der Nichtkonformitäten erstellen und abarbeiten
- Erstellen Sie einen Abarbeitungsplan und arbeiten Sie diesen ab.
- Falls sie nennenswerte Abweichungen entdecken, steht ein Remediation-Projekt an. Dieses hat das Ziel, alle Nichtkonformitäten schnellstmöglich und bestmöglich bis zur Inspektion zu beseitigen.
4.1.4 Inspektion generalstabsmäßig üben
Eine weitere Empfehlung ist das Üben der Inspektion. Dazu zählt eine Generalprobe. Denn jede und jeder im Unternehmen muss wissen,
- wie eine Inspektion abläuft,
- wie er oder sie sich bei der Inspektion verhalten soll und
- was man sagen soll und was nicht, um nicht die Vorbereitung zunichte zu machen.
Diese Generalprobe heißt auch Mock Inspection.
Unsere Experts schulen Sie im richtigen Verhalten und führen mit Ihnen Mock Inspections durch. So stellen Sie sicher, dass sich Ihr Team bei der Inspektion professionell verhält und den Erfolg der Inspektion nicht gefährdet.
4.2 Verhalten während den Inspektionen
Tipp 1: Beantworten Sie die Fragen der Inspektoren, aber nicht mehr.
Tipp 2: Spielen Sie nicht auf Zeit. Wenn Sie die angeforderten Nachweise, z. B. Prüfprotokolle oder Schulungsnachweise, nicht in angemessener Zeit liefern können, dann verärgern Sie nicht nur den Inspektor. Sie provozieren damit eine Abweichung.
Tipp 3: Trennen Sie den Front Room, in dem der Inspektor mit Ihrem QM-Beauftragten, Protokollanten sowie der oder dem Verantwortlichen für den gerade geprüften Bereich sitzen, vom War Room, auch Backoffice genannt. Im War Room sitzen weitere Personen, die die Aufgabe haben, die geforderten Unterlagen zu organisieren und die geforderten Aufzeichnungen und Dokumente im Unternehmen anzufragen und herauszugeben.
Tipp 4: Falls Sie bereits während der Inspektion Maßnahmen festlegen oder gar umsetzen können, kommt das gut an.
Tipp 5: Es klingt vielleicht banal, ist aber wichtig: Behandeln Sie den Inspektor wertschätzend und freundlich. Immer. Auch wenn sie nicht seiner oder ihrer Meinung sind. Werden Sie auch nicht kompromittierend.
5. Zusammenfassung
Behalten Sie einen kühlen Kopf, wenn sich die FDA für eine Inspektion ankündigt; aber handeln Sie schnell und konsequent. Denn Sie wollen und müssen einen negativen Ausgang vermeiden, um die Reputation und Existenz Ihres Unternehmens zu sichern.
Über die Wahrscheinlichkeit, dass Ihre Inspektion erfolgreich verläuft, entscheidet vor allem die Güte Ihrer Vorbereitung. Dazu zählen neben internen Audis auch Mock Inspections, mit denen Sie das richtige Verhalten während der FDA-Inspektion üben.
Die FDA Experts des Johner Instituts haben durch ihre Hilfe bei Inspektionen bisher immer einen FDA Warning Letter abwenden können. Nutzen Sie diese Expertise bei dem, was jetzt ansteht:
- Die Konformität des QMS über ein internes Audit sicherstellen und etwaige Abweichungen identifizieren
- Maßnahmenpläne zur Beseitigung von Nichtkonformitäten erstellen
- Durch Abstellen der Ursache (root cause) Nichtkonformitäten nachhaltig beseitigen
- Das richtige Verhalten bei Inspektionen bei Schulungen und Mock-Up Inspections üben
- Vor, während und nach den Inspektionen mit der FDA professionell kommunizieren
Melden Sie sich, damit Ihre FDA-Inspektion mit minimalem Stress und ohne unnötige Aufwände erfolgreich über die Bühne geht und Sie danach einen Grund zum Feiern haben. Wir besprechen in einem ersten Gespräch gleich Ihren persönlichen Fahrplan.




