Viele Medizinproduktehersteller empfinden die internationale Zulassung ihrer Produkte als ein Wagnis: Den Chancen neuer Märkte stehen schwer kalkulierbare Risiken sowie Kosten und Aufwände für diese Zulassungen gegenüber.
Mit fünf Schritten und der Checkliste „Internationale Zulassung“ wird es den Herstellern gelingen, diese Risiken besser zu beherrschen. Das ist notwendig, denn eine gescheiterte Zulassung ist nicht der „worst case“.
1. Diese Herausforderungen müssen Sie bei der internationalen Zulassung bewältigen
In einer Umfrage des Johner Instituts benannten die Teilnehmenden die häufigsten Schwierigkeiten bei der internationalen Zulassung ihrer Produkte.
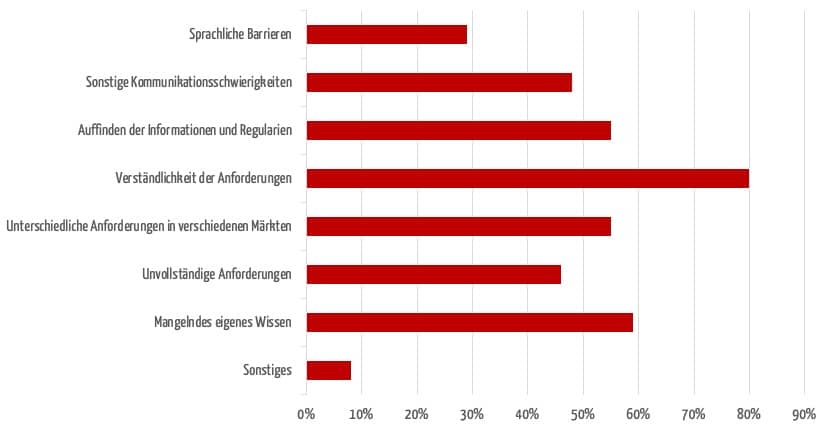
Oft zieht sich eine Zulassung allein durch Kommunikationsschwierigkeiten in die Länge. Die Gründe hierfür sind vielschichtig und reichen von sprachlichen Barrieren über ein unterschiedliches Verständnis von Anforderungen bis hin zu kulturellen Gepflogenheiten.
Auch das Auffinden konkreter und korrekter Anforderungen stellt immer wieder eine Hürde dar. Oft sind Informationen unvollständig oder werden nur nach und nach geliefert – sei es durch lokale Vertriebspartner, die an der Zulassung beteiligt sind, oder durch Behörden.
Weiterhin können Begriffe unterschiedlich definiert werden und so zu Missverständnissen führen. Und jeder, der bereits eine Zulassung durchgeführt hat, kennt die Herausforderungen bürokratischer Strukturen.
Manche empfinden sogar eine Willkür der Behörden, wenn am Ende die Dokumentation, die die Hersteller mit Mühe und nach bestem Gewissen erstellt haben, doch nicht die Anforderungen erfüllt.
In der Umfrage haben viele Hersteller auch das eigene mangelnde Wissen als behindernd eingestuft. Besonders häufig nannten sie auch als Schwierigkeit, dass unterschiedliche Anforderungen in den verschiedenen Ländern bestehen.
Fazit: Den Prozess der internationalen Zulassung zu durchlaufen, kann teuer, zeitaufwändig, und frustrierend sein.
Selbst eine Zulassung, in die viel Zeit und Energie geflossen ist und am Ende scheiterte, stellt nicht notwendigerweise den „Worst Case“ dar.
Im Podcast 2020-03 berichtet Luca Salvatore, ein Experte des Johner Instituts für internationale Zulassungen, von existenzbedrohenden Szenarien.
2. Die internationale Medizinproduktezulassung in 5 Schritten
Um zu verhindern, dass Ihr Zulassungsprozess an diesen Herausforderungen scheitert, empfiehlt das Johner Institut, die Zulassung in fünf Schritten zu durchlaufen. Diese Schritte helfen dabei,
- die internationale Zulassung strukturiert zu planen,
- unvorhergesehene Kosten und Aufwände zu vermeiden und
- Risiken zu minimieren.
Eine Checkliste am Ende des Artikels stellt sicher, dass bei der Planung keine Aktivitäten vergessen und Nacharbeiten notwendig werden, die die Zulassung verzögern oder gar gefährden.
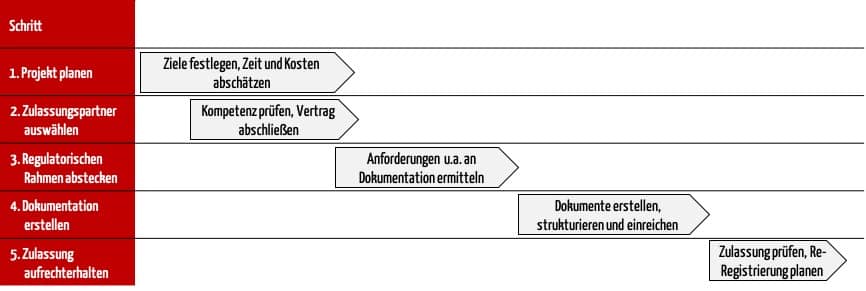
Schritt 1: Projekt planen
Jedes Projekt beginnt mit der Festlegung von Zielsetzungen. Dazu zählen:
- Auswahl der Märkte
- Auswahl der Produkte
- Zeitpunkt und Reihenfolge des Markteintritts
Identifizieren Sie die Behörden, die die Zulassung Ihrer Medizinprodukte im jeweiligen Land regulieren. Sie finden auf deren Webseiten nicht nur die (meisten) Zulassungsanforderungen, sondern auch erste Informationen zum Ablauf und damit zur Dauer sowie zu den Kosten.
Bestimmen Sie nach Möglichkeit die Klassifizierung Ihres Produktes und den entsprechenden Zulassungsweg. Diese haben meist Auswirkungen auf Dauer und Kosten.
Die Kosten umfassen die internen Kosten sowie die Zulassungsgebühr und ggf. die laufenden Kosten für die Aufrechterhaltung der Zulassungen. Die Aufrechterhaltung einer Zulassung kostet häufig mehrere Tausend Euro pro Jahr.
Falls Ihnen Informationen fehlen (z. B. weil diese nicht auf Englisch vorliegen), um die erste Projektplanung abzuschließen, nutzen Sie
- einen lokalen Bevollmächtigten, der auch vor Ort die Kommunikation mit Behörden übernimmt,
- einen Zulassungspartner, der die Registrierung übernimmt,
- ein Beratungsunternehmen, das auf die internationale Zulassung spezialisiert ist,
- die zuständige Behörde. Insbesondere bei Produkten, die neuartige Technologien verwenden, ist eine frühzeitige Abstimmung mit den Behörden vorteilhaft, um das Zulassungsverfahren abzustimmen.
Mit der Checkliste, die weiter unten verlinkt ist, können Sie sicherstellen, dass Sie über alle relevanten Informationen zur Projektplanung verfügen.
Schritt 2: Zulassungspartner auswählen
In vielen Zielländern ist ein lokaler Zulassungspartner vorgeschrieben. Dieser muss beispielsweise die Registrierung und die Zulassung durchführen sowie als Bevollmächtigter mit den Behörden kommunizieren.
Wählen Sie den Zulassungspartner sorgfältig aus, denn Sie begeben sich oft in seine Abhängigkeit, weil die Zulassung in seinem Namen erfolgt.
Optionen
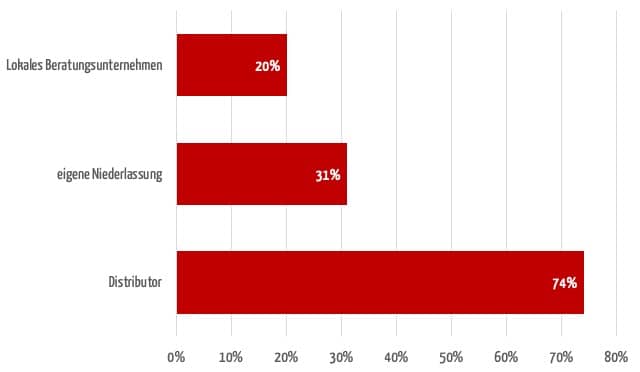
In der Regel bieten sich als Zulassungspartner an ein Vertriebspartner, eine unabhängige Firma oder eine Niederlassung im Zielland.
Bei der Umfrage des Johner Instituts gaben über 70 % an, dass der Vertriebspartner ihr Hauptansprechpartner für Zulassungen sei. Auf Platz zwei folgen eigene Niederlassungen (31 %). 20 % der Firmen arbeiten mit einem unabhängigen Unternehmen zusammen.
Vor- und Nachteile
Die Auswahl der Zulassungspartner hat Vor- und Nachteile:
|
| Vorteile | Nachteile |
| Vertriebspartner | + möglicher Verhandlungsspielraum bei den Zulassungskosten + Einziger Kontakt / Ansprechpartner für Zielland + Vertriebspartner kennt bereits Produkt | – Die Zulassung erfolgt (oft) im Namen des Vertriebspartners. Sie begeben sich somit in dessen Abhängigkeit – Der Repräsentant (hier Ihr Vertriebspartner) darf in einigen Ländern Distributoren benennen. Ihr Vertriebspartner wird dies u. U. nicht tun. – Ein Wechsel des Vertriebspartners erfordert oft eine Neuregistrierung oder eine Registrierungsänderung .– Das Wissen um regulatorische Anforderungen ist möglicherweise begrenzt . |
| Unabhängige Firma | + Vom Vertriebspartner unabhängig sein + Mit Experten zum Thema Medizinproduktezulassung zusammenarbeiten + Vertriebspartner benennen können,, ohne die Zulassung zu ändern | – Möglicherweise höhere Kosten – Sie benötigen zusätzlich einen Vertriebspartner . |
| Eigene Niederlassung | + Selbständige Verwaltung der Zulassungen + Keine zusätzlichen Gebühren für Lizenzhalter + Direkte Kommunikation mit den Behörden. |
– Nachteile im Bezug auf die Zulassung gibt es kaum. Unter Umständen ist die Suche nach qualifizierten Mitarbeitern mit Erfahrung in der Medizinproduktezulassung vor Ort schwierig. |
Entscheidungskriterien
Stellen Sie sich vor der Entscheidung, welcher Zulassungspartner für Sie am besten ist, folgende Fragen:
- Wie aufwendig ist die Änderung des Zulassungspartners? Ist es überhaupt möglich?
- Ist es erlaubt, mehrere Vertriebspartner für ein Produkt zu benennen?
- Wer darf weitere Vertriebspartner benennen?
- Ist es möglich, ein Produkt über mehrere Partner zuzulassen?
Haben Sie bereits einen Wunschpartner, dann prüfen Sie, ob dieser über die notwendigen Voraussetzungen verfügt, um das Produkt zuzulassen. Wichtige Anforderungen hierbei sind:
- Vorhandensein eines Qualitätsmanagementsystems
- Expertise
- Genehmigungen durch die Behörde
- Verlässlichkeit (ggf. durch Referenzen nachweisen lassen)
Vertragsinhalte
Im Vertrag mit Ihrem Zulassungspartner sollten Sie regeln:
- Sie erhalten den vollen Zugriff auf die Zulassungsdokumentation.
- Sie erhalten den Zugriff auf das Zertifikat oder eine Kopie des Zertifikats.
- Pflichten im Rahmen der Marktüberwachung und den Umgang mit Kunden-Feedback
- Initiale und fortlaufende Kosten für die Zulassung, die Kommunikation mit den Behörden, die Rückmeldungen usw.
Ihr Zulassungspartner ist ein Lieferant, den Sie gemäß ISO 13485:2016 bewerten müssen.
Schritt 3: Regulatorischen Rahmen abstecken
Ermitteln Sie nun die detaillierten Anforderungen an Sie als Hersteller und an das konkrete Produkt. Die Vorgaben liegen oft vor als Gesetze, als Guidance-Dokumente, als referenzierte Normen sowie als Hinweise auf den staatlichen Webseiten.
Nutzen Sie ggf. die Hilfe des Zulassungspartners, der Behörden oder eines Beratungsunternehmens.
Landesspezifische Informationen finden Sie auch in unseren weiteren Fachartikeln und unserer Behörden-Übersicht.
Dokumentationsanforderungen
Ermitteln Sie vor allem,
- welche Dokumente Sie bei der Behörde einreichen müssen,
- welche Inhalte diese Dokumente enthalten müssen und
- in welcher Form sowie in welcher Sprache die Einreichung erfolgt.
Beachten Sie, dass nicht alle Länder Englisch akzeptieren. Insbesondere bei den Gebrauchs- und Servicehandbüchern bestehen die Länder meist auf Übersetzungen in die Landessprache.
Nutzen Sie qualifizierte und zertifizierte Übersetzungsdienstleister. Übersetzen Sie kritische Elemente zur Prüfung ggf. wieder zurück ins Deutsche oder Englische. Es kommt regelmäßig vor, dass die Übersetzungen von Einreichungsunterlagen fehlerhaft sind.
Technische Anforderungen für internationale Zulassung
Nicht selten wird die Einhaltung landesspezifischer Normenversionen gefordert. Wenn Sie diese Anforderungen frühzeitig kennen, können Sie die Prüfung dieser Anforderungen, z. B. für die IEC 60601-1, mit Ihrer regulären Prüfung kombinieren.
Einige Länder fordern zudem für bestimmte Produktgruppen zusätzliche Prüfungen. Eine ausführlichere Recherche lohnt sich hinsichtlich der folgenden Punkte:
- Anforderungen an Funkmodule
- Anforderungen an elektronische Produkte
- Neuartige Technologien (z. B. „Anerkennung von klinischen Studien“)
Schritt 4: Dokumentation erstellen
Eine vollständige technische Dokumentation ist die Voraussetzung für eine schnelle und reibungslose Zulassung. Obwohl fast jedes Land eigene Anforderungen stellt, finden sich wiederkehrende Elemente wie
- Nachweise über Ihr Qualitätsmanagementsystem,
- Produktbeschreibung inklusive Varianten,
- eindeutig definierte Zweckbestimmung,
- Ergebnisse der Risikoanalyse,
- Gebrauchsanweisung und Labeling sowie
- Ergebnisse der Produkttests inklusive Software Verifikation und Validierung.
Nutzen Sie international anerkannte Dokumentationsstrukturen wie das STED, das in Form der Common Submission Technical Documentation (CSTD) von den Mitgliedsstaaten der ASEAN angestrebt wird.
Eine Alternative ist das ToC- (Table of Contents-) Format der IMDRF, welches in Kanada und China angestrebt wird. Das ToC-Format deckt auch weite Teile der nach der MDR geforderten technischen Dokumentation ab.
Damit schaffen Sie eine Basis, aus der Sie mit wenig Aufwand die notwendigen Informationen entnehmen können.
Diese Dokumentation reichen Sie bzw. Ihr Zulassungspartner bei der jeweiligen Behörde ein. Ist die Einreichung erfolgreich, erhalten Sie eine Bestätigung z. B. in Form eines Zertifikats.
Prüfen Sie zuerst, ob das Zertifikat korrekt ausgestellt ist und die Angaben zum Hersteller und Produkt stimmen. Ist ein Ablaufdatum genannt, klären Sie, in welchem Format dieses geschrieben ist. Nicht selten werden zuerst der Monat und dann der Tag genannt.
Schritt 5: Zulassung aufrechterhalten
Es gilt das Motto: Nach der Zulassung ist vor der Zulassung. Ermitteln Sie daher, wie viel Zeit Sie für eine Re-Registrierung einplanen müssen.
Zudem erwarten viele Länder eine Aktualisierung der Zulassung bei Produktänderungen. Halten Sie fest, wann Sie eine Änderungsmeldung an die Behörde schicken müssen.
Die Überwachung der Produkte im Markt, die Post-Market Surveillance, stellt in den meisten Ländern eine weitere Voraussetzung dar, um die Zulassung aufrechtzuerhalten. Auch die ISO 13485:2016 verlangt, dass Sie Anforderungen in Ländern überwachen, in denen Sie Ihr Produkt verkaufen.
Ermitteln Sie die Anforderungen an die Meldung von Vorkommnissen und Rückrufen und etablieren Sie – gemeinsam mit Ihren lokalen Partnern – entsprechende Systeme.
Wir sind Ihr zuverlässiger Bevollmächtigter für Medizinprodukte in Europa und der Schweiz, Ihre UK-Responsible Person im Vereinigten Königreich sowie Ihr US Agent in den USA und sichern somit Ihren erfolgreichen Marktzugang.
3. Checkliste „Internationale Zulassung“
Jeder der genannten Schritte bedingt einen Satz an Aktivitäten und Ergebnissen. Die Checkliste zur internationalen Zulassung hilft dabei,
- keine notwendigen Aktivitäten zu übersehen,
- Nachbesserungen und damit Projektverzug zu vermeiden,
- regulatorische Sicherheit zu erhöhen und
- die Planung der internationalen Zulassung zu erleichtern.
4. Fazit
Die internationale Zulassung von Medizinprodukten birgt zahllose Herausforderungen. Aber eine gute Planung hilft, diese Herausforderungen zu erkennen und zu bewältigen.
Viele Märkte sind es wert, dass Sie die Mühen einer internationalen Zulassung auf sich nehmen. Die fünf Schritte und die Checkliste helfen, die Risiken und Aufwände für diese Zulassungen zu beherrschen.
Was sind Ihre Erfahrungen oder die größten Herausforderungen, die Sie meistern mussten? Wir freuen uns, wenn Sie Ihre Erfahrungen zum Markteintritt in neuen Ländern teilen, z. B. im Kommentarfeld oder per E-Mail.
Haben Sie Fragen zum Vorgehen bei internationalen Zulassungen? Das Team vom Johner Institut unterstützen Sie gerne bei jedem Schritt und übernimmt bei Bedarf auch die komplette Zulassung für Sie.
Änderungshistorie
- 2025-04-07: Hinweis in Kapitel 2 ergänzt, Checkliste angepasst
- 2020-09-11: Artikel initial erstellt



