Die Norm ISO 15189 „Medizinische Laboratorien – Anforderungen an die Qualität und Kompetenz“ legt die Anforderungen an ein Qualitätsmanagementsystem für medizinische Labore fest. Labore sind gesetzlich verpflichtet, ein QM-System zu etablieren. Labore, die Inhouse-IVD betreiben, benötigen ein QM-System nach ISO 15189, das um zusätzliche Kapitel erweitert werden muss.
Dieser Artikel
- beschreibt die gesetzlichen Grundlagen,
- verschafft einen raschen Überblick über die ISO 15189 und
- hilft mit Praxistipps, bestehende QM-Systeme möglichst schnell und einfach zu erweitern und damit die regulatorischen Anforderungen der IVDR zu erfüllen.
1. ISO 15189:2022: Die Grundlagen
a) Anwendungsbereich der ISO 15189:2022
Primär ist die ISO 15189 „Medizinische Laboratorien – Anforderungen an die Qualität und Kompetenz“ zur Anwendung in medizinischen Laboratorien vorgesehen. Sie kann aber auch in weiteren Gesundheitseinrichtungen wie Blutbanken und Transfusionsdiensten sowie im wissenschaftlichen Kontext eingesetzt werden.
Mit der aktuellen Version ist die Norm auch im Kontext der patientennahen Tests anwendbar.
Die Inhalte regeln, wie das QM-System in medizinischen Laboren erstellt sowie betrieben wird und wie die Kompetenz des Laborpersonals beurteilt sowie sichergestellt werden soll. Dazu formuliert die Norm Anforderungen an Organisation, Personal, Ausstattung, Prozesse und Qualitätsmanagement.
b) Ziele der Norm
Die Norm zielt darauf ab, die Qualität medizinischer Labore und damit die Patientensicherheit zu erhöhen und das Vertrauen in die Arbeit medizinischer Laboratorien zu stärken.
Zentrale Aspekte sind die Sicherstellung zuverlässiger Untersuchungsergebnisse, der Schutz von Patientendaten und die kontinuierliche Verbesserung der Laborleistungen.
c) Besonderheit und Nutzen der ISO 15189
Im Gegensatz zu Normen wie ISO 9001 oder ISO 17025 ist die ISO 15189 speziell auf die Anforderungen medizinischer Laboratorien zugeschnitten.
Die Norm bestätigt die spezifische Kompetenz bei medizinischen Tests und berücksichtigt ethische Aspekte sowie Patientensicherheit.
Im Gegensatz zur ISO 17025, die für allgemeine Prüf- und Kalibrierlabore gilt, fokussiert sich die ISO 15189 auf die besonderen Bedürfnisse medizinischer Labore, einschließlich prä- und postanalytischer Prozesse.
Die Umsetzung der ISO 15189 führt oft zur Optimierung von Laborprozessen, spart Ressourcen und minimiert Fehlerrisiken. Dies stärkt das Vertrauen von Patienten, medizinischem Personal und Behörden in die Laborleistungen und kann einen wesentlichen Wettbewerbsvorteil darstellen.
d) Aufbau der aktuellen Version
Die ISO 15189 versteht sich selbst nicht als reine Qualitätsmanagementsystem-Norm, auch wenn sie oft so bezeichnet wird. Die Inhalte gehen deutlich über die eines klassischen QMS hinaus. Das eigentliche QM-System wird in Abschnitt 8 „Anforderungen an das Managementsystem” beschrieben.
In Abschnitt 3 „Begriffe“ der Norm ISO 15189 ist in der aktuellen Version nur noch von Managementsystemen und nicht mehr vom Qualitätsmanagementsystem die Rede. Es ist ergänzt, dass beide Begriffe synonym zu verwenden sind.
Die Norm definiert im Abschnitt 3.18 Managementsystem entsprechend als „Satz zusammenhängender oder sich gegenseitig beeinflussender Elemente einer Organisation, um Politiken, Ziele und Prozesse zum Erreichen dieser Ziele festzulegen“.
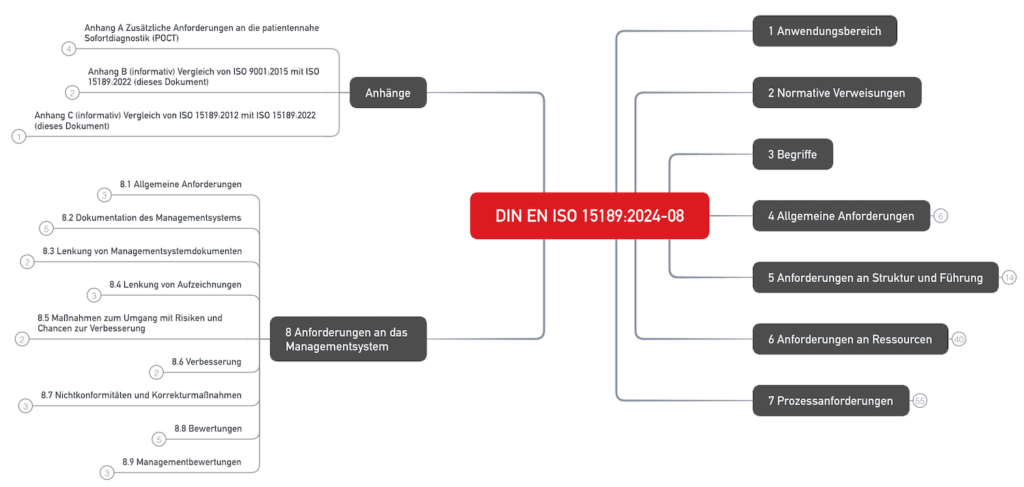
Die normativen Anforderungen finden sich in fünf Abschnitten und im Anhang A:
- Abschnitt 4: Allgemeine Anforderungen
- Abschnitt 5: Anforderungen an Struktur und Führung
- Abschnitt 6: Anforderungen an Ressourcen
- Abschnitt 7: Prozessanforderungen
- Abschnitt 8: Anforderungen an das Managementsystem
- Anhang A (normativ): Zusätzliche Anforderungen an die patientennahe Sofortdiagnostik (POCT)
e) Neuerungen der ISO 15189:2022 im Vergleich zur Vorgängerin
Nach den Versionen von 2003, 2007 und 2012 ist die ISO 15189:2022 die vierte und derzeit aktuelle Hauptversion der Norm (die bei Erstellung dieses Artikels aktuelle deutsche Unterversion ist die DIN EN ISO 15189:2024-08). Die Änderungen zur Vorversion fielen moderat aus und bezogen sich hauptsächlich auf die Kapitelstruktur der Norm.
Melden Sie sich (z. B. über unsere Kontaktseite), damit wir Ihnen kostenlos das Mapping der Versionen schicken können. Das erleichtert Ihnen die Gap-Analyse.
Weitere Anpassungen betreffen den deutlich größeren Fokus auf das Risikomanagement. So referenziert die Norm mehrfach die ISO 22367 „Medizinische Laboratorien – Anwendung des Risikomanagements auf medizinische Laboratorien“.
f) Ersetzung der ISO 22870:2026
Die Version ISO 15189:2022 ersetzt zudem die Norm ISO 22870:2016, die ersatzlos gestrichen wurde. Inhalte aus ISO 22870 sind im Anhang A „Zusätzliche Anforderungen an die patientennahe Sofortdiagnostik (POCT)” zu finden.
In unserem Grundlagenseminar ISO 15189:2022 lernen Sie die Anforderungen der neuen ISO 15189:2022 an die Qualität und Kompetenz in Ihrer Gesundheitseinrichtung bzw. Ihrem Labor kennen und umzusetzen.
2. Gesetzliche Anforderungen an QM-Systeme medizinischer Laboratorien
Mehrere Gesetze und Verordnungen legen Anforderungen an medizinische Labore fest. Diese sind überlappend, haben aber teilweise einen unterschiedlichen Fokus, der von der Rolle und den Funktionen des Labors abhängt.
a) Anforderung an alle diagnostischen Labore in Deutschland
Die Medizinprodukte-Betreiberverordnung (MPBetreibV) fordert als Minimalanforderung an ein QMS von den Laboren die Einhaltung der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK).
Anforderungen der MPBetreibV an das QMS:
Wer laboratoriumsmedizinische Untersuchungen durchführt, hat vor Aufnahme dieser Tätigkeit ein Qualitätssicherungssystem nach dem Stand der medizinischen Wissenschaft und Technik zur Aufrechterhaltung der
erforderlichen Qualität, Sicherheit und Leistung bei der Benutzung von In-vitro-Diagnostika sowie zur Sicherstellung der Zuverlässigkeit der damit erzielten Ergebnisse einzurichten. Eine ordnungsgemäße Qualitätssicherung nach Satz 1 wird vermutet, wenn die Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen in der Fassung vom 30. Mai 2023 (Deutsches Ärzteblatt vom 30. Mai 2023, DOI: 10.3238/arztebl.2023.rili_baek_QS_Labor) beachtet wird.
b) Anforderungen an Krankenhäuser in Deutschland
Das Sozialgesetzbuch Fünftes Buch (SGB V) enthält Vorgaben für ein QMS, die sich u. a. an Ärztinnen und Ärzte, Versorgungszentren und Krankenhäuser richten. Diese werden durch den gemeinsamen Bundesausschuss präzisiert.
Anforderungen des SGB V an das QMS:
Vertragsärzte, medizinische Versorgungszentren, zugelassene Krankenhäuser, Erbringer von Vorsorgeleistungen […] sind nach Maßgabe der §§ 136 bis 136b und 137d verpflichtet,
1. sich an einrichtungsübergreifenden Maßnahmen der Qualitätssicherung zu beteiligen, die insbesondere zum Ziel haben, die Ergebnisqualität zu verbessern und
2. einrichtungsintern ein Qualitätsmanagement einzuführen und weiterzuentwickeln, wozu in Krankenhäusern auch die Verpflichtung zur Durchführung eines patientenorientierten Beschwerdemanagements gehört.
c) Anforderungen an Labore mit Inhouse-IVD
Anforderungen der IVDR
Mit der Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR) wurden 2017 europaweit einheitliche Regeln für den Betrieb von Inhouse-IVD eingeführt. Diese beinhalten auch strenge Anforderungen an das QMS, die nach Ablauf der Übergangsfristen seit 26. Mai 2024 zu erfüllen sind.
Anforderungen der IVDR an das QMS:
b) die Herstellung und die Verwendung der Produkte erfolgen im Rahmen geeigneter Qualitätsmanagementsysteme;
c) das Labor der Gesundheitseinrichtung entspricht der Norm EN ISO 15189 oder gegebenenfalls nationalen Vorschriften einschließlich nationaler Akkreditierungsvorschriften;
Auch aus dem weiteren Inhalt von IVDR, Artikel 5(5), lassen sich Rückschlüsse auf das geforderte QMS ziehen.
Die IVDR fordert in Artikel 5(5) ein QMS nach ISO 15189, aber keine Akkreditierung nach dieser Norm. Obwohl eine Akkreditierung viele Vorteile mit sich bringt, sollte zuvor die Einhaltung der Anforderungen der Norm, der IVDR sowie der nationalen Gesetzgebung im Fokus stehen. Die Akkreditierung kann im Anschluss jederzeit nachgezogen werden.
Anforderungen der MDCG
Das Dokument „Guidance on the health institution exemption under Article 5(5) of Regulation (EU) 2017/745 and Regulation (EU) 2017/746“ der Medical Device Coordination Group MDCG 2023-1 interpretiert den Artikel 5(5) der IVDR. Es liefert viel Text zum Thema QMS, lässt sich aber in wenigen Worten zusammenfassen: Das QMS sollte so gestaltet sein, dass es die Anforderungen aus Artikel 5(5) und auch des Anhang I der IVDR abdeckt.
Insbesondere aus einem Satz des MDCG 2023-1 geht klar hervor, warum es in Artikel 5(5) mit den Punkten b) und c) zwei getrennte Anforderungen an das QMS gibt.
However, as the manufacturing process of a device and the compliance to the relevant requirements of Annex I is not in the scope of this standard, compliance with EN ISO 15189 alone does not constitute an appropriate QMS for the manufacture of in-house IVDs.
Und damit haben die Autoren recht. Die ISO 15189 (sowie die Rili-BÄK) beinhaltet kein Kapitel zur Entwicklung von Inhouse-IVD-Produkten. Klassische Outputs eines entsprechenden Teils des QMS sind aber in Artikel 5(5) und Anhang I der IVDR gefordert. Entsprechend muss das ISO 15189-System erweitert werden.
Die MDCG verweist darauf, möglichst harmonisierte ISO-Normen zu verwenden, um ein geeignetes QMS zu implementieren. Hierfür kommt derzeit einzig die ISO 13485 „Medizinprodukte – Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke“ infrage.
Schlussfolgerungen
Demnach lässt sich aus den Inhalten der IVDR und der MDCG schließen, dass ein QMS für diagnostische Labore auf folgende Weise aufgebaut sein sollte:
- Vollständiges QMS nach ISO 15189 (bzw. Rili-BÄK)
- Verfahren zu Entwicklung, Herstellung und Änderung von Inhouse-IVD (z. B. entsprechend ISO 13485, Kapitel 7)
- Verfahren zur Überwachung der Produkte
- Verfahren zum Vorgehen bei Vorkommnissen
- Verfahren zur Beschaffung von Informationen über gleichartige CE-gekennzeichnete Produkte, die auf dem Markt verfügbar sind (Äquivalenzanalyse)
Auch die in der ISO 15189 mehrfach erwähnte Risikomanagement-Norm ISO 22367 fordert für die Entwicklung von Inhouse-IVD die Berücksichtigung von ISO 13485, 7.3.
Mehr zu den Anforderungen der IVDR an Labore mit Inhouse-IVD erfahren Sie in diesem Fachartikel.
Die neue Norm ISO 5649 „Medical laboratories – Concepts and specifications for the design, development, implementation and use of laboratory-developed tests“ beschreibt einen möglichen Entwicklungsprozess für Inhouse-IVD.
Im Seminar IVDR für medizinische Labore erwerben Sie die Grundlagen, um die IVDR-Anforderungen an Inhouse-IVD genaustens zu verstehen und daraus abzuleiten, was in welcher Reihenfolge zu tun ist.
3. Qualitätsmanagement-Standards für Labore
Medizinische Labore haben teilweise verschiedene QM-Systeme implementiert. Die Entscheidung für ein System ist u. a. abhängig von nationalen Vorgaben, dem Tätigkeitsfeld und auch dem Alter der Gesundheitseinrichtung.
a) Rili-BÄK Teil A
Der erste Teil der Richtlinie der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen (Rili-BÄK) „legt grundsätzliche Anforderungen an das Qualitätsmanagement und die Qualitätssicherung laboratoriumsmedizinischer Untersuchungen in der Heilkunde fest“ (Rili-BÄK Teil A 1). Die Einhaltung der Rili-BÄK ist in Deutschland eine gesetzliche Anforderung an diagnostische Labore und wird von den Landesbehörden überprüft.
b) ISO 15189
Die Norm ISO 15189 „Medizinische Laboratorien – Anforderungen an die Qualität und Kompetenz“ legt, wie der Titel schon sagt, die Anforderungen an Qualität und Kompetenz in medizinischen Laboratorien fest. Bei Erfüllung aller Anforderungen können Labore davon ausgehen, dass sie damit auch die Anforderungen der Rili-BÄK einhalten, denn beide Dokumente sind inhaltlich sehr ähnlich. Die ISO 15189 ist aber präziser in der Ausformulierung der Anforderungen.
c) ISO 9001
Manche Labore haben ein QMS nach ISO 9001 „Qualitätsmanagementsysteme – Anforderungen“ eingerichtet und auch zertifizieren lassen. Diese „Mutter der QM-Systeme“ ist sehr allgemein gehalten und nicht laborspezifisch. Im Vergleich zur ISO 15189 deckt solch ein System nicht alle Anforderungen der Rili-BÄK ab.
d) ISO/IEC 17025
Einige Labore sind auch nach ISO 17025 „Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien“ akkreditiert. Diese Norm existiert seit 1999 und insbesondere ihr direkter Vorgänger, der ISO Guide 25, ist viel älter als die ISO 15189. Dies ist wahrscheinlich der Grund, warum noch so viele Labore nach ISO 17025 akkreditiert sind. Dennoch ändert sich das derzeit; Labore schwenken zur ISO 15189 um und folgen damit der Empfehlung der European Accreditation.
e) ISO/IEC 17020
Derzeit noch Standard in der Pathologie ist die ISO 17020 „Konformitätsbewertung – Anforderungen an den Betrieb verschiedener Typen von Stellen, die Inspektionen durchführen“. Ebenso wie bei den nach ISO 17025 akkreditierten Laboren ist davon auszugehen, dass über die anstehenden Jahre mehr und mehr Labore zur ISO 15189 übergehen werden.
4. Praxistipps
Tipp 1: In fünf Schritten vorgehen
- Schritt: Bei zur ISO 15189 abweichenden Systemen (ISO 17025, ISO 9001 etc.):
- Gap-Analyse zur ISO 15189:2022
- Lücken schließen
- Überflüssige Prozesse eliminieren
- Schritt: Vorgabedokumente zur Überwachung der Laboranalysen und zum Vorgehen bei Vorkommnissen erstellen
- Schritt: Risikomanagement auf Vorgaben der ISO 22367 anpassen
- Schritt: Geeigneten Entwicklungsprozess entsprechend ISO 13485, Abschnitt 7 einführen
- Schritt: Ggf. Akkreditierung
Tipp 2: Fokus auf eine Norm legen
Konzentrieren Sie sich auf die ISO 15189, anstatt integrierte Systeme aus z. B. ISO 9001 und ISO 17025 zu nutzen. Eine Zertifizierung nach ISO 9001 ist überflüssig und hat kaum noch Aussagekraft.
Tipp 3: Die (richtigen) Personen einbinden
Hören Sie auf das Feedback Ihrer Mitarbeitenden, die täglich die Prozesse durchführen. Diese wissen genau, welche Informationen sie brauchen und insbesondere, welche man nicht benötigt.
Überlassen Sie die Überarbeitung des QMS nicht einer Person. z. B. dem QMB: Nur die Prozesseigner selbst sind in der Lage, ihre Prozesse adäquat zu beschreiben und Risikomanagement dafür zu betreiben.
Tipp 4: QM-System entschlacken
Eliminieren Sie überflüssige Dokumente und Inhalte: Regulatorisch nicht geforderte Inhalte, die auch nicht zur Risikominimierung beitragen, haben im QM-System keine Daseinsberechtigung.
Es ist auch oft nicht notwendig, den kompletten Abschnitt 7 der ISO 13485 zu implementieren. Die Prozesse sollten auf die derzeitigen und zukünftig geplanten Inhouse-IVD zugeschnitten sein.
5. Zusammenfassung und Fazit
a) Zusammenfassung
Für medizinische Labore gibt es verschiedene Vorlagen, auf die Sie bei der Erstellung eines QMS zurückgreifen sollten. Die Mindestanforderung ist gesetzlich vorgegeben und wird durch Einhaltung der Rili-BÄK Teil A erfüllt.
Nahezu alle medizinischen Labore nutzen auch Inhouse-IVD für ihre Analysen. Somit sind die Anforderungen der IVDR einzuhalten. Diese umfassen die Implementierung eines QMS nach ISO 15189, das um zusätzliche Inhalte aus der ISO 13485 erweitert werden muss.
b) Fazit
Die Forderung der IVDR nach dem erweiterten System basierend auf ISO 15189 führt dazu, dass sich immer mehr Labore nach dieser Norm richten und andere QM-Normen im Labor-Bereich weniger präsent sein werden.
Die geforderte Erweiterung des Systems um Prozesse zur Entwicklung, Herstellung, Änderung und Überwachung kann zu Überforderung führen. Daher sollten Labore das richtige Maß finden, um einerseits die strengen Anforderungen der IVDR zu erfüllen und andererseits Flexibilität und Effizienz im Laboralltag zu wahren.
Das Team des Johner Instituts hilft medizinischen Laboren bei der Implementierung oder gesetzlich geforderten Erweiterung ihres QMS. Dabei achtet es darauf, dass das QM-System schlank und lebbar bleibt und bei der täglichen Routine unterstützt.
Mit seinen Seminaren, Workshops und digitalen Produkten hat das Johner Institut für jede und jeden die passende Unterstützung parat, um Labore auf ihrem Weg zu einem effizienteren Arbeitsalltag zu begleiten:
- Grundlagenseminar ISO 15189:2022
- Seminar „Regulatorische Anforderungen an den Laborbetrieb“
- Grundlagenseminar „IVDR für medizinische Labore“
- Seminar „Interner Auditor“
- Regulatory Radar
- Johner Academy
- Auditgarant




Vielen Dank, für den Übersichtsartikel zur medizinischen Laborwelt. Ich möchte hierzu nur gerne noch einige Präzisierungen ergänzen:
Da Deutschland in Sache Akkreditieren von Pathologischen Untersuchungen ein gallisches Dorf ist, ist nicht damit zu rechnen, dass sich hier die 15189 als Akkreditierungsnorm durchsetzen wird. Es wird von mehreren Seiten her weiterhin forciert, dies nach 17020 weiterhin zu akkreditieren. Ebenso auch Untersuchungen der Molekularpathologie, diese bekommt man nicht nach 15189 akkreditiert. Da gibt es sehr detaillierte Vorgaben innerhalb der DAkkS, die sich vor allem auf das Untersuchungsmaterial fixieren.
Es ist korrekt, dass derzeit keine Akkreditieren nach ISO 15189 in der medizinischen Laoratoriumsdiagnostik pauschal vorgeschrieben ist. Es gibt aber durchaus Bereiche, die aus anderen gesetzlichen Vorgaben eine Akkreditierungspflicht haben, dies betrifft z.B. Abstammungsuntersuchungen oder Neugeborenenscreening.
Herzliche Grüße
Dr. Nina Rählert
Liebe Frau Rählert,
herzlichen Dank für Ihren Beitrag und den Blick aus Ihrer Position.
Bezüglich der Pathologen und der ISO 17020 war wohl auch ein Bisschen der Wunsch der Vater des Gedanken. Ich habe die Hoffnung an die DAkkS noch nicht aufgegeben, dass sie sich von einem Behörden-ähnlichen Charakter zu einem service-orientierten Unternehmen verwandelt in dem pragmatisch im Sinne der Patienten gehandelt wird.
Genau, das Gendiagnostikgesetz fordert in § 5 eine Akkreditierung des Labors für genetische Abstammungsuntersuchungen. Dort wird aber keine Norm referenziert. Für das Neugeborenenscreening kenne ich keinen vergleichbaren Paragraphen.
Liebe Grüße,
Ulrich Hafen