Die Normenfamilie EN ISO 18562-Serie trägt den Titel „Beurteilung der Biokompatibilität der Atemgaswege bei medizinischen Anwendungen“. Sie besteht aus vier Teilen, die seit 2020 unter den EU-Richtlinien harmonisiert sind.
Dieser Artikel hilft Ihnen bei der Umsetzung dieser Normen, z. B. wenn Sie feststellen möchten, welche Tests Sie für Ihr Medizinprodukt tatsächlich benötigen. Mit den hier gegebenen Informationen und Tipps wird es Ihnen gelingen, unnötige Aufwände und regulatorische Risiken zu minimieren und viele Probleme zu vermeiden, die in der Praxis regelmäßig auftreten.
1. Probleme bei der Umsetzung der EN ISO 18562
In der Praxis treten regelmäßig Probleme bei der Umsetzung der Normenfamilie EN ISO 18562 auf:
- Vielen Herstellern ist diese Normenfamilie noch immer unbekannt. Andere wissen nicht, wann diese Norm anwendbar ist und wie sie sich von der ISO 10993 abgrenzt.
- Die neuen Ansätze zur Freisetzungskinetik, insbesondere der TTC/AET-Ansatz, erfordern teils komplexe Testdesigns.
- Die Prüfungen sind (auch deshalb) oft sehr kostenintensiv.
- Nur wenige Labore bieten die zugehörigen Prüfungen an.
- Die Anwendbarkeit der Norm ist nicht immer eindeutig.
Dieser Artikel gibt Hinweise, wie Sie diese Probleme vermeiden können.
2. Anwendungsbereich der EN ISO 18562
a) Abgrenzung zur Normenfamilie EN ISO 10993
Für Medizinprodukte mit direktem Patientenkontakt ist die EN ISO 10993-Reihe „Biological evaluation of medical devices“ heranzuziehen, um die Biokompatibilität zu beurteilen.
Haben Medizinprodukte allerdings keinen direkten oder flüssigkeitsvermittelten Patientenkontakt, so ist die EN ISO 10993 nicht anwendbar. Dies ist zum Beispiel bei Medizinprodukten mit gasvermitteltem Kontakt zu den Atemwegen der Fall.
Die EN ISO 10993-1 verweist hier auf die produktspezifische Norm.
„For gas pathway device components with only indirect contact, device specific standards should be used to determine the relevant type of biocompatibility evaluations [see ISO 18562 (all parts)].“
EN ISO 10993-1, 5.1
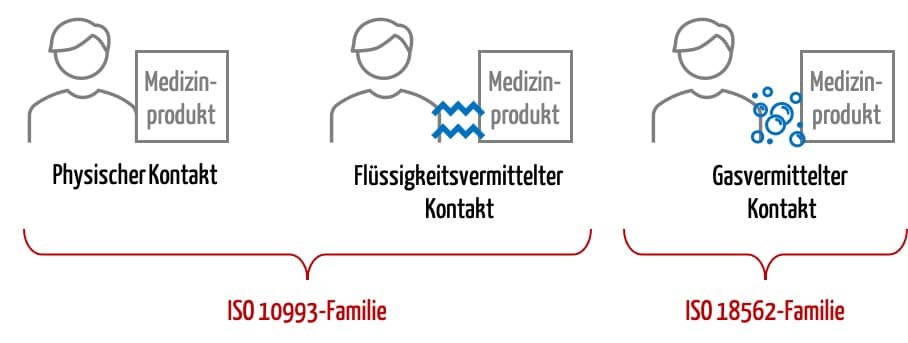
Ob die EN ISO 18562 Serie für Ihr Produkt gilt, können Sie anhand der folgenden Definition leicht ableiten:
b) Beispiele
Um zusätzlich Klarheit zu schaffen, nennt die EN ISO 18562-1 mehrere Produktbeispiele für den Gültigkeitsbereich der Norm:
- Therapeutische Medizinprodukte
- Ventilators
- Respiratory gas monitors
- Anesthesia workstations
- Incubators
- Aufbereitung von Gasen
- Nebulisers
- Humidifiers
- Breathing system filters
- Oxygen concentrators
- Weiterleitung von Gasen
- Y-pieces
- Breathing tubes
- Masks
- Oxygen conservation equipment
- Low-pressure hoses
c) Weitere Hilfestellungen
Trotz der Definition und der Beispiele sind sich Hersteller und Benannte Stellen nicht immer einig. Das Johner Institut empfiehlt daher folgende Faustformel:
Die ISO 18562 ist unabhängig von der Größe des Medizinprodukts anwendbar, wenn der Patient durch dieses Produkt Luft bzw. Gas aktiv einatmet.
Ist die EN ISO 18562 für Ihr Medizinprodukt anwendbar und liegt ebenfalls direkter Patientenkontakt mit dem Produkt vor, so ist unter Umständen zusätzlich die EN ISO 10993 zu berücksichtigen. Aber mit etwas Glück lassen sich die Prüfergebnisse der einen Norm auf die andere übertragen. Wie das geht, lesen Sie weiter unten im Artikel.
3. Die Normenfamilie EN ISO 18562
a) Überblick
Die Normenreihe trägt den Titel „Beurteilung der Biokompatibilität der Atemgaswege bei medizinischen Anwendungen“. Sie besteht aus vier Teilen.
Der erste Teil ist als übergeordneter, rahmenbildender Teil zu verstehen und immer anzuwenden.
Die Teile 2 bis 4 beschäftigen sich mit spezifischen Fragestellungen und sind nicht für jedes Medizinprodukt anwendbar, das in den Anwendungsbereich der ISO 18562 fällt.
|
Norm |
Titel |
Anwendbar |
|
ISO 18562-1 |
Beurteilung und Prüfung innerhalb eines Risikomanagementprozesses | Immer; allgemeine Ausführungen |
|
ISO 18562-2 | Prüfung für Emissionen von Partikeln | Bei möglichen Schwebstoffen, z. B. durch Produktbewegungen |
|
ISO 18562-3 |
Prüfungen für Emissionen von flüchtigen organischen Verbindungen (VOCs) | Bei möglichen volatilen Substanzen, z. B. bestimmten Kunststoffen |
|
ISO 18562-4 |
Prüfungen für herauslösbare Substanzen in Kondensaten |
Bei möglichen Kondensaten, die zum Patienten fließen können |
Genau wie die neue EN ISO 10993-1 gibt auch die EN ISO 18562 der Materialcharakterisierung und den In-vitro-Tests absoluten Vorrang vor Tierversuchen. Dies ist ein weiterer konkreter Meilenstein in der tierversuchsfreien Prüfung von Medizinprodukten.
Das Johner Institut geht davon aus, dass die Normen zukünftig dieser Prüfstrategie verstärkt folgen werden.
Sie können die Normen der Reihe EN ISO 18562 z. B. beim Beuth-Verlag erwerben.
b) EN ISO 18562-1: Beurteilung und Prüfung innerhalb eines Risikomanagement-Prozesses
Die EN ISO 18562-1 beschreibt v. a. die Einbindung des Risikomanagementprozesses bei der Planung und Bewertung der Biokompatibilität. Dieser Prozess sollte konform der EN ISO 14971 erfolgen. Die ISO 14971 und der TR ISO 24971 geben Hinweise zur Risiko-Nutzen-Bewertung.
Dieser erste Teil der Normenfamilie EN ISO 18562
- vermittelt grundlegende Anforderungen,
- gibt eine Übersicht über die anderen Teile der Reihe,
- definiert die Begriffe,
- stellt eine Anleitung zur Testauswahl bereit und
- liefert eine Anleitung zur Planung und Bewertung der Biokompatibilität sowie
- detaillierte Angaben zum Umgang mit Freisetzungsprodukten.
Zur Beurteilung der Biokompatibilität sind laut ISO 18562-1 unter anderem folgende Punkte zu berücksichtigen:
- Werkstoffe
- Additive
- Prozessverunreinigungen/-rückstände
- Während des Gebrauchs freigesetzte Stoffe
- Zersetzungsprodukte und Wechselwirkungen der Materialien
Diese Anforderungen verdeutlichen noch einmal, dass eine Beurteilung der Biokompatibilität allein auf Material- und Datenblattbasis nicht zielführend und in aller Regel sogar unmöglich ist.
Ebenso fordert die EN ISO 18562 die Berücksichtigung des Einflusses aller Aufbereitungsschritte bei wiederverwendbaren Medizinprodukten. Diese Forderung stellen auch MDR und EN ISO 10993.
Folgende Beiträge helfen Ihnen,
- zu verstehen, weshalb die Biokompatibilität ausschließlich auf Basis von Materialien und Datenblättern nur schwer nachzuweisen ist und
- die richtigen Aufbereitungsschritte bei wiederverwendbaren Medizinprodukten zu wählen.
c) EN ISO 18562-2: Prüfungen für Emissionen von Teilchen
Die EN ISO 18562-2 enthält konkrete und umfangreiche Hinweise zur Prüfung auf Schwebstoffe. Ob dieser zweite Teil für Ihr Produkt anwendbar ist, können Sie direkt aus den Vorgaben der Norm entnehmen:
„A simple component such as a connector with minimal area exposed to the patient breathing gas stream is very unlikely to need testing for particulate matter, while a mechanical medical device with moving parts such as a ventilator could well require thorough testing.“
EN ISO 18564-2, 5.2
Bei der Emission von Teilchen (Partikeln) sind hier prinzipiell keine Verunreinigungen aus der Produktion gemeint, sondern Partikel, die durch den Betrieb des Medizinprodukts selbst (seiner Teile oder Zubehör) entstehen und in den Gasstrom eingebracht werden können.
Trifft dies zu, so sind alle Partikel zwischen 0,2 und 10 µg zu quantifizieren. Die spezifischen Grenzwerte legt die Norm nach Partikelgröße fest:
|
Teilchengröße [µm] |
Maximale Anzahl von Teilchen [µg/m3] |
|
< 0,2 |
Norm nicht anwendbar (Nanopartikel) |
|
0,2 bis 2,5 |
12 |
|
2,5 bis 10 |
150 |
|
> 10 |
Norm nicht anwendbar |
Partikel mit Abmessungen unter 0,2 µm sind als Nanopartikel zu betrachten. Für diese gilt die Norm nicht; hier können Sie sich an der ISO/TR 10993-22 „Guidance on nanomaterials“ orientieren.
d) EN ISO 18562-3: Prüfungen für Emissionen von flüchtigen organischen Verbindungen (VOC)
Anwendungsgebiet
Für Medizinprodukte, welche über Atemgase Kontakt zum Patienten haben, spielt die Freisetzung von flüchtigen Substanzen ins Gas eine wichtige Rolle.
Es ist gut nachvollziehbar, dass größere Mengen an flüchtigen Substanzen (z. B. Lösungsmittel) dem Patienten Schaden zufügen können. Daher ist es wichtig, eine Freisetzung von flüchtigen Substanzen auszuschließen bzw. deren Menge zu belegen.
Man unterscheidet bei diesen flüchtigen Substanzen:
- VOC: leicht flüchtige Verbindungen
- VVOC: sehr leicht flüchtige Verbindungen
Offiziell fordert die EN ISO 18562-3 nur den Nachweis von möglichen VOC.
Doch Achtung:
Einige ZUSTÄNDIGE STELLEN fordern die Bewertung der SVOC- und VVOC-Emissionen.“
EN ISO 18562-1, 5.3
Anforderungen
Für viele Substanzen gibt es toxikologische Grenzwerte, die bei der Beurteilung von freigesetzten flüchtigen Substanzen helfen.
Über den sogenannten TTC-Ansatz (Treshold of Toxicological Concern) ist sicherzustellen, dass Substanzen bis zu einer gewissen Menge mit den durchgeführten Analysen überhaupt erfassbar sind und auch erfasst werden.
So können Sie sicherstellen, dass analytisch nicht mehr erfassbare Mengen einer unbekannten Substanz (weil zu gering) kein toxikologisches Risiko mehr darstellen.
Da aber auch geringere Mengen einer kritischen Substanz über einen längeren Zeitraum hinweg Probleme bereiten können, sinkt der TTC über die Kontaktdauer kontinuierlich ab. Somit kann man vereinfacht sagen:
Eine größere Menge an freigesetzten Substanzen ist über kurze Zeit genauso kritisch zu sehen wie eine sehr geringe Menge, die über einen langen Zeitraum in den Patienten gelangt.
Je nach Material und volatilen Substanzen, kann der angesetzte TTC aber zu hoch sein, um eine verlässliche toxikologische Aussage treffen zu können.
Halten Sie daher die Bestimmungsgrenzen so gering wie möglich und schauen Sie sich grundsätzlich alle freigesetzten Substanzen an.
| Einwirkungsdauer (exposure duration) in Tagen (d) | TTC [µg/d] |
|
≤ 1 |
360 |
| 1–30 |
120 |
|
> 30 |
40 |
Der Prüfaufbau und die Testmusterauswahl sind maßgeblich entscheidend für einen erfolgreichen Test. Sie gewährleisten, dass Ihr Medizinprodukt weder unterbewertet noch unnötig überbewertet wird. Prüfen Sie die VVOC am besten immer gleich mit. Je nach Labor entstehen keine zusätzlichen Kosten, und Sie schließen alle fachlichen Lücken zu Fragestellungen bzgl. flüchtiger Substanzen.
e) EN ISO 18562-4: Prüfungen für herauslösbare Substanzen in Kondensaten
Falls sich in den Gaswegen Kondensate bilden und zum Patienten zurückfließen können, ist es nötig, die Kondensate auf mögliche „Leachables“ hin zu untersuchen. Hierfür können Kondensate entweder entnommen oder (durch Extraktion) selbst produziert werden.
Neben den organischen Bestandteilen sind die Kondensate (je nach Material) auch auf mögliche anorganische Substanzen hin zu untersuchen (Prüfung z. B. nach USP <233>). Betroffen sind alle Komponenten, die mit Kondensat in Berührung kommen können.
In diesem Fall müssen Sie ebenso einen Zytotoxizitätstest nach EN ISO 10993-5 durchführen. Zudem sollten Sie unbedingt auf die optimale Laborauswahl achten, um falsch negative Ergebnisse zu vermeiden.
Die Norm schlägt vor, Kondensate auf sensibilisierende Substanzen nach ISO 10993-10 zu prüfen. Werden Substanzen detektiert, können daher neben der EN ISO 18562 auch die Vorgaben und Hilfestellungen der EN ISO 10993-18/-17 herangezogen werden, z. B. zur Berechnung der „Margin of Safety“.
„Only sections of the gas pathway from which the patient can be exposed to condensate need be tested.“
EN ISO 18562-1, 5.4
4. Sechs Tipps zur Minimierung von Kosten und Aufwänden
Die nachfolgenden Tipps können Ihnen helfen, die Prüfkosten und den Gesamtaufwand zu reduzieren. Aufgrund der fachlichen Komplexität haben wir diese sehr prägnant formuliert. Wenn Sie tiefer einsteigen wollen, dann kontaktieren Sie uns einfach.
Tipp 1: Nehmen Sie eine Worst-Case-Auswahl vor
Sie müssen nicht die komplette Produktpalette prüfen. Nutzen Sie für die Auswahl kritischer Produkte folgende Eigenschaften:
- Materialien
- Materialverhältnisse
- Absolute Oberflächengrößen
- Kleber
- Geometrie
Allerdings zeigt die Erfahrung, dass es meist mehrere Worst-Case-Produkte gibt. Berücksichtigen Sie auch alle Worst-Case-Parameter für den Testaufbau. So ist zum Beispiel für die Tests auf VOC’s die maximale Umgebungstemperatur einzusetzen.
Tipp 2: Nutzen Sie die Ergebnisse anderer Tests
Wenn Ihnen Prüfergebnisse aus der Endreinigung, von der EN ISO 10993 oder Testdaten vom Lieferanten vorliegen, können Sie mit etwas Glück diese Ergebnisse übertragen.
Gerade die Prüfungen auf flüchtige Substanzen und Fragestellungen zu Extractables (gelöste Substanzen in Kondensaten) sind häufig bereits fachlich durch Prüfungen zur ISO 10993-18 abgedeckt. Vor allem dann, wenn Sie die Komponente bereits wegen ihres direkten Patientenkontakts geprüft haben.
Auch aus der Prüfung anderer Produkte Ihres Portfolios können Sie womöglich ausreichende Schlüsse auf Ihr aktuelles Produkt ziehen. Es lohnt sich auf jeden Fall, hier genau hinzusehen.
„If the medical device under evaluation has already been evaluated as tissue contacting according to ISO 10993-1, then leachable substances tests need not be performed in addition.“
EN ISO 18562-1, 5.4
Tipp 3: Nutzen Sie Typprüfungen
Ist es schwierig, das Endprodukt zu prüfen? Dann nutzen Sie Typprüfungen. Komplizierte Prüfdesigns treiben die Prüfkosten unnötig hoch.
Tipp 4: Vermeiden Sie Änderungen
Versuchen Sie, unnötige Änderungen am Produkt und dem Herstellungsprozess möglichst zu vermeiden. Wenn Änderungen zu einem der folgenden Punkte auftreten, so müssen Sie die Biokompatibilität erneut bewerten:
- Rezeptur
- Farbe
- Aufbereitung
- Bestimmungsgemäßer Gebrauch
- Lieferant
- Herstellung
- Kleber
Tipp 5: Überwachen Sie die Prüfergebnisse
Viele Hersteller haben mit diesen „neuen“ Prüfungen wenig Erfahrung. Das betrifft insbesondere die Einschätzung
- der Plausibilität freigesetzter Substanzen und Mengen sowie
- der toxikologischen Auswirkungen, wenn diese Stoffe detektiert werden.
Überwachen Sie Ihre Prüfergebnisse von Beginn an sowohl materialbezogen als auch produktbezogen. Plausibilitätschecks und Einschätzungen von Mengen freigesetzter Substanzen über eine Prüfhistorie sind bares Geld wert und ersparen Ihnen in nennenswertem Umfang Prüfkosten.
Tipp 6: Bereiten Sie sich auf unklare Forderungen von Benannten Stellen vor
Wir haben leider mehrfach beobachtet, dass manche Benannten Stellen nicht einheitlich mit den Vorgaben zur EN ISO 18562 umgehen, selbst bei gleichen Produkten. Das ist zwar bedauerlich, aber nachvollziehbar, da es viele Sonderfälle gibt, die Raum zur Interpretation geben.
Seien Sie daher gefasst auch auf Forderungen in Bezug auf Kapitel 4.5 der EN ISO 18562-1:
- Ozon für Gaswege in Kontakt mit aktiven elektromechanischen oder elektrostatischen Teilen im normalen Zustand
- CO und CO2 für Gaswege, in denen anorganische Gase erzeugt oder konzentriert werden
- Auswaschbare Stoffe in Gaswegen in Kontakt mit Anästhesiewirkstoffen, bei denen das Gas im normalen Zustand eingeführt werden kann
- Auswaschbare Stoffe in Gaswegen in Kontakt mit Stoffen, die für die Zufuhr über die Atemwege vorgesehen sind (z. B. einatembare Medikamente)
5. Fazit
Die Normenfamilie EN ISO 18562 hilft Ihnen, die Anforderungen der MDR zur Biokompatibilität der Atemgaswege bei medizinischen Anwendungen nachzuweisen.
Die Norm besteht aus vier Teilen. Suchen Sie sich zuerst die anwendbaren Teile dieser Normenfamilie heraus.
Sie können in nennenswertem Umfang Aufwände und Kosten sparen durch
- eine smarte Worst-Case-Auswahl und
- den Übertrag von Testergebnissen, die Sie in einem anderen Kontext generiert haben.
Sollte Ihr Medizinprodukt wider Erwarten auffällige Ergebnisse liefern oder sollte der Testaufbau zu komplex zu werden, unterstützen wir Sie gerne dabei, die Normkonformität zu erfüllen.
Wir übernehmen für Sie auch eine toxikologische Bewertung Ihrer Produkte. Weitere Informationen finden Sie hier.




Guten Tag Herr Rudolf,
besten Dank für diese sehr gute Übersicht über die ISO 18562 Normenreihe.
Eine echte Hilfe sich schnell zu orientieren.
Beste Grüsse,
Dirk Steinhoff