Nur durch klinische Evidenz – wirkliche Beweise – können Hersteller die Sicherheit, Leistungsfähigkeit und Wirksamkeit ihrer Medizinprodukte nachweisen. Doch wann ist ein Beweis stichhaltig genug? Sprich: Wann liegt eine ausreichende klinische Evidenz vor, welche Behörden und Benannte Stellen akzeptieren?
Dieser Artikel beantwortet die Fragen und verschafft einen kompakten Einstieg in das Thema „Klinische Evidenz“.
1. Relevanz der klinischen Evidenz
Nur mit klinischer Evidenz lassen sich die Anforderungen der verschiedenen Anspruchsgruppen erfüllen (Tab. 1):
| Anspruchsgruppe | Relevanz der klinischen Evidenz |
| Regulierer, Benannte Stellen, Behörden (z. B. FDA, Aufsichtsbehörden) | Die Vertreter dieser Anspruchsgruppe fordern klinische Nachweise (klinische Evidenz) beispielsweise bei der Zulassung von Medizinprodukten. Damit bewerten sie die Sicherheit und Wirksamkeit der Produkte, bevor sie die Marktfreigabe oder Zulassung erteilen. |
| Gesundheitsdienstleister (Krankenhäuser, Arztpraxen, Labore) | Diese Organisationen verlassen sich auf die klinischen Nachweise, um die Sicherheit und den Nutzen zu bewerten und damit fundierte Entscheidungen über die Auswahl und den Einsatz von Medizinprodukten zu treffen. Eine evidenzbasierte Entscheidungsfindung stellt sicher, dass die Patienten das für ihren speziellen medizinischen Zustand am besten geeignete Produkt erhalten, was zu besseren Behandlungsergebnissen führt. |
| Patienten | Die meist durch klinische Studien generierten klinischen Daten tragen dazu bei, potenzielle Risiken im Zusammenhang mit Medizinprodukten zu erkennen und zu mindern und so die Patientensicherheit zu erhöhen. Klinische Nachweise helfen bei der Bewertung des Sicherheitsprofils des Produkts und liefern wertvolle Informationen, um fundierte Entscheidungen zu treffen und sichere Produkte auf den Markt zu bringen. |
| Medizinproduktehersteller | Hersteller müssen die regulatorisch geforderte klinische Evidenz liefern. Sie hilft ihnen, die Konformität ihrer Produkte nachzuweisen und damit die Voraussetzungen für die Zulassung der Produkte zu schaffen. |
2. Klinische Evidenz: Die Grundlagen
a) Definitionen
Definition gemäß MDR
Die Begriffe „Beweis“ und „Nachweis“ werden synonym verwendet mit dem Begriff „Evidenz“. Die englische MDR spricht von „clinical evidence“, die deutsche Version von „klinischem Nachweis“. Die MDR definiert den Begriff wie folgt.
Die klinischen Daten und die Ergebnisse der klinischen Bewertung zu einem Produkt, die in quantitativer und qualitativer Hinsicht ausreichend sind, um qualifiziert beurteilen zu können, ob das Produkt sicher ist und den angestrebten klinischen Nutzen bei bestimmungsgemäßer Verwendung nach Angabe des Herstellers erreicht;
MDR, Artikel 2 (51)
Definition gemäß Leitlinie MEDDEV 2.7/1 rev. 4
Die Leitlinie liefert zwar keine Begriffsdefinition. Sie definiert aber „suffient clinical evidence“.
an amount and quality of clinical evidence to guarantee the scientific validity of the conclusions
Definition gemäß FDA
Die FDA nutzt die Begriffe „real-world data“ und „real-world evidence“.
Real-world data [RWD] are data relating to patient health status and/or the delivery of health care routinely collected from a variety of sources. Examples of RWD include data derived from electronic health records, medical claims data, data from product or disease registries, and data gathered from other sources (such as digital health technologies) that can inform on health status.
Real-world evidence is the clinical evidence about the usage and potential benefits or risks of a medical product derived from analysis of RWD.
b) Zielsetzung der klinischen Evidenz
In der (evidenzbasierten) Medizin
Die „evidenzbasierte Medizin hat zum Ziel, die ärztlichen Entscheidungsgrundlagen zu verbessern und die Qualität bei Diagnose und Therapie zu erhöhen.“
BMG
Sie möchte dieses Ziel erreichen, indem sich die medizinische Versorgung nicht mehr (allein) auf Meinungen und Übereinkünfte stützt, sondern auf Nachweise (Evidenz). Die Nachweise sind dann verlässlich, wenn diese mit objektiven wissenschaftlichen Methoden erhoben werden.
Bei Medizinprodukten
Medizinproduktehersteller benötigen klinische Evidenz, um die Sicherheit, Leistungsfähigkeit und Wirksamkeit (Nutzen) ihrer Medizinprodukte zu belegen.
Klinischen Evidenz ist somit unerlässlich, damit Aufsichtsbehörden, Angehörige der Gesundheitsberufe und Patienten fundierte Entscheidungen über die Auswahl, Einführung und Verwendung von Produkten treffen können. Dies ermöglicht Gesundheitsdienstleistern eine evidenzbasierte Versorgung, die die Sicherheit der Patienten gewährleistet und die Behandlungsergebnisse optimiert.
Sie stehen noch am Anfang Ihrer klinischen Bewertung?
Unser Clinical Evaluation Jumpstart Kit hilft Ihnen, die ersten Schritte innerhalb der klinischen Bewertung Ihrer Medizinprodukte zu gehen und verschafft Orientierung, was konkret von Ihnen verlangt wird.
3. Klinische Evidenz festlegen
a) Zeitpunkt und Art der Festlegung
Hersteller sind gesetzlich verpflichtet, die (notwendige) klinische Evidenz für ihre Produkte bereits im klinischen Evaluierungsplan (CEP) festzulegen. Dazu zählt die Festlegung des Umfangs und der Qualität der Nachweise, mit denen Sicherheit, Leistung und das Nutzen-Risiko-Verhältnis des Medizinprodukts nachgewiesen werden sollen. Beispielsweise beschreiben Hersteller die Anforderungen an Qualität, Quantität, Vollständigkeit und statistischer Validität der Daten.
Diese klinischen Nachweise müssen laut MDR den Merkmalen des Produkts und seiner Zweckbestimmung angemessen sein und den Stand der Technik reflektieren.
Beispiel
Das folgende Beispiel zeigt,
- welche Daten ein Hersteller berücksichtigen sollte, wenn er die klinische Evidenz bestimmt,
- weshalb er diese Daten als hilfreich erachtet und welche Aussagen er sich davon verspricht,
- welche Anforderungen er an die Güte dieser Daten(quellen) stellt und
- ob diese Daten mit seinem Produkt bzw. mit einem Äquivalenzprodukt erhoben wurden.
| Datenquelle | Design und Begründung | Eigenes Produkt | Äquivalenz- produkt | Nicht anwendbar |
| Nicht-klinische Daten | Leistungsdaten nach Norm Es sind produktspezifische Normen vorhanden, die Technologie ist bereits seit 20 Jahren bekannt, der Stand der Technik ist ausgereift. Das Produkt hat keinen direkten klinischen Nutzen/Endpunkt. | ☐ | ☐ | ☐ |
| Klinische Prüfung | Randomisiert, kontrolliert Der Stand der Technik zeigt Datenlücken in der Wirksamkeit der Medizinproduktegruppe. | ☐ | ☐ | ☐ |
| Klinische Erfahrungsdaten – PMS klinische Daten, Berichte über Reklamationen und Vorkommnisse | Leistungsdaten nach Norm Es sind produktspezifische Normen vorhanden, die Technologie ist bereits seit 20 Jahren bekannt, der Stand der Technik ist ausgereift. Das Produkt hat keinen direkten klinischen Nutzen/Endpunkt. | ☐ | ☐ | ☐ |
| Klinische Erfahrungsdaten – Sicherheitsdatenbanksuche | s. o. | ☐ | ☐ | ☐ |
| Klinische Fachliteratur | Das Produkt ist seit 20 Jahren auf dem Markt. Das Risiko-Nutzen-Profil ist bekannt. Die Leistungsnachweise sind in technischen Normen festgehalten, klinische Endpunkte sind lediglich zu untermauern, die generelle Leistung ist nicht anzuzweifeln. | ☐ | ☐ | ☐ |
| PMCF | s. o. | ☐ | ☐ | ☐ |
b) Herausforderungen bei der Festlegung
Herausforderung 1: Quantifizierung der Evidenz
Zuerst müssen Hersteller festlegen, wann sie den klinischen Nachweis als ausreichend betrachten und welche Zielgrößen sie dazu nutzen wollen.
Beispiele für Zielgrößen sind die Signifikanz, die Spezifität und die Wahrscheinlichkeiten (wie p-Values), dass Hypothesen zutreffen oder nicht.
Wenn diese Zielgrößen feststehen, werden deren Zielwerte bestimmt. Es muss z. B. begründet werden, weshalb ein p < 0,1 ausreichend ist.
Bei klinischen Studien unterscheidet man Evidenzniveaus. Diese werden weiter unten vorgestellt.
Herausforderung 2: Aufwand der Datenerhebung
Je höher die „Beweissicherheit“ sein soll, desto mehr klinische Daten müssen die Hersteller sammeln. Insbesondere klinische Prüfungen sind sehr kosten- und zeitintensiv.
Welche Daten wie gesammelt werden können, beschreibt der Fachbeitrag Klinische Daten.
Herausforderung 3: Abstimmung mit Behörden und Benannten Stellen
Benannte Stellen sind verpflichtet, die klinische Evidenz zu verifizieren. Daher kommt es regelmäßig zu Diskussionen, auch bei Bestandsprodukten.
Die Benannte Stelle überprüft die Angemessenheit des klinischen Nachweises und der klinischen Bewertung sowie die Ergebnisse, zu denen der Hersteller hinsichtlich der Konformität mit den einschlägigen grundlegenden Sicherheits- und Leistungsanforderungen gelangt ist.
Quelle: MDR, Anhang IX, Kapitel 2, Abschnitt 4.6
In der MDR steht, dass der Hersteller das Level der klinischen Evidenz seines Produkts festlegt, nicht die Benannte Stelle!
Der Hersteller spezifiziert und begründet den Umfang des klinischen Nachweises, der erforderlich ist, um die Erfüllung der einschlägigen grundlegenden Sicherheits- und Leistungsanforderungen zu belegen. Der Umfang des klinischen Nachweises muss den Merkmalen des Produkts und seiner Zweckbestimmung angemessen sein.
MDR, Artikel 61(1)
Der Beitrag MDCG 2020-6: Anforderungen an klinische Daten gibt Hinweise zum Festlegen der klinischen Evidenz bei Bestandsprodukten.
Herausforderung 4: Fortlaufende Aktualisierung
Der rasche technologische und medizinische Fortschritt erfordert eine kontinuierliche Bewertung der klinischen Evidenz.
Um mit den ständigen Innovationen Schritt zu halten, ist die Zusammenarbeit zwischen Herstellern, medizinischen Fachkräften, Forschern sowie Aufsichtsbehörden von entscheidender Bedeutung. Investitionen in gut durchdachte klinische Studien, innovative Studiendesigns und die Nutzung von Daten aus der Praxis können die Qualität und Effizienz der klinischen Beweisführung für Medizinprodukte verbessern.
4. Klinische Evidenz bewerten
a) Bewertung von klinischen Studien mithilfe von Evidenzlevels
Zu den wichtigsten Datenquellen zählen klinische Studien. Die Aussagekraft dieser Studien hängt von den Evidenzlevels ab. Man unterscheidet sechs Levels. Daten des Levels 1 haben die höchste Aussagekraft, Daten des Levels 6 die niedrigste.
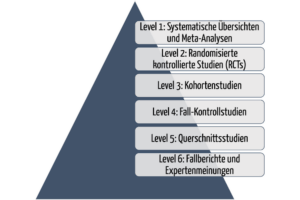
Die sechs Evidenzlevels helfen Fachleuten und Forschenden, die Qualität und Zuverlässigkeit der in klinischen Studien präsentierten Beweise zu bewerten. Das Verständnis dieser Ebenen ist unerlässlich, um fundierte Entscheidungen in der medizinischen Praxis und in der evidenzbasierten Medizin zu treffen.
Level 1: Systematische Übersichten und Meta-Analysen
An der Spitze der Hierarchie stehen systematische Übersichten und Meta-Analysen, die als höchste Evidenzstufe gelten.
Systematische Übersichten beinhalten eine umfassende Identifizierung, Bewertung und Synthese aller relevanten Studien zu einem bestimmten Thema.
Meta-Analysen gehen noch einen Schritt weiter, indem sie die Daten aus mehreren Studien statistisch kombinieren, um genauere Schätzungen der Behandlungseffekte zu erhalten. Diese Art von Studien liefert eine solide Zusammenfassung der verfügbaren Erkenntnisse und wird in der evidenzbasierten Medizin sehr geschätzt.
Level 2: Randomisierte kontrollierte Studien (RCT)
Randomisierte kontrollierte Studien gelten als der Goldstandard für die Bewertung von Behandlungsmaßnahmen. In einer RCT werden die Teilnehmer nach dem Zufallsprinzip verschiedenen Behandlungsgruppen zugeteilt, was einen Vergleich der Ergebnisse zwischen den Gruppen ermöglicht. RCT liefern überzeugende Beweise für die Kausalität und sind wirksam bei der Bewertung der Wirksamkeit und Sicherheit von Maßnahmen. Gut konzipierte und ordnungsgemäß durchgeführte RCT gelten im Allgemeinen als zuverlässige Beweisquellen.
Level 3: Kohortenstudien
Kohortenstudien sind Beobachtungsstudien, die eine Gruppe von Personen über einen längeren Zeitraum hinweg verfolgen. Sie können prospektiv (vorausschauend) oder retrospektiv (rückblickend) angelegt sein. In Kohortenstudien wird die Exposition von Personen gegenüber bestimmten Faktoren oder Interventionen bewertet; anschließend werden die Ergebnisse nachverfolgt.
Obwohl sie keine Randomisierung beinhalten, können Kohortenstudien wertvolle Erkenntnisse über den natürlichen Verlauf von Krankheiten, Risikofaktoren und Behandlungsergebnissen liefern. Sie sind jedoch anfällig für Verzerrungen und Störfaktoren, was ihre Zuverlässigkeit einschränken kann.
Level 4: Fall-Kontroll-Studien
Fall-Kontroll-Studien sind retrospektive Beobachtungsstudien, bei denen Personen mit einer bestimmten Erkrankung (Fälle) mit Personen ohne diese Erkrankung (Kontrollen) verglichen werden. Die Forscher bewerten die Expositionsgeschichten beider Gruppen und ermitteln den Zusammenhang zwischen der Exposition und der Entwicklung der Erkrankung.
Fall-Kontroll-Studien sind nützlich, um seltene Krankheiten oder Behandlungsergebnisse zu untersuchen, und sie sind relativ schnell und kostengünstig. Sie sind jedoch anfällig für Erinnerungsverzerrungen und hängen von einer genauen Berichterstattung über frühere Expositionen ab.
Level 5: Querschnittsstudien
Querschnittsstudien sind Beobachtungsstudien, die Daten aus einer bestimmten Population zu einem einzigen Zeitpunkt erheben. Die Forschenden erheben gleichzeitig Informationen über Expositions- und Ergebnisvariablen und analysieren die Zusammenhänge zwischen diesen Variablen. Querschnittsstudien sind hilfreich bei der Ermittlung von Prävalenzraten und der Identifizierung potenzieller Beziehungen zwischen Variablen. Sie können jedoch keine Kausalität feststellen oder zeitliche Zusammenhänge bewerten.
Level 6: Fallberichte und Expertenmeinungen
Auf der untersten Ebene der Evidenzhierarchie haben Fallberichte und Expertenmeinungen einen anekdotischen Charakter. Fallberichte beschreiben einzelne Patientenfälle, während Expertenmeinungen auf dem Wissen und der Erfahrung anerkannter Autoritäten auf dem Gebiet beruhen. Diese Quellen bieten wertvolle Einblicke und können Hypothesen für die weitere Forschung aufstellen. Aufgrund des Fehlens einer systematischen Datenerhebung sowie wegen möglicher Verzerrungen und Subjektivität gelten sie nicht als solide Evidenz.
b) Bewertung von klinischen Leitlinien
Abgrenzung von Leitlinien und klinischen Studien
Für die klinischen Bewertungen berücksichtigen die Hersteller neben den klinischen Studien auch klinische Leitlinien. Dazu sollten sie auch diese klinischen Leitlinien auf ihre Güte hin bewerten.
Die klassische evidenzbasierte Medizin setzt sich mit einer spezifischen klinischen Frage bei einem individuellen Patienten auseinander. Leitlinien hingegen bieten i. d. R. jeweils Entscheidungshilfen für eine Vielzahl verwandter klinischer Situationen und Patienten-Subgruppen.
Bewertung von Leitlinien mithilfe der S-Klassifikation
Das Manual Systematische Recherche für Evidenzsynthesen und Leitlinien wurde in seiner ersten Version im Rahmen des vom Bundesministerium für Gesundheit (BMG) geförderten Projekts „Acting on Knowledge“ (IIA5-2512MQS006) in Zusammenarbeit von Cochrane Deutschland und dem Institut für medizinisches Wissensmanagement der AWMF (AMWF-IMWi) sowie dem Ärztlichen Zentrum für Qualität in der Medizin (ÄZQ) erstellt.
Die S-Klassifikation hilft bei der Bewertung von Leitlinien.
| Niveau | Bezeichnung | Eigenschaften |
| S3 (hohe Systematik) | Evidenz- und konsensbasierte Leitlinie | Repräsentatives Gremium; systematische Recherche, Auswahl, Bewertung der Literatur; strukturierte Konsensfindung |
| S2e | Evidenzbasierte Leitlinie | Systematische Recherche, Auswahl, Bewertung der Literatur |
| S2k | Konsensbasierte Leitlinie | Repräsentatives Gremium; strukturierte Konsensfindung |
| S1 (niedrige Systematik) | Handlungsempfehlung von Expertengruppen | Konsensfindung in einem informellen Verfahren |
5. Tipps zum Vermeiden typischer Fehler
Tipp 1: Verzerrte Ergebnisse erkennen und vermeiden
Klinische Studien spielen im Rahmen der klinischen Evidenz eine wichtige Rolle. Hersteller sollten sich bewusst sein, dass es viele Faktoren gibt, welche die Studienergebnisse beeinflussen und dadurch zu ungenauen oder falschen Schlussfolgerungen führen.
Diese Verzerrungen können auch auf systematische Fehler zurückgeführt werden, die bei der Planung, Durchführung oder Analyse einer Studie auftreten.
Selection Bias (Auswahlverzerrung)
Selektionsverzerrungen treten auf, wenn die Zuordnung der Studienteilnehmer in verschiedene Studienarme durch Faktoren beeinflusst wird, die mit dem untersuchten Ergebnis zusammenhängen. Er kann entstehen, wenn Forschende versehentlich bestimmte Gruppen bevorzugen oder bei der Zuteilung der Teilnehmer keine Randomisierung sicherstellen.
Dieser „Selection Bias“ kann die Repräsentation der Zielpopulation beeinflussen und zu verzerrten Ergebnissen führen. Um Selektionsverzerrungen abzuschwächen, sollten Forschende eine Randomisierung anstreben und sicherstellen, dass die Teilnehmenden objektiv, d. h. ohne Einflussnahme oder Bevorzugung, und auf eine wissenschaftlich nachvollziehbare Weise den Behandlungsarmen zugewiesen werden.
Hier sind weitere Tipps, um Verzerrungen zu vermeiden:
Information Bias (Informationsfehler)
Die Informationsverzerrung bezieht sich auf Fehler bei der Messung oder Bewertung von Studienvariablen. Sie kann in zwei Unterkategorien eingeteilt werden: Erinnerungsfehler und Messfehler.
Recall Bias (Erinnerungsfehler)
Eine Erinnerungsverzerrung tritt auf, wenn sich die Teilnehmenden einer Studie selektiv an Informationen erinnern oder je nach Exposition oder Ergebnisstatus unterschiedlich über diese berichten.
Diese Verzerrung kann vermehrt bei retrospektiven Studien oder Fall-Kontroll-Studien auftreten, bei denen die Teilnehmenden ggf. Schwierigkeiten haben, sich genau an vergangene Ereignisse oder Expositionen zu erinnern.
Measurement Bias (Messfehler)
Messfehler treten auf, wenn bei der Messung oder Bewertung von Studienvariablen Fehler oder Unstimmigkeiten auftreten. Diese können durch ungenaue Messinstrumente, Variabilität zwischen den Beobachtern oder eine falsche Klassifizierung der Ergebnisse verursacht werden. Die Forschenden sollten strenge und standardisierte Messverfahren anwenden, um Messfehler zu minimieren.
Confounding Bias (Zusammenhangsfehler)
Ein Confounding Bias tritt auf, wenn ein fremder Faktor, ein sogenannter Confounder, sowohl mit der Exposition als auch mit dem untersuchten Ergebnis assoziiert ist. Diese Assoziation führt zu einer Verzerrung des wahren Verhältnisses zwischen der Exposition und dem Ergebnis, wodurch es schwierig wird, die beobachtete Wirkung ausschließlich der interessierenden Exposition zuzuschreiben.
Die Verwechslungsgefahr kann durch das Studiendesign (z. B. Randomisierung) oder statistische Verfahren wie Stratifizierung oder multivariate Analyse kontrolliert werden.
Publication Bias (Publikationsverzerrung)
Unter Publikationsverzerrung versteht man die selektive Veröffentlichung von Studien auf Grundlage der Richtung oder statistischen Signifikanz ihrer Ergebnisse. Studien mit positiven oder signifikanten Ergebnissen werden mit größerer Wahrscheinlichkeit veröffentlicht als Studien mit negativen oder nicht signifikanten Ergebnissen, die möglicherweise unveröffentlicht bleiben oder nicht beachtet werden.
Publikationsverzerrungen können zu einer Überschätzung der Behandlungseffekte und zu einer ungenauen Darstellung der verfügbaren klinischen Evidenz führen. Um dieser Verzerrung entgegenzuwirken, sollte die Veröffentlichung aller Studienergebnisse gefördert werden, unabhängig von ihren Ergebnissen.
Performance Bias (Leistungsverzerrung)
Eine Leistungsverzerrung liegt vor, wenn das Verhalten von Teilnehmenden oder Forschenden einer Studie durch das Wissen über die zugewiesene Behandlung oder Intervention beeinflusst wird. Diese Verzerrung kann zu einer unterschiedlichen Compliance, Ko-Intervention oder Bewertung der Ergebnisse führen, was wiederum verzerrten Studienergebnissen mit sich bringt.
Um den Performance Bias zu minimieren, können Verblindungstechniken eingesetzt werden (z. B. Doppelblind- oder Einfachblind-Designs): Weder die Teilnehmenden noch die Forschenden kennen die Behandlungszuweisung.
Verzerrung der Berichterstattung
Die Verzerrung der Berichterstattung bezieht sich auf die selektive oder unvollständige Berichterstattung über Studienergebnisse. Sie kann auftreten, wenn Forschende bestimmte Ergebnisse oder Analysen gegenüber anderen hervorheben oder wenn sie unerwünschte Ereignisse oder sekundäre Ergebnisse verschweigen. Verzerrungen in der Berichterstattung können die Gesamtinterpretation der Studienergebnisse beeinflussen und die Transparenz und Reproduzierbarkeit der Forschung beeinträchtigen.
Eine transparente und umfassende Berichterstattung, die sich an etablierte Richtlinien wie CONSORT (Consolidated Standards of Reporting Trials) hält, kann dazu beitragen, die Verzerrung der Berichterstattung zu verringern.
Cochrane hat ein Handbuch zur Bias-Bewertung publiziert, das die verschiedenen Arten der Verzerrung beschreibt sowie Möglichkeiten, diese zu vermeiden.
Tipp 2: Literatur strukturiert bewerten
Eine strukturierte Beschreibung von Literaturquellen hilft, Studien nachvollziehbar und vollständig zu bewerten. Somit ist sie unabdingbar bei der Festlegung der klinischen Evidenz.
Bei der strukturierten Beschreibung können u. a. folgende Punkte zur Orientierung genutzt werden:
- Identifikation der Studie
- Beschreibung der Studie, z. B. Ziel, Evidenzlevel, Fallzahl, Impact-Faktor, verwendete Produkte, Patientenpopulation usw.
- Bewertung der Ergebnisse, z. B. Bias, Störfaktoren, Aussage (z. B. über Leistung)
Das Johner Institut nutzt Werkzeuge, um die Daten systematisch und kategorisiert zu erfassen und auszuwerten. Wir unterstützen Sie gerne dabei, diese ebenfalls einzusetzen. Damit sparen Sie Aufwände und erhöhen die Qualität Ihrer klinischen Bewertungen.
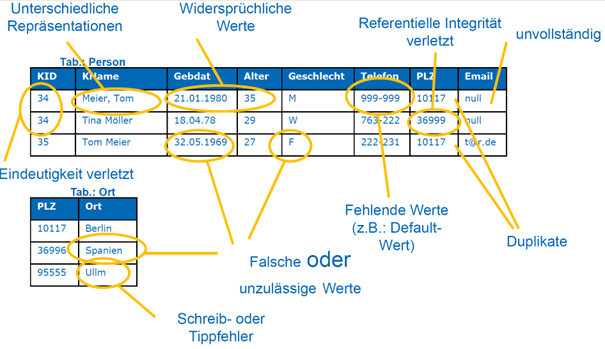
Tipp 3: Qualität aller Daten bestimmen und sicherstellen
Hersteller müssen nicht nur klinische Studien und die Literatur hinsichtlich ihrer Evidenz prüfen, sondern auch Datenquellen wie PMS-Daten, pivotale Daten, Bench-Tests und experimentelle Studien.
Prüfkriterien festlegen
Mit der Festlegung von Prüfkriterien lässt sich die Datenqualität bewerten. Typischerweise nutzen Hersteller ein Subset der folgenden Kriterien, um verlässliche Entscheidungen zu treffen:
- Vollständigkeit
- Eindeutigkeit
- Korrektheit
- Aktualität
- Genauigkeit
- Konsistenz
- Redundanzfreiheit
- Relevanz
- Einheitlichkeit
- Zuverlässigkeit
- Verständlichkeit
Es ist leichter, mit wenigen, relevanten Kriterien zu starten. Mit zunehmender Erfahrung und abhängig vom jeweiligen Kontext können diese stückweise ergänzt werden.
Prüfkriterien anwenden
Das nachfolgende Schaubild zeigt beispielhaft, wie die Kriterien in der Praxis zur Anwendung kommen können.
5. Fazit und Zusammenfassung
Klinische Nachweise sind von größter Bedeutung für die Bewertung von Sicherheit, Leistung und Nutzen von Medizinprodukten. Durch präklinische Studien, klinische Prüfungen und Beobachtungsstudien liefern klinische Nachweise wertvolle Erkenntnisse für Hersteller, Aufsichtsbehörden, medizinische Fachkräfte und Patienten.
Durch die Erleichterung einer fundierten Entscheidungsfindung, die Erhöhung der Patientensicherheit und die Optimierung der Behandlungsergebnisse spielt die klinische Evidenz eine zentrale Rolle bei der Weiterentwicklung von Medizinprodukten und somit der Verbesserung der Patientenversorgung.
Die klinischen Expertinnen und Experten des Johner Instituts helfen Ihnen dabei, die klinische Strategie festzulegen und einen Clinical Evaluation Plan (CEP) zu formulieren. Zu den einzelnen Schritten zählen:
- Stand der Technik ermitteln
- Klinisch relevante Parameter ableiten, um den klinischen Nutzen abzuleiten
- Akzeptanzkriterien festlegen, um die notwendige klinische Evidenz zu erreichen
- Methoden bestimmen um nachzuweisen, dass dies Akzeptanzkriterien erfüllt sind
Damit haben Sie alle Informationen, um Ihre klinischen Bewertungen zu erfüllen. Sie können sicher sein, die regulatorischen Anforderungen an den CEP erfüllt zu haben. Melden Sie sich gleich heute!