Die Literatursuche ist ein zentraler Bestandteil der klinischen Bewertung. Sie bedeutet meist viele Stunden Arbeit. In diesem Artikel erhalten Sie sechs Tipps, um die Literatursuche effizient durchzuführen und vollständig zu dokumentieren.
Mit der Literatursuche tragen die Hersteller wissenschaftliche Fachartikel zusammen, um u.a. den Stand der Technik zu dokumentieren sowie um Nachweise zur Sicherheit, zur Leistungsfähigkeit und zum klinischen Nutzen des Produkts zu erbringen. Mehr dazu später.
Sie stehen noch am Anfang Ihrer klinischen Bewertung?
Unser Clinical Evaluation Jumpstart Kit hilft Ihnen, die ersten Schritte innerhalb der klinischen Bewertung Ihrer Medizinprodukte zu gehen und verschafft Orientierung, was konkret von Ihnen verlangt wird.
Tipp 1: Nutzen Sie die Hinweise in den Leitlinien
Mittlerweile gibt es einige MDCG-Dokumente zum Thema klinische Bewertung, jedoch keines, welches die Durchführung und Dokumentation der Literatursuche zur klinischen Bewertung beschreibt.
a) MEDDEV 2.7/1 Revision 4 zur Literatursuche
Die MEDDEV 2.7/1 ist auch unter der MDR die wichtigste Leitlinie zur Literatursuche. Das sagt auch die Medical Device Coordination Group.
„For general guidance on a literature search, see MEDDEV 2.7/1 Revision 4, A5. Literature search and literature review protocol, key elements“
Section D, MDCG 2020-13
Durch die Literatursuche finden Sie Literatur zu dem zu evaluierenden Produkt, zum Äquivalenzprodukt und zum State of the Art. Dieser schließt alternative Untersuchungs- und Behandlungsmethoden mit ein.
Der Anhang 5 der MEDDEV 2.7/1 Revision 4 beschreibt die wichtigsten Punkte, die man bei der Dokumentation der Literatursuche beachten sollte. So verlangt die Leitlinie, das Ziel der Literatursuche(n) zu dokumentieren. Beispiele für solche Ziele sind:
- Daten zum zu evaluierenden Produkt (inklusive Produktname und Modell) liefern
- Wichtige Daten für den Risikomanagementprozess identifizieren (Fokus Patientenpopulation und vorhandene Interventionen)
- Informationen liefern, um das Nutzen-Risiko-Verhältnis zu bewerten
- Einen Überblick über die aktuellen Sicherheitsspezifikationen geben
- Einen Vergleich von möglichen Nebenwirkungen ermöglichen
- Informationen zu Benchmark-Produkten liefern
Hersteller müssen auch die Suchmethodik dokumentieren.
Weitere Hinweise zur Dokumentation finden Sie im zweiten Tipp.
Beachten Sie den ausführlichen Artikel zur MEDDEV 2.7/1.
b) MDCG Dokumente
Die MDCG-Dokumente bieten derzeit noch keine konkrete Anleitung, wie die Literatursuche umgesetzt werden soll. Das MDCG-Dokument 2020-13 „Clinical evaluation assessment report template“ ist dennoch nützlich:
Es richtet sich zwar primär an die Prüfer der klinischen Bewertung, insbesondere bei den Benannten Stellen. Aber damit bietet es auch indirekte Hinweise für diejenigen, die die klinische Bewertung durchführen. Im Abschnitt D werden die Literatursuche und die Literaturübersicht (Literature Review) thematisiert. Die dort gelisteten Anforderungen stimmen mit denen der MEDDEV 2.7/1 Revision 4 überein. Im Fokus stehen:
- Suchkategorien (bspw. Produktsuche oder State of the Art inklusive medizinischem Zustand)
- Umfang der Suchstrategie
- Such- und Review-Methoden
- Dokumentation zur Literatursuche
Letztlich referenziert das MDCG 2020-13 Dokument die MEDDEV 2.7/1 Revision 4. Also sparen Sie sich die Zeit für das MDCG-Dokument und freuen Sie sich darüber, dass Sie besonders im Hinblick auf die Literatursuche weiter mit der MEDDEV 2.7/1 Revision 4 arbeiten dürfen.
c) Weitere Dokumente
Weitere Leitdokumente zur Erstellung der klinischen Bewertung stammen z.B. vom IMDRF MDCE WG/N57FINAL:2019.
Tipp 2: Dokumentieren Sie die Literatursuche vollständig
a) Literatursuchprotokoll
Eine unvollständige Dokumentation der Literatursuche bedeutet eine Nicht-Konformität. Das kann zu unnötigen Rückfragen oder gar zu Abweichungen im Audit führen. Denn das MDCG-Dokument 2020-13 verlangt von den Benannten Stellen explizit, die Dokumentation zur Literatursuche zu überprüfen. Sie fordert die Prüfer auf, folgende Metadaten genau zu evaluieren:
- Suchbegriffe
- verwendete Datenbanken
- Ein- und Ausschlusskriterien
- Ausschluss von Duplikaten
- Verfahren und Dokumentation zur Literaturübersicht
- Suchmethoden
Diese Metadaten fließen in das Literatursuchprotokoll ein.
Die MDCG 2020-13 verlangt von den Auditoren, ein besonderes Augenmerk auf die Ausschlusskriterien zu werfen.
The clinical evaluation should clearly describe the selection criteria with respect to the regulatory purpose to which it will apply. The CER should clearly differentiate between the two types of data (device under evaluation or an equivalence device, state of the art or alternative treatment option). If the data does not relate to either of the above, provide a rationale with respect to its inclusion.
Section D, MDCG 2020-13
Die MDCG 2020-13 verpflichtet die Hersteller, die Auswahlkriterien für die Literatursuche festzulegen und zu dokumentieren. Dabei sollten die Auswahlkriterien im Kontext der klinischen Bewertung stehen und zwischen zumindest zwei Suchen nach Daten oder Informationen unterscheiden:
- Suche zum State of the Art
- Suche zu dem zu evaluierenden Produkt/Äquivalenzprodukt
Mehr zu diesen zwei Suchen erfahren Sie im Tipp 3.
b) Weitere Dokumentation
Die vollständige Dokumentation zur Literatursuche umfasst nicht nur das Literatursuchprotokoll.
Die Dokumentation beinhaltet in Summe die folgenden Dokumente:
- Das eben erwähnte Literatursuchprotokoll
- Bericht zur Literatursuche, welcher u.a. Abweichungen vom Literatursuchprotokoll und die Ergebnisse der Suche umfasst
- Vollständige Liste der abgerufenen Artikel
- Vollständige Liste der ausgeschlossenen Artikel mit Ausschlussgründen
- Volltextkopien der relevanten Dokumente
Tipp 3: Beachten Sie, dass es mehrere Literatursuchen gibt
Bei der Auswahl, nach was Sie suchen müssen, sind sie nicht frei. MEDDEV 2.7/1 Revision 4 besteht darauf, dass Ihre Literatursuche zumindest zwei wesentliche Themen berücksichtigt:
- Den State of the Art benötigen Sie, um den Stand der Technik zu Ihrem Produkt darzulegen und um Ihr Produkt im Vergleich dazu zu bewerten.
- Die Aussagen zum eigenen Produkt (bzw. Äquivalenzprodukt) benötigen Sie, um die Sicherheit, die Leistung und den klinischen Nutzen Ihres Medizinproduktes nachzuweisen.
Abhängig von der Zielsetzung wählen Sie unterschiedliche Suchbegriffe (siehe Abbildung 1).
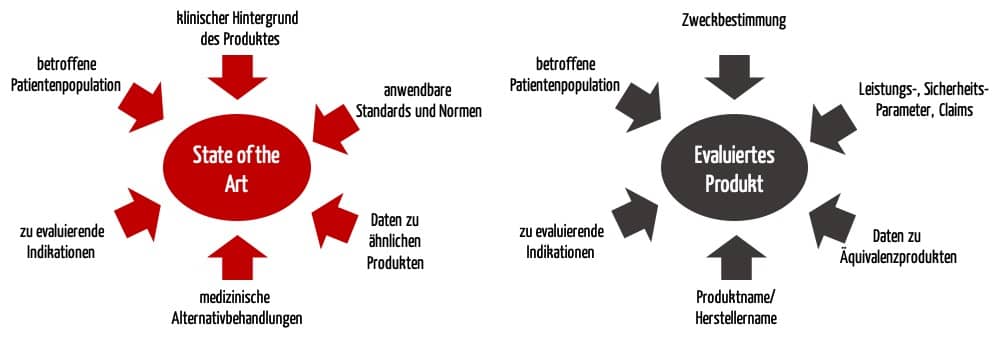
Vernachlässigen Sie keine dieser Suchen. Andernfalls droht eine Nicht-Konformität im Audit.
Das PICO-Schema hilft bei der Literaturrecherche, beispielsweise um Suchkriterien für den den State of the Art zu finden.
Patient/Population; Intervention/Behandlung; Comparison/Alternativbehandlungen; Outcome/Behandlungsziel
Diese PICO-Schema wird besonders in der evidenzbasierten Medizin angewendet und für den Aufbau der Literatursuche durch die MEDDEV 2.7/1 Revision 4 in der klinischen Bewertung empfohlen.
Tipp 4: Suchen Sie in den für Sie relevanten Datenbanken
Genauso wichtig wie die Suchstrategie ist die Auswahl der zu durchsuchenden Datenbanken. Die MDR gibt zur Auswahl der Literaturdatenbanken keine konkreten Hinweise. Allerdings fordert sie im Artikel 2 (48) Peer-Review-Publikationen.
PubMed enthält, von wenigen Ausnahmen abgesehen, nur Peer-Review-Publikationen. PubMed ermöglicht im Gegensatz zu Embase eine kostenfrei Suche und Registrierung. Der Zugriff auf die Volltexte ist jedoch auch bei PubMed teilweise nicht kostenfrei.
Darüber hinaus spricht die MDR von „einschlägiger Fachliteratur“ oder „Datenbanken“. Die EU-Verordnung lässt aber offen, welche Datenbanken die Autoren klinischer Bewertungen heranziehen sollen.
In Section D weist das MDCG 2020-13-Dokument darauf hin, dass mehrere Datenbanken verwendet werden sollen, um Verzerrungen bei der Literaturübersicht zu vermeiden.
Um geeignete Literaturdatenbanken auszuwählen, gibt MEDDEV 2.7/1 Revision 4, Annex 4 eine Hilfestellung. Hier werden MEDLINE bzw. Pubmed und weitere Datenbanken wie EMBASE oder Cochrane CENTRAL Trials Register empfohlen, jedoch nicht explizit gefordert.
|
Datenbank | Nutzen gemäß MEDDEV 2.7/1 Revision 4, Annex 4 |
| PubMed/Medline |
Guter Ausgangspunkt für eine Suche. Die Vollständigkeit kann jedoch nicht garantiert werden (möglicherweise unvollständige Berichterstattung über europäische Zeitschriften) |
| EMBASE/Excerpta Medica |
Angemessener Umfang an in Europa verwendeten Medizinprodukten und Therapien. Erleichterte Suche nach Produktnamen und Herstellern |
|
Cochrane CENTRAL Trials Register |
Wie EMBASE |
Sparen Sie also Kosten und führen Sie die Suche direkt mit PubMed durch. Verwenden Sie zusätzliche Datenbanken, um europäische Thematiken (in Europa etablierte Therapien oder Medizinprodukte) abzudecken (z.B. Embase).
Eine weitere Liste möglicher Quellen für Literatur und klinische Daten finden Sie im Fachartikel zu den klinischen Daten.
Tipp 5: Nutzen Sie Operatoren
Der Einsatz von (booleschen) Operatoren ermöglicht Ihnen, Ihre Literatursuche einzuengen. So können Sie sich das Lesen unspezifischer Literaturquellen ersparen. Durch die booleschen Operatoren können Sie die Suche aber auch erweitern, insbesondere wenn Sie nicht auf ausreichende Literaturstellen stoßen.
Mit Hilfe der Operatoren können verschiedenste Suchbegriffe im Hinblick auf Ihren Kontext kombiniert werden. Die bekanntesten booleschen Operatoren sind AND, OR, und NOT.
- Die Kombination mit „AND“ filtert Ihnen die Ergebnisse nach Einträgen, die alle Suchbegriffe enthalten.
- Die Kombination mit „OR“ filtert Ihnen die Ergebnisse nach Einträgen, die einen der Suchbegriffe enthalten.
- Und die Kombination mit „NOT“ schließt Einträge mit diesem Suchbegriff von Ihrer Suche aus.
Anführungszeichen und runde Klammern sind ebenfalls nützlich, um die Qualität der Suchergebnisse zu verbessern. Nutzen Sie diese, um zu relevanten und spezifischen Suchergebnissen zu gelangen.
- Wenn Sie Anführungszeichen „“ setzten, wird die Suchmaschine die Suchbegriffe in direktem Zusammenhang und Reihenfolge suchen.
- Mit runden Klammern () können Sie einen booleschen Operator auf Terme bzw. Einheiten beziehen.
Die nachfolgende Tabelle illustriert das beispielhaft:
|
Suchbegriff | Anzahl der gefundenen Publikationen |
|
Ice pack |
1154 |
|
„Ice pack“ |
244 |
| „Ice pack“ AND reduction AND pain OR edema | 181,916 |
| „Ice pack“ AND (reduction AND (pain OR edema)) | 19 |
Beachten Sie, dass die verschiedenen Datenbanken unterschiedliche Operatoren nutzen. Informieren Sie sich direkt auf der Webseite der jeweiligen Datenbank. Das betrifft auch die Interpretation der Suchphrase, wenn Klammern fehlen (wie im vorletzten Beispiel in der vorangegangenen Tabelle gezeigt). Einige Datenbanken interpretieren diese Suchphrase als („Ice pack“ AND reduction AND pain) OR edema.
Tipp 6: Lesen Sie nicht alle Suchergebnisse im Volltext
Die Literatursuche führt häufig zu mehreren Hundert Publikationen. An diesem Punkt fragen Sie sich sicher, ob es nötig ist, jede Publikation im Volltext zu lesen.
Die Volltexte der initial gefunden Dokumente müssen Sie (noch) nicht in Gänze lesen. Schließen Sie offensichtlich nichtrelevante Publikationen anhand des Abstracts aus, wenn diese nicht im Zusammenhang mit der klinischen Bewertung stehen und z.B. nichts mit dem zu evaluierenden Produkt zu tun haben.
Spätestens zum Zeitpunkt der Literaturbewertung sollten Sie allerdings die Volltextpublikation lesen. Diese Ansicht vertritt auch die MDCG:
“Abstracts lack sufficient detail to allow issues to be evaluated thoroughly and independently, but may be sufficient to allow a first evaluation of the relevance of a paper. Copies of the full text papers and documents should be obtained for the appraisal stage.”
Section D, MDCG 2020-13
Zusammenfassung und Schlussfolgerung
Nutzen Sie die MEDDEV 2.7/1 Revision 4 weiterhin als Leitlinie für die Literatursuche. Das Dokument MDCG 2020-13 verweist auf die Anforderungen der MEDDEV 2.7/1 Revision 4 und hält die Prüfer der klinischen Bewertung dazu an, bei den folgenden Themen genau hinzuschauen:
- Dokumentation zur Literatursuche
- Vorhandensein der Volltextpublikationen
- Vollständigkeit der Metainformationen (z.B. Ein- und Ausschlusskriterien)
Steuern Sie den Umfang und die Spezifität der Publikationen, die Sie bei Ihrer Literatursuche gefunden haben, indem Sie (boolesche) Operatoren einsetzen. Sparen Sie Zeit, indem Sie offensichtliche nichtrelevante Publikationen frühzeitig ausschließen, insbesondere wenn diese weder den State of the Art noch das zu bewertende Produkt betreffen.
Denken Sie daran, dass Sie neben dem State of the Art zumindest noch die Informationen zu den Äquivalenzprodukten recherchieren, d.h. mindestens zwei Suchen durchführen müssen.
Wenn Sie die Tipps in diesem Artikel berücksichtigen, werden Sie die Anforderungen der MDR an die Literatursuche erfüllen.
Haben Sie Fragen zur konkreten Umsetzung im Dokument? Schreiben Sie uns eine E-Mail oder senden Sie uns eine Kontaktanfrage. Wir prüfen und trimmen mit Ihnen Ihre Dokumente auf Konformität, damit Ihre klinische Bewertung im Audit standhält.
Möchten Sie mehr zur klinischen Bewertung erfahren? Dann melden Sie sich gleich hier zum Bootcamp an!




Guten Tag Frau Wettlaufer,
so wie ich das jetzt verstanden habe sind laut MDR aber keine „(systematic) reviews“ als Literaturquelle zulässig sondern nur „peer-reviewed“ Paper?
Ist das korrekt?
Mit freundlichen Grüßen
Lukas de Hond
Lieber Herr de Hond,
herzlichen Dank für Ihre nette Frage. In der MDR heißt es
„ […] in nach dem Peer-Review-Verfahren überprüfter wissenschaftlicher Fachliteratur veröffentlichte Berichte über sonstige klinische Erfahrungen entweder mit dem betreffenden Produkt oder einem Produkt, dessen Gleichartigkeit mit dem betreffenden Produkt nachgewiesen werden kann“
Systematische Reviews können ebenfalls einem Peer-Review unterzogen sein, wodurch diese wieder als klinische Daten (gemäß MDR) gelten, um die Sicherheit und die Leistung des zu evaluierenden Medizinproduktes nachzuweisen.
Darüber hinaus zählen
– klinische Prüfungen zum zu evaluierenden Produkt,
– oder sonstige in der wissenschaftlichen Fachliteratur wiedergegebene Studien zum Äquivalenzprodukt als auch
– Daten aus der Überwachung nach dem Inverkehrbringen (PMS/PMCF-Daten)
als klinische Daten, die in die klinische Bewertung integriert werden, um Sicherheit und Leistung des zu evaluierenden Produktes zu belegen.