Hersteller von Bestandsprodukten (legacy devices) können derzeit ihre Produkte noch auf dem Markt behalten, ohne einen Konformitätsnachweis nach der Verordnung 2017/745 über Medizinprodukte (MDR) zu erbringen. Spätestens mit Ende der Übergangsfrist müssen Hersteller jedoch die hierfür notwendigen klinischen Daten bereitstellen.
Die Anforderungen an klinische Daten, die als Nachweis für die Konformität nutzbar sind, sind allerdings unter der MDR enorm gestiegen. Außerdem bleibt die Verordnung bezüglich der genauen Anforderungen vielfach vage.
Abhilfe schafft da die Leitlinie MDCG 2020-6 „Regulation (EU) 2017/745: Clinical evidence needed for medical devices previously CE marked under Directives 93/42/EEC or 90/385/EEC – A guide for manufacturers and notified bodies“. Sie gibt Empfehlungen, welchen Anforderungen die klinischen Daten genügen müssen, damit sie die Konformität der Bestandsprodukte mit der MDR nachweisen.
Als Hersteller von Bestandsprodukten sollten Sie die Übergangsfrist nutzen, um u. a. mit Hilfe dieser Leitlinie rechtzeitig die nötigen klinischen Daten zu sammeln. So vermeiden Sie, dass Sie Ihr Produkt vom Markt nehmen müssen. Der folgende Beitrag erleichtert Ihnen die Arbeit, indem er
- die Empfehlungen aus der MDCG 2020-6 zusammenfasst und
- Tipps gibt, wie Sie am besten vorgehen, um die nötigen klinischen Daten für Ihr Bestandsprodukt zu sammeln.
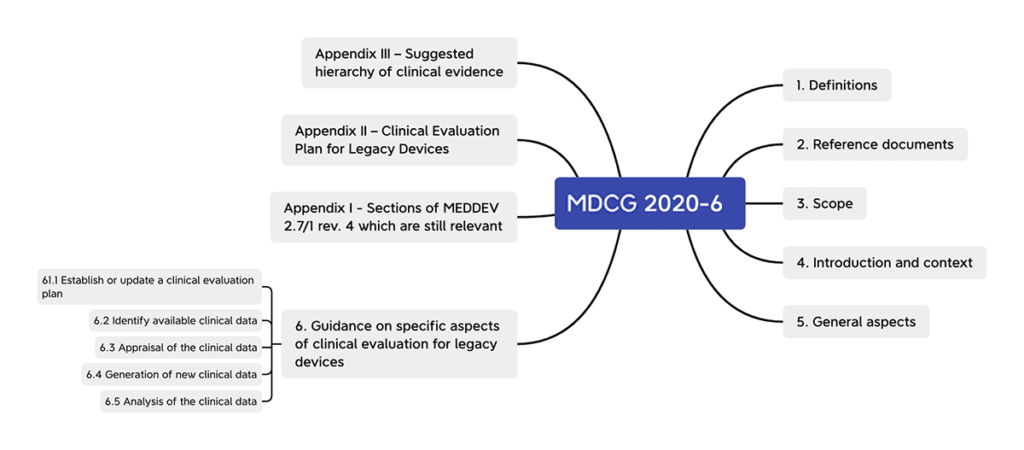
1. Anwendungsbereich der MDCG 2020-6
a) Legacy Devices: Produkte mit MDD/AIMDD-Zertifikat
Die MDCG 2020-6 bezieht sich auf sogenannte Legacy Devices. Dies sind Bestandsprodukte, die bereits vor Gültigkeit der MDR gemäß der europäischen Richtlinie 93/42/EWG über Medizinprodukte (MDD) oder der Richtlinie 90/385/EWG über aktive implantierbare medizinische Geräte (AIMDD) auf den Markt gebracht wurden.
Die MDCG 2020-6 bietet Herstellern und Benannten Stellen eine Richtschnur für die Erhebung und Auswertung klinischer Daten in Bezug auf solche Bestandsprodukte.
Diese Daten sind später für das Konformitätsbewertungsverfahren nach der MDR wichtig.
b) Klinische Daten für das Konformitätsbewertungsverfahren nach MDR
Seit Gültigkeit der MDR (Mai 2021) gilt für Bestandsprodukte eine Übergangsfrist, bis auch diese das Konformitätsbewertungsverfahren nach MDR durchlaufen müssen. Die Fristen enden spätestens am 26.05.2024.
Klinische Daten sind nötig für
- die Bestätigung der Erfüllung der einschlägigen grundlegenden Sicherheits- und Leistungsanforderungen gemäß MDR Anhang I sowie
- die Beurteilung unerwünschter Nebenwirkungen und der Vertretbarkeit des Nutzen-Risiko-Verhältnisses.
Bereits während der Übergangsfrist gelten für Hersteller die MDR-Anforderungen für Post-Market Surveillance. Im Rahmen der Post-Market Surveillance (PMS) sind sie verpflichtet, proaktiv sowohl Daten zur Sicherheit und Leistung der Bestandsprodukte als auch wissenschaftliche Daten zu sammeln. Diese Ergebnisse fließen in die klinische Bewertung ein, die wiederum für den Konformitätsnachweis unerlässlich ist.
Sämtliche Daten zum Produkt vor und nach dem Inverkehrbringen dienen als Nachweis für die Konformität mit den einschlägigen grundlegenden Sicherheits- und Leistungsanforderungen der MDR.
Daher sollten sich insbesondere Hersteller von Bestandsprodukten unbedingt mit den Empfehlungen der MDCG 2020-6 zur Erhebung und Auswertung dieser Daten befassen.
Mehr zur klinischen Bewertung erfahren Sie in diesem Übersichts-Beitrag.
Mehr zu den Übergangsfristen der MDR erfahren Sie in einem gesonderten Beitrag .c) Für wen MDCG 2020-6 besonders interessant ist
Damit ist die Leitlinie MDCG 2020-6 vor allem interessant für:
- Hersteller von Bestandsprodukten
Diese können die Übergangsfrist bis zur Erneuerung des MDR-Zertifikats nutzen, um ausreichend klinische Daten zum eigenen Produkt zu sammeln. - Hersteller, die ein Produkt neu entwickeln
Die MDCG 2020-6 bietet Definitionen für zahlreiche Begriffe, die in Art. 2 MDR nicht ausdrücklich definiert sind, aber für die Bewertung des Nutzen-Risiko-Verhältnisses und die Schlussfolgerungen der klinischen Bewertung von wesentlicher Bedeutung sind (z. B. Indikation, State of the Art, Grad der klinischen Evidenz).
2. Wie die MDCG 2020-6 beim MDR-Konformitätsbewertungsverfahren hilft
Die MDCG 2020-6 erläutert und ergänzt einige Unklarheiten, die sich bezüglich klinischer Daten in der MDR ergeben. Insbesondere sind dies:
- Definitionen
In Punkt 1.2 ergänzt die MDCG 2020-6 Definitionen von Begriffen, die in der MDR nicht definiert werden. Hierzu gehören „Bestandsprodukt“ (legacy device), „bewährte Technik“, „wissenschaftliche Validität“, „ausreichende klinische Evidenz“, „Stand der Technik“, „beabsichtigte Nutzung“, „Indikation“ sowie „ähnliches Produkt“. - Klinische Bewertung
Im allgemeinen Teil hebt die MDCG 2020-6 verschiedene Punkte hervor, die für die klinische Bewertung beachtenswert sind. Besonders geht die Verordnung auf den Leitfaden MEDDEV 2.12/2 zu PMCF-Studien ein.
- Ausnahmen der Nutzung klinischer Daten
Art. 61 MDR nennt einige Ausnahmen, in denen klinische Daten nicht für den Nachweis der Konformität herangezogen werden müssen. Die MDCG 2020-6 stellt klar, wann diese gelten und wann nicht.
- Plan für die klinische Bewertung
Die MDR nennt in Anhang XIV, Teil A, Punkt 1 a) Anforderungen an den Plan für die klinische Bewertung (Clinical Evaluation Plan, CEP). Die MDCG 2020-6 empfiehlt (zusätzlich zu den dort genannten Anforderungen) weitere Punkte, die zu beachten sind. - Bewertung, Auswertung und Generierung klinischer Daten
Die MDCG 2020-6 gibt Empfehlungen, was bei der Bewertung, Auswertung und Generierung klinischer Daten allgemein zu beachten ist.
- Abschnitte von MEDDEV 2.7/1 rev. 4, die unter der MDR noch relevant sind
Die MEDDEV 2.7/1 rev. 4 bezieht sich eigentlich auf die nun veralteten Richtlinien. Allerdings gibt es Abschnitte, die auch noch unter der MDR gelten. Diese werden aufgelistet. - Hierarchie der klinischen Beweise
Die MDCG 2020-6 gibt außerdem eine Empfehlung ab, in welcher Reihenfolge bzw. hierarchischen Ordnung die klinischen Daten als Nachweis der Konformität von Bestandsprodukten mit der MDR gelten.
3. Empfehlungen und Erläuterungen aus der MDCG 2020-6
a) Definitionen
In Punkt 1.2 ergänzt die MDCG 2020-6 Definitionen, die in der MDR fehlen.
Bestandsprodukte
Alle Produkte, die vor Gültigkeit der MDR eine CE-Kennzeichnung gemäß der europäischen Richtlinie 93/42/EWG über Medizinprodukte (MDD) oder der Richtlinie 90/385/EWG über aktive implantierbare medizinische Geräte (AIMDD) erhalten haben
Bewährte Technik (well-established technology)
Zwar nutzt die MDR den Begriff „bewährte Technologie“ in mehreren Artikeln (Art. 52 Abs. 5, Art. 61 Abs. 8), sie definiert den Begriff jedoch nicht.
Die MDCG 2020-6 liefert in Punkt 1.2 Kriterien, die eine bewährte Technologie erfüllen muss:
- Relativ einfaches, gängiges und stabiles Design mit wenigen Änderungen über die Zeit
- Die generische Produktgruppe ist allgemein als sicher bekannt und wurde in der Vergangenheit nicht mit Sicherheitsproblemen in Verbindung gebracht.
- Allgemein bekannte Charakteristika der klinischen Leistung; die generische Produktgruppe gehört außerdem zu den medizinischen Standardgeräten, bei denen es wenig Abweichung bei den Indikationen gibt; die Geräte sind auf dem Stand der Technik (state of the art).
- Lange Historie auf dem Markt
Wissenschaftliche Validität
In Hinblick auf die wissenschaftliche Validität betont die MDCG 2020-6, dass klinische Bewertungen einem „definierten und methodisch fundierten Verfahren“ folgen müssen. Hierbei nennt das Dokument einige Kriterien, z. B.:
- Angemessenheit des Studiendesigns und der Kontrollen
- Angemessenheit und Relevanz der Forschungsfragen
- Angemessenheit der Stichprobengrößen und statistischen Analysen
- Vollständigkeit der Daten
- Angemessenheit der Nachbeobachtungszeit
- Angemessenheit der Schlussfolgerungen auf der Grundlage objektiver Nachweise
Außerdem wird auf die Leitlinien aus Abschnitt 9.3.1 von MEDDEV 2.7/1 rev. 4 verwiesen, die auch noch unter der MDR gelten.
Ausreichende klinische Evidenz
Die „ausreichende klinische Evidenz“ wird in der MDR zwar gefordert, dort aber nicht definiert. Die MDCG 2020-6 schafft hier Abhilfe und definiert „ausreichende klinische Evidenz“ als „das vorliegende Ergebnis der qualifizierten klinischen Bewertung, die schlussfolgert, dass das Produkt sicher ist und den beabsichtigten Nutzen erzielt“.
the present result of the qualified assessment which has reached the conclusion that the device is safe and achieves the intended benefits
Stand der Technik
Hier verweist die Leitlinie auf die Definition aus IMDRF/GRRP WG/N47, die lautet:
„Stand der derzeitigen technischen Möglichkeiten und/oder der anerkannten klinischen Praxis in Bezug auf Produkte, Verfahren und Patientenmanagement, basierend auf den relevanten konsolidierten Erkenntnissen aus Wissenschaft, Technik und Erfahrung“
Beabsichtigte Nutzung
An dieser Stelle erwähnt das Dokument lediglich, dass die MDR den „beabsichtigten Zweck“, nicht aber die „beabsichtigte Nutzung“ definiert, und stellt fest, dass diese beiden Begriffe gleichbedeutend verwendet werden sollten.
Indikation
Die Indikation wird definiert als der klinische Zustand, der durch das Medizinprodukt diagnostiziert, verhindert, überwacht, behandelt, gelindert, kompensiert, verändert oder kontrolliert werden soll. Die Indikation soll von „Zweckbestimmung/Verwendungszweck“ unterschieden werden. Diese beschreiben die Wirkung eines Produkts.
Ähnliches Produkt
Geräte, die zur gleichen generischen Gerätegruppe gehören. Die MDR definiert dies als eine Gruppe von Produkten mit gleicher oder ähnlicher Zweckbestimmung oder Gemeinsamkeiten in der Technologie, die eine generische Einstufung ermöglichen, ohne dass sie spezifische Merkmale widerspiegeln.
b) Beachtenswerte Punkte für die klinische Bewertung
Die MDR unterstreicht in der Reihe wichtiger Faktoren, die für die klinische Bewertung relevant sind:
- Die Abwägung verfügbarer alternativer Behandlungsoptionen ist erforderlich für die Abwägung des Nutzen-Risiko-Verhältnisses.
- Die Abwägung des Nutzen-Risiko-Verhältnisses muss auf klinischen Daten beruhen, die ausreichende klinische Nachweise liefern, gegebenenfalls einschließlich relevanter Daten aus dem Post-Market Surveillance (PMS).
- Der Grad des klinischen Nachweises muss vom Hersteller angegeben und begründet werden, wobei die Merkmale des Produkts und die Zweckbestimmung zu berücksichtigen sind.
- Daten der Post-Market Surveillance, insbesondere Daten der Nachverfolgung nach dem Inverkehrbringen (Post-Market Clinical Follow-Up, PMCF) müssen in die klinische Bewertung einfließen.
- Hersteller sind verpflichtet, einen Plan für die Post-Market Surveillance nach Anhang III MDR zu erstellen.
Besonders hebt MDCG 2020-6 die Daten aus der klinischen Nachverfolgung nach dem Inverkehrbringen (Post-Market Clinical Follow-Up, PMCF) hervor.
Beim Post-Market Clinical Follow-up (PMCF) geht es um das systematische Sammeln klinischer Daten. Die PMCF hat zum Ziel, die klinische Bewertung zu aktualisieren.
c) Ausnahmen der Nutzung klinischer Daten
Art. 61 Abs. 10 MDR besagt, dass in Fällen, in denen klinische Daten ungeeignet sind, um die Konformität mit den grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen, auf andere Nachweise zurückgegriffen werden kann.
Die Leitlinie MDCG 2020-6 weist darauf hin, dass diese Ausnahmen nicht für Klasse-III-Produkte oder implantierbare Produkte gilt.
Grundsätzlich muss jede Ausnahme auf der Grundlage des Risikomanagements des Herstellers und unter Berücksichtigung der besonderen Merkmale des Zusammenspiels zwischen dem Produkt und dem menschlichen Körper, der bezweckten klinischen Leistung und der Angaben des Herstellers angemessen begründet werden.
d) Plan für die klinische Evaluation etablieren oder updaten
Die MDR nennt in Anhang XIV, Teil A, Punkt 1 a) Anforderungen an den Plan für die klinische Bewertung (Clinical Evaluation Plan, CEP). Die MDCG 2020-6 empfiehlt in Punkt 6.1, zusätzlich zu den dort genannten Anforderungen, die folgenden Punkte zu berücksichtigen:
|
Mindestanforderung nach MDR, Anhang XIV, Teil A, 1.a) |
Erläuterung aus MDCG 2020-6 |
| (1) Identification of the relevant GSPRs | Eine Analyse in Bezug auf die grundlegenden Sicherheits- und Leistungsanforderungen (GSPRs) der MDR, um festzustellen, ob zusätzliche Daten zur Unterstützung des klinischen Nachweises erforderlich sind, um zusätzliche MDR-Anforderungen zu erfüllen |
| (2) und (3) Specification of the intended purpose, target groups, indications, contraindications | Inputs für die klinische Bewertung sind in Übereinstimmung mit Referenzangaben: Marketingmaterial, IFU, Risikomanagement-Dokumente |
| (4) Detailed description of intended clinical benefits with relevant and specified clinical outcome parameters | Zusätzliche und relevante Informationen in Bezug auf die Definition und Quantifizierung des Nutzens und die Bestimmung relevanter Outcome-Parameter des klinischen Nutzens (Verweis auf MEDDEV 2.7/1 rev. 4 Anhang A7.2 Abschnitt b und c) |
| (5–7) Specification of qualitative and quantitative aspects of clinical safety and performance | Begründung des „Level of clinical evidence“: Als Ergebnis dieses Schrittes sollte es möglich sein zu schlussfolgern, ob es sich bei dem Produkt um ein Produkt handelt, das eine eindeutig positive Nutzen-Risiko-Bestimmung aufweist. |
| (6) „determine … the acceptability of the benefit-risk ratio for the various indications and for the intended purpose or purposes of the device“ | Muss sich an dem neuesten medizinischen Kenntnisstand (State of the Art) orientieren (MEDDEV 2.7/1 rev. 4, Abschnitt 8.2) |
e) Bewertung, Auswertung und Generierung klinischer Daten
In Kapitel 6.3 gibt die MDCG 2020-6 Empfehlungen für die Beurteilung und Auswertung bestehender und neuer Daten.
Identifizieren klinischer Daten
Für den Konformitätsnachweis können sowohl Prä- als auch Post-Market-Daten herangezogen werden. Hierzu gehören etwa:
- Stand der Technik
- Klinische Daten für ähnliche Produkte
- Gebrauchstauglichkeitstests oder Tests mit simulierter Anwendung
Eine Zusammenfassung der Datenquellen findet sich in Anhang III von MDCG 2020-6.
PMCF-Studien
PMCF-Studien können zusätzlich zu den nichtklinischen Daten (Artikel 61(10) MDR) zur Bestätigung der Sicherheit und Leistung herangezogen werden.
Analyse klinischer Daten
Bei der Auswertung bestehender Daten für den Nachweis der Konformität unterscheidet die MDCG 2020-6 zwischen direktem klinischen Nutzen und indirektem klinischen Nutzen. Unter direktem klinischen Nutzen versteht die Leitlinie Medizinprodukte, die eine direkte therapeutische oder diagnostische Funktion erfüllen.
Medizinprodukte mit indirektem klinischen Nutzen erfüllen keine direkte therapeutische oder diagnostische Funktion. Der klinische Nutzen ergibt sich erst indirekt. Ein Beispiel sind Führungsdrähte, die andere Medizinprodukte dabei unterstützen, ihren vorgesehenen Zweck zu erfüllen, ohne selbst eine direkte therapeutische oder diagnostische Funktion zu haben.
- Direkter klinischer Nutzen
Muss durch klinische Daten nachgewiesen werden
- Indirekter klinischer Nutzen
Für den Nachweis von indirektem klinischem Nutzen können Hersteller auch auf- präklinische/Bench-Test-Daten,
- Daten aus der Produktnutzung (etwa aus einer bestehenden Datenbank) oder
- Daten aus der Verwendung mit einem weiteren Produkt zurückgreifen (z. B. Daten von einem Stent, die herangezogen werden, um die Sicherheit und Leistung eines Führungsdrahtes nachzuweisen).
Risiken
Die MDR erfordert von Herstellern ein Risiko-Management-System. Hierfür bietet ISO 14971 Orientierung.
Inwiefern es für dieses Risikomanagement nötig ist, neue klinische Daten zu generieren, hängt davon ab, ob Wahrscheinlichkeit und Schwere eines bestimmten Schadens oder die Wirksamkeit einer Risikokontrollmaßnahme dies erfordern.
Aus der klinischen Bewertung muss im Ergebnis hervorgehen, ob neue klinische Daten für die Zwecke des Risikomanagements erhoben werden müssen.
Nutzen-Risiko-Bestimmung
Nach der MDR muss der Nutzen eines Medizinproduktes immer in angemessenen Verhältnis zum Risiko stehen, das dieses Produkt für Patient:innen darstellt. Hierfür müssen Hersteller folgende Punkte bei der Datenerhebung berücksichtigen:
- Stand der Technik
- Alternative Behandlungsmöglichkeiten
Um diese zu bestimmen, sollen Hersteller etwa auch auf bereits veröffentlichte klinische Studien und Therapierichtlinien zurückgreifen.
Mangel an klinischen Daten
Mangelt es bei einem Bestandsprodukt an klinischen Daten, empfiehlt MDCG 2020-6:
- Zweckbestimmung des Produktes einschränken
- PMCF-Studien bis zur Zertifizierung unter MDR durchführen
- Bei gut etablierten Technologien (well-established technology) PMCF-Aktivitäten prüfen/auferlegen. In Ausnahmefällen reichen ein Qualitätsmanagement-System und Post-Market-Surveillance-Daten aus, jedoch mitunter nicht bei implantierbaren und Klasse III-Produkten (vgl. oben).
Äquivalenzprodukte
Auch Daten von Äquivalenzprodukten können als Beweis herangezogen werden. Äquivalenz (Gleichwertigkeit) muss jedoch gesondert nachgewiesen werden. Die Anforderungen der MDR an Äquivalenz sind allerdings so hoch, dass dieser Nachweis kaum noch erbracht werden kann.
Dennoch können Hersteller auf Daten ähnlicher (nicht äquivalenter) Produkte zurückgreifen.
- Daten von ähnlichen Produkten können auch wichtig sein, um festzustellen, ob das zu bewertende Produkt und ähnliche Produkte zu der Gruppe von Produkten gehören, die als „bewährte Technologien“ (WET) gelten.
- Daten von ähnlichen Produkten können beispielsweise verwendet werden, um die Allgemeingültigkeit der Auslegung, den Mangel an Neuheit, das bekannte Sicherheits- und Leistungsprofil einer generischen Gruppe von Produkten usw. nachzuweisen.
f) Abschnitte von MEDDEV 2.7/1 rev. 4, die unter der MDR noch relevant sind
Obwohl MEDDEV 2.7/1 rev. 4 nicht für die MDR erstellt wurde, ist das Dokument noch immer zumindest in Teilen auf die neue Verordnung anwendbar. MEDDEV 2.7/1 rev. 4 gibt konkrete Anweisungen, wie der Prozess der klinischen Bewertung zu strukturieren und durchzuführen ist.
Die MDCG 2020-6 listet konkret auf, welche Abschnitte von MEDDEV 2.7/1 rev. 4 noch auf die MDR anwendbar sind.
- 6.4. Who should perform the clinical evaluation?
- 8. Identification of pertinent data (Stage 1)
- 9. Appraisal of pertinent data (Stage 2)
- 10. Analysis of the clinical data (Stage 3). This chapter includes references to the MDD, MDR requirements should be used instead.
- A3. Device description – typical contents
- A4. Sources of literature
- A5. Literature search and literature review protocol, key elements
- A6. Appraisal of clinical data – examples of studies that lack scientific validity for demonstration of adequate clinical performance and/or clinical safety
- A7.2. Conformity assessment with requirement on acceptable benefit/risk profile
- A7.3. Conformity assessment with requirement on performance
- A7.4. Conformity assessment with requirements on acceptability of undesirable side-effects
- A10. Proposed checklist for the release of the clinical evaluation report
g) Hierarchie der klinischen Beweise
Die Leitlinie MDCG 2020-6 empfiehlt bei klinischen und nichtklinischen Datenquellen, die Hersteller zum Nachweis der Konformität ihres Bestandsproduktes nutzen können, folgende Hierarchie:
- Ergebnisse von qualitativ hochwertigen klinischen Untersuchungen für alle Gerätevarianten, Indikationen, Patienten-Populationen, Dauer des Behandlungseffekts etc.
- Ergebnisse von qualitativ hochwertigen klinischen Untersuchungen mit einigen Lücken
- Ergebnisse eines qualitativ hochwertigen klinischen Datenerhebungssystems (wie etwa Register)
- Ergebnisse aus Studien mit möglichen Fehlern, bei denen die Daten noch quantifizierbar und akzeptabel sind
- Äquivalenzdaten (zuverlässig /quantifizierbar)
- Bewertung des Stands der Technik einschließlich der Bewertung von klinischen Daten von ähnlichen Produkten
- Reklamationen und Vigilanzdaten; kuratierte Daten
- Proaktive PMS-Daten wie solche, die aus Umfragen stammen
- Einzelne Fallberichte über das Gerät
- Einhaltung der nichtklinischen Elemente der allgemein anerkannten Spezifikationen, die für die Sicherheit und Leistung der Produkte als relevant gelten
- Simulierte Nutzung, Tier- und Leichentests unter Beteiligung von medizinischen Fachkräften oder anderen Endverbrauchern
- Präklinische und klinische Prüfung/Einhaltung von Normen
4. Was Hersteller von Bestandsprodukten jetzt tun sollten
a) Übergangsfristen nutzen
Hersteller von Bestandsprodukten sollten die Übergangsfristen bis zur MDR-Konformitätserklärung nutzen, um ausreichend klinische Daten zum eigenen Produkt zu sammeln.
b) GAP-Analyse durchführen
Analysieren Sie die vorhandenen klinischen Daten bezüglich klinischer Evidenz für die MDR-Konformität.
Führen Sie im Rahmen der klinischen Bewertung eine GAP-Analyse (Lückenanalyse) durch, um einen etwaigen Mangel an klinischen Daten aufzudecken.
- Nicht jedes Produkt braucht automatisch eine klinische Prüfung oder PMCF-Studie. Ob und in welcher Form für ein Produkt klinische Daten überhaupt notwendig bzw. als Nachweis geeignet sind, sollte frühzeitig mit der klinischen Bewertung identifiziert werden.
- Im Allgemeinen müssen ausreichende klinische Nachweise vorliegen, um für die Bestandsprodukte vor der CE-Kennzeichnung im Rahmen der MDR die Sicherheit, Leistung und Annehmbarkeit der Nutzen-Risiko-Bestimmung in Bezug auf den Stand der Technik zu bestätigen.
c) PMCF-Aktivitäten etablieren
Beziehen Sie beim Etablieren der PMCF-Aktivitäten die Ergebnisse aus der GAP-Analyse der klinischen Bewertung ein.
d) Prüfen, ob Äquivalenz (noch) in Betracht kommt
Die Anforderungen an die Äquivalenzkriterien sind durch die MDR sehr hoch. So können bisher verwendete klinische Daten für das eigene Produkt ggf. nicht mehr verwendet werden. Prüfen Sie anhand der MDR-Kriterien, ob eine Äquivalenz noch in Betracht kommt.
5. Fazit
Die MDCG 2020-6 bietet eine wichtige Richtschnur für die Frage, wie die klinischen Daten für Bestandsprodukte beschaffen sein müssen, damit sie als Nachweis für die Konformität mit der MDR gelten. Das Dokument behebt außerdem einige Unklarheiten, die im Text der MDR bestehen.
Hersteller sollten die MDCG 2020-6 bereits zu Beginn der Übergangsfrist berücksichtigen. Zum einen gelten für sie bereits in der Übergangszeit die MDR-Anforderungen für Post-Market Surveillance einschließlich PMCF; zum anderen sollten sie die Übergangsfrist keinesfalls ungenutzt verstreichen lassen.
Die Anforderungen an klinische Daten, insbesondere an den Nachweis der Äquivalenz (Gleichwertigkeit), sind mit der MDR gestiegen. Die nötigen Aktivitäten sollten daher schnellstmöglich etabliert werden, um rechtzeitig eine ausreichende Datengrundlage zu schaffen.
Bei Fragen zur klinischen Bewertung oder zum Konformitätsbewertungsverfahren können Sie sich gerne an unsere Beratung wenden. Nutzen Sie dafür das Formular oder schreiben Sie eine E-Mail.
Möchten Sie mehr zur klinischen Bewertung erfahren? Dann melden Sie sich gleich hier zum Bootcamp an!




Guten Tag, Ihre Interpretation bzw. den Hinweis unter 3.g) kann ich nicht nachvollziehen. In der MDCG 2020-06 steht, dass Legacy Produkte Klasse III und implantierbare Legacy Produkte klinische Daten mindestens auf Stufe 4 haben sollten. Legacy Produkte, die unter well-established technologies fallen können für die klinischen Daten auch auf die Punkte 5-12 zurückgreifen. Die zuerst genannten Legacy Produkte (also Klasse III, implantierbar) können sich nicht auf Punkte 5-12 beschränken, sondern einer der Punkte 1-4 muss erfüllt sein. Richtig?
In Ihrem Hinweis steht: „Bestandsprodukte der Klasse III und implantierbare Bestandsprodukte, die nicht zu den etablierten Technologien gehören, sollten mindestens Nachweise auf Stufe 4 über ausreichende klinische Daten verfügen, und zwar durch eine Bewertung der kumulativen Evidenz aus zusätzlichen Quellen (5. bis 12.).“
Ist das nicht ein Widerspruch?
VG
A.B.
Sehr geehrte Dame/sehr geehrter Herr,
vielen Dank für den Hinweis!
Sie haben Recht, der Wortlaut wird geändert. Bei Bestandsprodukte der Klasse III und implantierbare Bestandsprodukte, die nicht zu den etablierten Technologien gehören, kommt die Bewertung der kumulativen Evidenz aus den zusätzlichen Quellen (5. bis 12.) hinzu.
Viele Grüße.