„Medical Writer“ haben einen festen Platz im Ökosystem der Medizinprodukte- und IVD-Hersteller. Dieser Artikel klärt,
- welche regulatorischen Anforderungen Medical Writer erfüllen müssen,
- was diese Personen tun und
- was gute Medical Writer ausmacht.
1. Zusammenfassung
Ein Medical Writer ist eine Person, die im Umfeld der Pharma- und Medizinprodukte Forschungsergebnisse sowie Hinweise zur Verwendung von Produkten und medizinische Informationen sammelt, bewertet sowie verständlich, wissenschaftlich korrekt und gesetzeskonform dokumentiert.
Medical Writing bezeichnet das Erstellen von wissenschaftlichen und technischen Dokumenten im regulierten medizinischen, medizintechnischen und pharmazeutischen Bereich.
2. Medical Writer: Die Tätigkeiten
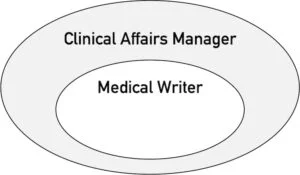
Im Umfeld der Medizinprodukte zählt das Medical Writing zu den Aufgaben der Clinical Affairs Manager. Es umfasst folgende Aufgaben:
- Systematische Literaturrecherche (Fokus auf den Stand der Technik und das zu bewertende Produkt)
- Systematische Be- und Auswertung der erhaltenen Daten/Treffer
- Erstellung von Dokumenten für die Technische Dokumentation (Fokus: Klinische Bewertung)
- Schreiben medizinischer Texte, bei denen regulatorische Anforderungen zu berücksichtigen sind, z. B. Patienteninformationen und Schulungsunterlagen
- Verfassen wissenschaftlicher Artikel
Das Aufgabenspektrum von Clinical Affairs Managern geht über das Medical Writing hinaus. Es schließt u. a. zusätzlich ein:
- Festlegung von klinischen Strategien
- Auswertung von präklinischen und klinischen Daten
- Spezifikation von Parametern und Akzeptanzkriterien für den Nachweis der Leistungsfähigkeit
Sie stehen noch am Anfang Ihrer klinischen Bewertung?
Unser Clinical Evaluation Jumpstart Kit hilft Ihnen, die ersten Schritte innerhalb der klinischen Bewertung Ihrer Medizinprodukte zu gehen und verschafft Orientierung, was konkret von Ihnen verlangt wird.
3. Der regulatorische Rahmen
Gesetze wie die MDR und die IVDR sowie Normen wie die ISO 13485 verpflichten einen Hersteller, die notwendigen Kompetenzen der Mitarbeitenden zu spezifizieren und zu gewährleisten. Sie stellen aber keine spezifischen Anforderungen an die Rolle Medical Writer.
Anforderungen an Medical Writer finden sich in Leitlinien wie der MEDDEV 2.7/1 rev. 4 sowie der geplanten MDCG-Leitlinie. Diese fordern als Voraussetzungen für die Autoren von klinischen Bewertungen:
- a degree from higher education in the respective field and 5 years of documented professional experience; or
- 10 years of documented professional experience if a degree is not a prerequisite for a given task.
An anderer Stelle wird noch spezifischer formuliert:
e.g. post-graduate experience in a relevant science or in medicine; training and experience in medical writing, systematic review and clinical data appraisal
Unabhängig von den Kompetenzanforderungen stellen die Gesetze Anforderungen an die klinischen Bewertungspläne und Berichte, d. h. an die Arbeitsergebnisse der Medical Writer.
4. Charakteristiken guter Medical Writer
Die Kompetenz von Medical Writer zeigt sich in der Güte der Arbeitsergebnisse und der Geschwindigkeit, mit der diese produziert werden.
Kennzeichnen guter Arbeitsergebnisse sind:
- Die Texte sind fachlich präzise sowie korrekt und erfüllen die regulatorischen Anforderungen.
- Die Analyse und Bewertung der (klinischen) Daten ist nachvollziehbar sowie verständlich und zeugt von einem systematischen, gründlichen und objektiven Ansatz.
- Die kritische Bewertung berücksichtigt die einschlägige derzeit verfügbare Fachliteratur über die Sicherheit, Leistung und Auslegungsmerkmale (MDR, Art. 61(3)).
So stellt es sich beim Besprechen des Stands der Technik im Rahmen des E-Learning-Kurses Medical Writer meist schnell heraus, ob jemand „nur“ wissenschaftlich fundiert schreiben kann (das gelingt meist gut), oder ob jemand auch die regulatorischen Anforderungen kennt und berücksichtigt.
Ein guter Writer beschreibt in der klinischen Bewertung den „State of the Art“ und formuliert ihn konform mit den Anforderungen der MDCG-Leitlinien (MDCG 2020-5 und 2020-13).
Erfahrene Medical Writer sind in der Lage, auch für viele Produkte in kurzer Zeit klinische Bewertungsberichte zu schreiben, dafür die Produkte geschickt zu gruppieren und Daten möglichst wiederzuverwenden.
Professionelle Medical Writer vermeiden diese häufigen Fehler:
- Die Recherche ist nicht nachvollziehbar.
- Die Systematik der Recherche ist nicht erkennbar (z. B. kein PICO-Schema verwendet).
- Der regulatorische Fokus der Recherche ist nicht erkennbar (z. B. geht es um den Stand der Technik spezifisch für das zu bewertende Produkt?).
- Die Bewertungskriterien wurden nicht festgelegt oder nicht angewandt.
- Die Evidenz der Ergebnisse ist nicht ausreichend begründet.
5. Fazit
Klinische Bewertungen stehen im Fokus der Behörden und Benannten Stellen. Das ist nicht überraschend, weil die klinischen Bewertungen alle Aussagen zur Sicherheit, Leistungsfähigkeit und Wirksamkeit von Medizinprodukten und IVD zusammenfassen und bestätigen – und damit die Konformität der Produkte.
Deshalb sollten die Hersteller die Kompetenz ihrer Medical Writer sicherstellen, beispielsweise durch Qualifizierungen, um das Wissen ins Unternehmen zu holen und um regulatorischen Ärger zu vermeiden.
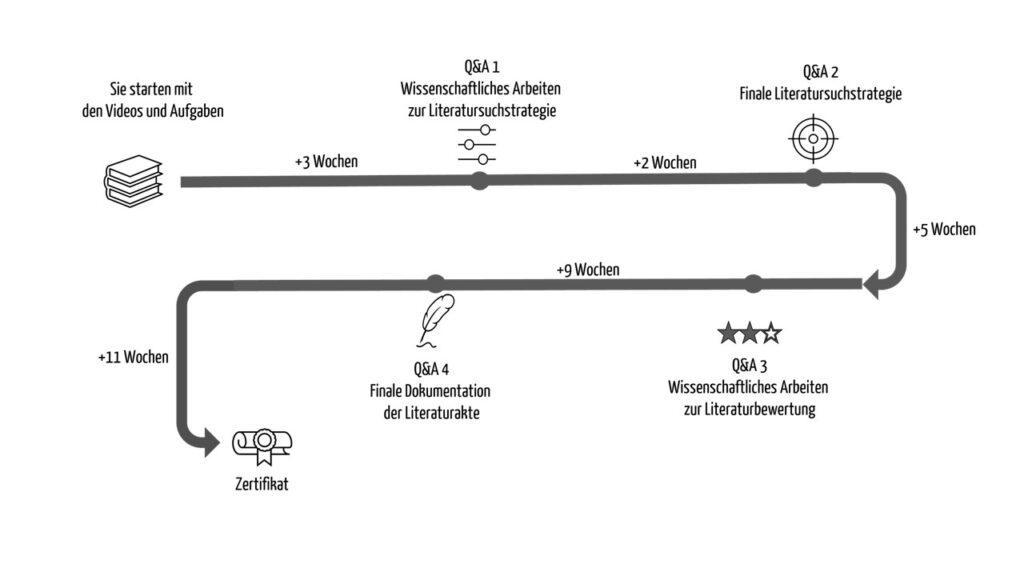
Das Johner Institut bildet Medical Writer aus. Es bietet unter anderem Seminare wie das Autoren-Seminar Klinische Bewertung an. Beim E-Learning-Kurs Medical Writer begleiten die Clinical Experts des Johner Instituts die (angehenden) Medical Writer durch vier Q&A-Sessions. Themen des Kurses sind:
- Regularien: MDR, MEDDEV 2.7/1 Revision 4, IMDRF MDCE
- WG/N56FINAL:2019, MDCG 2020-13
- PICO, PRISMA und weitere Methoden
- Relevanz- und Qualitätskriterien
- Literaturrecherche in PubMed, AWMF, Clinicaltrials.gov
- Sicherheitsdatenbanken
- MDR-konforme Dokumentation der Literaturrecherche (Blueprint: Protokoll und Bericht Literaturrecherche)