Weder das MPG noch die MDR treffen Regelungen zur Produkthaftung, also zur Haftung der Hersteller für Schäden, die aufgrund von Produktfehlern entstehen.
Hersteller sollten sich aber bewusst sein, dass viele Rechtsnormen den Geschädigten Anspruch auf Schadenersatz zubilligen, wenn ein fehlerhaftes Medizinprodukt Patienten, Anwender oder Dritte schädigt. Die Haftung kann sich beispielsweise ergeben aus:
- Deliktsrecht (§ 823 Abs. 1 und Abs. 2 BGB)
- Produkthaftungsgesetz (ProdHaftG)
- Vertragliches Schadensersatzrecht (z. B. § 280 BGB in Verbindung mit dem Vertrag)
Hohe Relevanz in der Praxis hat die Produkthaftung, die den Verbraucher (z.B. Patienten) bei Produktschäden schützt. Dieser Artikel geht auf die zivilrechtliche Produkthaftung nach dem Produkthaftungsgesetz ein.
Sie können den Entwurf der Produkthaftungsrichtlinie vom Januar 2024 hier herunterladen.
Der weitere Text dieses Artikels berücksichtigt diese Version des Entwurfs noch nicht.
1. Produkthaftung: Wer haftet wofür?
a) Wer haftet überhaupt?
Das Produkthaftungsgesetz regelt vor allem die Haftung des Herstellers. Darunter versteht man sowohl den tatsächlichen Hersteller als auch den Legal-Hersteller (den sog. „Quasi-Hersteller“).
Der Importeur wird mit einem Hersteller gleichgestellt, sofern die Einfuhr zum Zweck des Verkaufs, der Vermietung, des Mietkaufs oder zu einer anderen Form des Vertriebs mit wirtschaftlicher Zwecksetzung erfolgt (§ 4 Abs. 2 ProdHaftG).
Übernimmt der EU-Bevollmächtigte eines Herstellers eine dieser Aufgaben, was nach der MDR generell der Fall ist, so kann auch er nach dem Produkthaftungsgesetz haften. Denn das ProdHaftG kennt die Haftung mehrerer Hersteller nebeneinander (§ 5 ProdHaftG). Das bedeutet, dass man zusätzlich zu dem tatsächlichen Hersteller auch den EU-Bevollmächtigten verklagen kann. Dann haften beide gesamtschuldnerisch.
Ferner regelt das Produkthaftungsgesetz auch die Lieferantenhaftung, also die Haftung für Händler, sofern sich nicht ermitteln lässt, wer der Hersteller ist. Die MDR spricht von Händler, das Produkthaftungsgesetz von Lieferanten.
Die Labeling-Vorschriften der MDR helfen den Lieferanten bzw. Händlern, den tatsächlichen Hersteller zu identifizieren.
Der Haftungsanspruch richtet sich vor allem gegen die juristische Person, also das Unternehmen. Wann eine persönliche Haftung des Arbeitnehmers infrage kommt, erfahren Sie in diesem Artikel zur Arbeitnehmerhaftung.
b) Welche Schäden sind ersatzfähig?
Das Produkthaftungsgesetz zielt auf Schadensersatz bei Verletzung von Leben, Körper und Gesundheit sowie Sachen, sofern eine andere Sache als das fehlerhafte Produkt beschädigt wurde, die gewöhnlich für den privaten Ge- oder Verbrauch genutzt wird.
Die Haftung für sogenannte Nebenwirkungen ist nicht eindeutig geregelt. Gerade bei Medizinprodukten wird daher in Haftungsprozessen bei Nebenwirkungen die Übereinstimmung des Produkts mit den regulatorischen Anforderungen überprüft. Dabei werden vor allem das Nutzen-Risiko-Profil des Produkts und die dazugehörige Gebrauchsanweisung gutachterlich untersucht.
c) Abgrenzung zur Gewährleisung
Die Produkthaftung darf nicht mit der Gewährleistung verwechselt werden. Bei der gesetzlichen Produkthaftung haftet der Hersteller für Schäden an Leben, Körper und Eigentum, die durch Produktfehler entstehen. Diese Pflicht besteht auch ohne vertragliche Beziehung zwischen Geschädigtem und Hersteller.
Bei der Gewährleistung geht es um die Mangelfreiheit der Kaufsache. Die Gewährleistung ist die vertragliche Verpflichtung des Verkäufers, dass das Produkt frei von Sach- und Rechtsmängeln ist. Ein Beispiel ist ein Blutdruckmessgerät, das bereits bei Lieferung ungenaue Messwerte anzeigt – hier muss der Verkäufer das Gerät reparieren oder ersetzen.
Auch die Fristen unterscheiden sich: Bei der Gewährleistung sind es in der Regel zwei Jahre, bei der Produkthaftung zehn Jahre.
2. Produkthaftungsgesetz
a) Was versteht das Gesetz unter einem Produkt?
Ein fehlerhaftes Produkt kann vor allem eine bewegliche Sache sein (§ 2 ProdHaftG). Es zielt nicht nur auf Medizinprodukte ab, sondern kann vielmehr auch andere physische und nichtphysische Produkte umfassen (z.B. Elektrizität).
Der Produktbegriff ist nicht mit dem Begriff „Produkt“ der ISO 13485 gleichzustellen. Denn diese Norm subsumiert unter einem Produkt nicht nur physische Gegenstände und Software, sondern auch Dienstleistungen.
b) Was versteht das Gesetz unter einem Fehler?
Der Fehlerbegriff des Produkthaftungsgesetzes ist sehr weit gefasst. Ein Fehler liegt bereits vor, wenn das Produkt nicht die Sicherheit bietet, die unter Berücksichtigung aller Umstände berechtigterweise erwartet werden kann (§ 3 Abs. 1 ProdHaftG).
In der Praxis ist der Nachweis eines Fehlers Dreh- und Angelpunkt einer gerichtlichen Entscheidung. Zu den anerkannten Fehlertypen zählen:
- Konstruktionsfehler: Produkt erreicht bereits seiner Konzeption nach nicht den gebotenen Sicherheitsstandard
- Fabrikationsfehler: Abweichung im Rahmen der Produktion von dem durch den Hersteller selbst gesetzten Standard hinsichtlich Konstruktion und Qualität
- Instruktionsfehler: Unzureichende Aufklärung über die Art und Weise der Verwendung und die damit verbundenen Gefahren
Auch die Wirkungslosigkeit eines Produkts kann, wie ein begründeter Fehlerverdacht (sog. potenzieller Fehler bei fehlerhafter Produktserie oder -charge), zur Haftung führen.
Schäden, die auf eine unterlassene oder fehlerhafte Produktbeobachtung (z.B. eine unzureichende Post-Market Surveillance, PMS) zurückzuführen sind, sind zwar nicht nach dem Produkthaftungsgesetz, jedoch nach dem allgemeinen Deliktsrecht (§ 823 BGB) zu ersetzen.
Ein gutes PMS-System hilft dabei, die Erfüllung dieser Pflichten nachzuweisen. Es sollte nicht nur die selbst hergestellten Produkte berücksichtigen, sondern auch das entsprechende Zubehör (auch wenn dieses von einem anderen Hersteller stammt).
Beachten Sie in diesem Kontext auch das „Honda-Urteil“.
3. Weitere Regularien und Urteile
Neben dem Produkthaftungsgesetz gibt es eine Vielzahl weiterer Rechtsnormen und Gerichtsentscheide, die im Schadensfall herangezogen werden.
a) Relevante Regularien
Auf europäischer und nationaler Ebene sind besonders diese Regularien relevant:
- ProdHaftG
- BGB, insb. § 823 ff. BGB
- MDR und IVDR
- MPG bzw. MPDG
- MPSV
- MPBetreibV
Abhängig vom konkreten Produkt sind weitere Gesetze anwendbar, etwa die DiGAV, wenn die gesetzlichen Interoperabilitätsanforderungen nicht erfüllt sind und sich dadurch Schäden ergeben.
b) Relevante Urteile
Die Rechtsprechung bezieht sich zudem auf bereits erfolgte Gerichtsentscheidungen. Besonders relevant im Falle der Produkthaftung bei Medizinprodukten sind die folgenden Urteile:
BGH-Urteile
- 09.12.1986, Az. VI ZR 65/86 (Honda-Urteil): Produktnachbeobachtungspflichten des Herstellers, insb. hinsichtlich Zubehörteile von Drittherstellern
- 16.12.2008, Az.: VI ZR 170/07: Herstellerpflichten bei Produkten mit Sicherheitsmängeln
- 27.2.2020, Az.: VII ZR 151/18 (Deliktische Haftung für Folgen der Verwendung von PIP-Brustimplantaten)
OLG-Urteile
- OLG Saarbrücken, Urteil vom 3.8.2011, Az.: 1 U 316/10-89: Herstellerhaftung für Medizinprodukte – Teleskopmarknägel
- OLG Düsseldorf, Urteil vom 14.3.2012, Az.: I-15 U 122/10: Haftung des Vertriebshändlers von Medizinprodukten, insb. Warn- und ggf. Rückrufpflicht, MPSV-Pflichten
- KG Berlin, Urteil vom 3.4.2014, Az.: 20 U 253/12: Produkthaftung bei Kombinationen von Medizinprodukten
- OLG Schleswig, Urteil vom 29.8.2014, Az.: 4 U 21/13): Anwender- und Betreiberverantwortung für ein Medizinprodukt
- OLG Frankfurt, Urteil vom 13.1.2015, Az. 8 U 168/13: Anscheinsbeweis zulasten eines Medizinprodukteherstellers
EuGH-Urteile
- 5.3.2015, Az.: C-503/13, C-504/13 (Boston Scientific/AOK Sachsen-Anhalt): Produkthaftung für potenziell fehlerhaftes Medizinprodukt
- 16.2.2017, Az.: C-219/15 (Schmitt/TÜV Rheinland): Pflichten und Haftung der Kontrollstellen von Medizinprodukten
- 6.9.2018, Az.: C-346/17 P: Untersagung des Inverkehrbringens eines Medizinprodukts
Weitere Urteile
- LG Freiburg, Urteil vom 15.10.2018, Az.: 1 O 240/10: Schadensersatzansprüche aus Produkthaftung für fehlerhaftes Medizinprodukt – Hüfttotalendoprothese
4. Beweisführung bei der Produkthaftung
a) Grundsatz
Nach dem Produkthaftungsgesetz hat der Geschädigte den Produktfehler, den Schaden und den ursächlichen Zusammenhang zwischen Fehler und Schaden zu beweisen (§ 1 Abs. 4 S. 1 ProdHaftG).
Der Geschädigte muss dabei die Fehlerhaftigkeit des Produkts zum Zeitpunkt des Schadeneintritts beweisen. Er muss allerdings nicht nachweisen, wo und wann der Fehler entstanden ist. Vielmehr muss der Hersteller sich hinsichtlich der Sorgfaltspflichtverletzung entlasten, also darlegen, dass sein Produkt zum Zeitpunkt der Inverkehrbringung fehlerfrei war (§ 1 Abs. 2 Nr. 2 ProdHaftG).
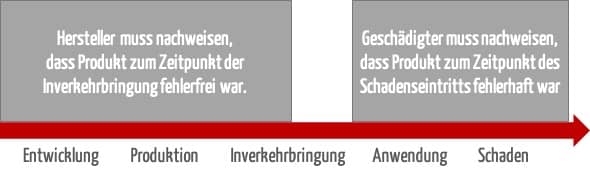
Oft wird hier von der Beweislastumkehr, sekundären Beweislast oder Beweiserleichterung gesprochen. Der Hintergrund für diese Erleichterung ist, dass dem Geschädigten i. d. R. kein Einblick in die Produktionsprozesse möglich ist. Er soll daher nur den objektiv fehlerhaften Zustand des Produkts nachweisen.
Der Hersteller muss sich sodann subjektiv von dem Verschuldensvorwurf entlasten. Einen sogenannten Vollbeweis muss er nicht erbringen. (Das Gericht muss also nicht voll überzeugt werden.) Es reicht aus, wenn „nach den Umständen davon auszugehen ist“, dass das Produkt zum Zeitpunkt des Inverkehrbringens fehlerfrei war.
b) Beispiele
Hüftendoprothese
Bei einer Hüftendoprothese kommt es bereits ein Jahr nach der Implantation zu einem Bruch.
Da es sich um eine gegossene Prothese handelt, führt der Geschädigte aus, dass der Bruch auf einen Gießfehler bei der Produktion zurückzuführen sei (z.B. Entstehung eines Lunkers, der eine Sollbruchstelle darstellt).
Der Hersteller muss im konkreten Fall nachweisen, dass die Produktion der konkreten Prothese fehlerfrei erfolgte und kein Gießfehler vorliegt. Dies erfolgt in der Praxis im Rahmen eines Sachverständigenbeweises, wird also durch die Einholung eines technischen Gutachtens geklärt.
Elektrokauter
Bei einer Operation mit einem Elektrokauter kommt es zu Verbrennungen beim Patienten sowie beim operierenden Arzt.
Der Patient trägt in dem gerichtlichen Verfahren vor, dass seine Verbrennungen auf unzureichender elektrischer Sicherheit des Elektrokauters beruhten.
Der Hersteller muss daher nachweisen, dass sein Produkt einwandfrei funktionierte und der Stand der Wissenschaft und Technik bei der Produktion eingehalten wurde. Er kann zudem vortragen, dass es zu einem Bedienungsfehler (sog. Anwenderfehler) gekommen und der Arzt daher für den Schaden des Patienten verantwortlich sei.
Die Beweisführung erfolgt auch hier unter Hinzuziehung eines Sachverständigen.
c) Besonderheiten bei Medizinprodukten
Die Beispiele zeigen, dass die Produkthaftung bei Medizinprodukten im Vergleich zu anderen Produkten Besonderheiten aufweist:
Medizinprodukte werden oft nicht nur von Patienten, sondern auch von Ärzten angewendet bzw. Medizinprodukte kommen nur unter Beteiligung eines Arztes mit dem Patienten in Berührung.
In solchen Fällen kann neben dem Produktfehler oder auch anstatt des Produktfehlers ein Arztfehler vorliegen, der den Schaden (mit)begründet. So ist auch im Hüftendoprothesen-Fall denkbar, dass die Prothese falsch implantiert wurde und der Bruch auf diesen ärztlichen Fehler zurückzuführen ist. Die Abgrenzung solcher Alternativursachen stellt in der Praxis eine große Herausforderung dar.
Professor Johner klärt im Gespräch mit dem auf Medizinprodukte und Produkthaftung spezialisierten Rechtsanwalt Boris Handorn unter anderem, welche regulatorischen Vorgaben Hersteller befolgen müssen, wer konkret haftet und worauf Hersteller achten sollten, um nicht verklagt zu werden.
Diese und weitere Podcast-Episoden finden Sie auch hier.
5. Berechnung der Haftungssumme
Bei Produktfehlern variieren die Haftungssummen von Fall zu Fall sehr stark. Sie hängen von den entstandenen Schäden ab und müssen immer individuell ermittelt werden.
a) Schmerzensgeld
In der Praxis richten sich die Schadenersatzforderungen vor allem auf Schmerzensgeld. Die Höhe eines Schmerzensgeldes richtet sich generell nach:
- Ausmaß der Verletzungen (Intensität der Schmerzen, Rekonvaleszenzzeit usw.)
- Mögliche Folgeschäden
- Beeinträchtigung des privaten oder beruflichen Lebens
- Alter des Geschädigten
- Schuldfrage (Grad der Verschuldung, evtl. Mitverschulden)
- Wirtschaftliche Situation der Beteiligten (Einkommen, Vermögen)
Liegt ein Dauerschaden vor, so muss stets mit höherem Schmerzensgeld gerechnet werden als bei vorübergehenden Verletzungen.
Der Tod stellt einen großen Verlust dar, begründet aber generell kein Schmerzensgeld, da dieses vor allem auf den Leidensweg abstellt. Erstattungsfähig sind nur die Kosten der versuchten Heilung, erlittene Vermögensnachteile, Bestattungskosten sowie der Unterhaltsschaden.
Die nahen Angehörigen (z.B. Ehegatte, Lebenspartner, Elternteil oder Kind) haben zudem einen Anspruch auf Ersatz des zugefügten seelischen Leids (sog. Schockschäden). Derartiges Schmerzensgeld wird aber in der Praxis selten mit einem Betrag über 10.000,00 € beziffert.
b) Verdienstausfall, Haushaltsführung
Dem Geschädigten steht Ersatz für den Verdienstausfall zu sowie für den Haushaltsführungsschaden. Dieser entsteht, wenn eine Person aufgrund der Verletzung den (Familien-) Haushalt nicht oder nur teilweise führen kann.
Begründet sind die Schäden allerdings nur, wenn sie auf einen Produktfehler zurückzuführen sind. Man spricht hier von der haftungsausfüllenden Kausalität.
c) Unterschiede zu den USA
In den USA werden viel höhere Schadensersatzsummen zugesprochen als in Deutschland. Das beruht auf den Unterschieden der beiden Rechtssysteme.
Das US-amerikanische System sieht neben dem Anspruch auf Schmerzensgeld und Schadensersatz noch einen Strafschadensersatz (punitive damages) vor, der besonders hoch ausfällt. Das deutsche Zivilrecht basiert dagegen auf einem Ausgleichsprinzip und verfolgt keine Straf- und Abschreckungszwecke. Strafrechtliche Aspekte spielen nur in einem Strafverfahren eine Rolle.
6. Tipps
a) Tipps für Hersteller
Eine MDR-/IVDR-konforme Entwicklung ist wesentlich, um Haftungsrisiken zu minimieren. Das betrifft insbesondere:
- Einhaltung der grundlegenden Sicherheits- und Leistungsanforderungen des Produkts
- MDR-/ISO-13485-konformes Qualitätsmanagementsystem
- Umfassendes Risikomanagementsystem
- Klinische Bewertung
- Systematische Post-Market Surveillance (PMS) für jedes Produkt
Im Rahmen der Post-Market Surveillance müssen die Hersteller die Rückmeldungen zu sämtlichen Abweichungen bezüglich Schweregrad und Wahrscheinlichkeit mit erwarteten Risiken abgleichen und entsprechend im Risikobericht dokumentieren.
Eine vollständige technische Dokumentation, die im Rahmen der Nachbeobachtung (PMS) regelmäßig aktualisiert wird, kann im Haftungsprozess die Beweisführung erleichtern.
Der Umfang der Daten und Informationen, die Hersteller im Rahmen der Post-Market Surveillance sammeln und bewerten müssen, nimmt ständig zu. Daher empfiehlt es sich, diese Tätigkeiten weitgehend zu automatisieren, wie es das Post-Market Radar beispielhaft tut.
Ferner sollten Hersteller die Meldepflichten der MPSV immer streng befolgen.
Hersteller können zudem eine Versicherung abschließen (ggf. mit Bezug auf die entsprechenden Anforderung in der MDR), auch wenn nicht jedes Risiko versicherbar ist. Die MDR fordert in Artikel 10 (16) auf, entsprechende Vorkehrungen zur Deckung eventueller Risiken zu treffen (keine Versicherungspflicht!). Auf das Medizinrecht spezialisierte Versicherungsunternehmen können den Hersteller bei der Ermittlung des richtigen Tarifs beraten.
Kommt es zu einem Haftungsfall, sollte professionelle juristische Unterstützung eingeholt werden. Dabei ist darauf zu achten, dass der Rechtsbeistand entsprechend spezialisiert ist und über Prozesserfahrung verfügt.
Oft hängt das Verfahren auch von dem Sachverständigen ab, dessen Gutachten die Anwälte ausführlich bewerten; oder sie müssen für den Gegenbeweis einen anderen Sachverständigen heranziehen. Bei speziellen Produktfehlerfragen ist es oft nicht einfach, einen Gutachter zu finden.
b) Tipps für Händler
Lieferanten bzw. Händler sollen die MDR/IVDR-Pflichten beachten, vor allem jene zum Labeling, um nicht aufgrund falscher Kennzeichnung in die „Quasi-Hersteller“-Haftung zu gelangen.
Die Pflichten an die Kennzeichnung benennt die MDR in Artikel 14 Absatz 2, mit Referenz auf Artikel 10 Absatz 11, der wiederum auf die Details im Anhang I Abschnitt 23 verweist.
Ist aus der Kennzeichnung nicht eindeutig erkennbar, wer der Hersteller des Medizinprodukts ist, so kann der Geschädigte den Lieferanten auffordern, den Hersteller zu benennen. Dieser Aufforderung sollte unbedingt innerhalb einer Monatsfrist nachgegangen werden, anderenfalls kann der Lieferant als Hersteller i.S.d. Produkthaftungsgesetzes in Anspruch genommen werden (§ 4 Abs. 3 ProdHaftG).
c) Tipps für Patienten
Kommt ein Patient aufgrund eines Medizinproduktefehlers zu Schaden, so ist es wichtig, dass er den Ablauf des Heilungsprozesses und alle etwaigen Schäden gut dokumentiert.
Auch der Patient sollte einen Anwalt aufsuchen, der auf Medizinproduktefehler spezialisiert ist. Nur ein erfahrener Spezialist kann einschätzen, ob ggf. auch ein Arzt bzw. Krankenhaus verklagt werden muss oder diesem der Streit verkündet werden soll.
7. Fazit, Zusammenfassung
Die Produkthaftung spielt eine große Rolle in der gerichtlichen Praxis und sollte von Medizinprodukteherstellern und anderen Wirtschaftsakteuren wie Importeuren und Händlern nicht unterschätzt werden.
Eine gute Dokumentation der unternehmensinternen Prozesse, insbesondere der Herstellung und der Post-Market Surveillance (PMS), die Risikomanagementakte und die Dokumentation des QM-Systems können in Haftungsprozessen eine entscheidende Rolle spielen.
Auch die technische Dokumentation eines Medizinprodukts sollte immer vollständig und korrekt sein und stets aktuell gehalten werden.
Falls Sie Unterstützung dabei wünschen, Ihre Verfahren und Unterlagen auf Stand zu bringen und die Wahrscheinlichkeit eines Haftungsfalls zu minimieren, können Sie sich an das Johner Institut wenden (z.B. über das Kontaktformular). Falls Sie Unterstützung in einem Rechtsstreit benötigen, hilft Ihnen die Fachanwältin Sonia Seubert gerne weiter.
Änderungshistorie
- 2025-04-09: Kapitel 1.c) mit der Abgrenzung zur Gewährleistung ergänzt
- 2024-02-20: Entwurf der Produkthaftungsrichtlinie vom Januar 2024 zu Beginn des Artikels eingefügt
- 2021-02-09: Artikel veröffentlicht




Hallo Johner-Team
Vielen Dank für diesen sehr informativen Beitrag und den Verweisen zu den Urteilen.
Hallo Herr Gretler,
vielen lieben Dank!
Sehr geehrtes Team des Johner Instituts, liebe Sonja Seubert,
im 2. Abschnitt Produkthaftungsgesetz, Teil B ist mir ein kleiner Fehler aufgefallen:
„Ein Fehler liegt bereits vor, wenn das Produkt die Sicherheit bietet, die unter Berücksichtigung aller Umstände berechtigterweise erwartet werden kann (§ 3 Abs. 1 ProdHaftG).“
müsste eher heißen: „… wenn das Produkt NICHT die Sicherheit bietet, …“ oder?
sonst ein toller Artikel, vielen Dank dafür
Sehr geehrter Herr Kaul,
vielen Dank für den Hinweis! Wir haben den Tippfehler korrigiert.
Sehr geehrte Frau Seubert, vielen dank für den Artikel.
Nun, das würde ja bedeuten, dass nur der legale Hersteller verklagt werden kann. Soweit ich informiert bin, kann aber auf der Seite des Zivilrechts jede private Person innerhalb des Unternehmens von Privatpersonen auf Schadensersatz verklagt werden. In Ihren Artikel geht es hauptsächlich darum, dass der Staatsanwalt ermittelt. Und hier kann es auch bei einem Todesfall dann Konsequenz die Geschäftsführer und / oder die nach Artikel 15 verantwortlichen Person haben.
VG Stefan Kieslinger
Sehr geehrter Herr Kieslinger,
der Artikel geht – wie im Vorwort angemerkt – auf die zivilrechtliche Haftung bei Produktschäden nach dem Produkthaftungsgesetz (ProdHaftG) ein. Strafrechtliche Konsequenzen und auch Haftung von privaten Personen haben wir in dem Artikel nicht beschrieben. Ausführungen zur Arbeitnehmerhaftung und auch der nach Art. 15 MDR verantwortlichen Person können Sie in unserem Beitrag zur Arbeitnehmerhaftung nachlesen (https://www.johner-institut.de/blog/regulatory-affairs/arbeitnehmerhaftung/). Hinsichtlich weiterer Fragen können Sie gerne mich direkt anschreiben: sonia.seubert@mazars.de.
Beste Grüße
Sonia Seubert
Sehr geehrte Frau Seubert,
ich bin über die Suche „Honda-Urteil, Post Marketing Surveillance“ auf dieser Seite gelandet und habe die detaillierten Ausführungen genau gelesen – vielen Dank dafür.
Was ich nicht gefunden habe, ist die Konsequenz, wenn ein Hersteller weiß, dass sein Produkt
fehlverwendet wird, d.h. für eine Anwendung, die im Beipackzettel explizit ausgeschlossen wird oder dass dort vermerkt ist, dass das Produkt für die genannte Anwendung ungeeignet ist.
Die Diskussion im Kollegenkreis kam auf, ob die massenhafte Anwendung der PCR-Tests für diagnostische Zwecke unter dem Apekt der PMS juristische Folgen für den Hersteller der Tests haben kann.
Vielen Dank und Grüße
Sehr geehrter Herr Fendt,
vielen Dank für diese spannende Frage, die in der Juristerei auch sehr heiß diskutiert wird. Generell ist es so, dass der Hersteller aufgrund seiner Produktbeobachtungspflichten immer reagieren muss. Bei erstmaligen Verstößen kann ein entsprechender Sicherheitshinweis genügen. Wird die Falschverwendung zum Regelfall, so kann der Hersteller z.B. die Zweckbestimmung des Produktes für diesen Fall erweitern (unter Berücksichtigung aller regulatorischen Konsequenzen) oder auch vom Markt zurücknehmen. Keinesfalls darf die Falschanwendung aber einfach nur hingenommen werden. Sofern Sie weitere Fragen haben, können Sie mich gerne auch direkt kontaktieren: sonia.seubert@mazars.de
VG
Sonia Seubert
Hallo liebes Johner-Team,
im Abschnitt 6a schreiben Sie, dass der Hersteller eine Haftpflichtversicherung abschließen muss. Dies geht aus Artikel 10 (16) MDR so explizit nicht hervor.
Selbstredend macht eine entsprechende Versicherung an der Stelle Sinn, mit einer ausreichenden Liquidität z. B. wäre die Forderung der MDR aber auch hinreichend erfüllt.
Ansonsten ein dickes Lob für all Ihre qualifizierten und fundierten Beiträge!
Viele Grüße
M. Herzog
info@qmr-consult.de
Hallo Herr Herzog,
vielen Dank für das aufmerksame Lesen und Ihr Kompliment. Es trifft zu, dass Art. 10 (16) MDR keine Versicherungspflicht auferlegt. Vielmehr reicht es aus, wenn entsprechende Vorkehrungen zur Absicherung der Risiken, z.B. durch Bildung von ausreichenden Rücklagen getroffen werden. Wir haben nun explizit darauf hingewiesen, dass keine Versicherungspflicht besteht, um Missverständnisse zu vermeiden.
Beste Grüße
Sonia Seubert
Sehr geehrte Frau Seubert,
vielen Dank für Ihren ausführlichen Beitrag zu dieses Thema.
Sie Schreiben, dass Schäden, die auf eine unterlassende oder fehlerhafte Produktbeobachtung (z.B. eine unzureichende Post-Market Surveillance) zurückzuführen sind, nicht in dem Produkthaftungsgesetz berücksichtigt werden. Das finde ich auch zurück in dem Schaubild in Abb. 1 – „Hersteller muss nachweisen, dass Produkt zum ZEITPUNKT DER INVERKEHRBRINGUNG fehlerfrei war“
An der Stelle verweisen Sie auf dem allgemeinen Deliktsrecht (§823 BGB).
Es wird rundum Medizinprodukte oft über die Beweislastumkehr gesprochen. Denn wie soll der Nutzer als Leihe einen fehlerhafte Zustand eines Produkts, auch nach dem Inverkehrbringen, erkennen.
Jetzt möchte ich mich nochmal rückversicherern, ob ich die von Ihnen dargestellte Rechts- und Gesetzeslage so richtig auslege:
– In der MDR (und MPDG?) sind keine Inhalte zu der Beweislastumkehr verankert.
– Die Verankerung liegt nach Inverkehrbringen bei dem Produkthaftungsgesetz (ProrHaftG).
– Die Verpflichtung der PMS wird über das Deliktrecht (§ 823 Abs. 1 und Abs. 2 BGB) berücksichtigt, insbesondere durch folgenden Satz: „Die gleiche Verpflichtung trifft denjenigen, welcher gegen ein den Schutz EINES ANDEREN BEZWECKENDES GESETZ verstößt.“ (in diesem Fall MDR und MPDG).
Meine Fragen dazu sind folgende:
– Stimmt dieses Fazit?
– Was ist der Grund, dass das MDR als EU Verordnung keine Regelung für Produkthaftung getroffen hat?
– Gibt es im EU oder Deutsches Medizinprodukterecht zusätzliche Guidances zu dieses Thema?
Ich danke im Voraus herzlich für Ihre Rückmeldung.
Mit freundlichen Grüßen,
Hugo de Wit
Lieber Herr de Wit,
herzlichen Dank für Ihre Fragen! Sie müssten bereits eine Rückmeldung von Frau Seubert erhalten haben.
Gerne teile ich Ihnen ihre Antwort nochmal auf diesem Weg mit:
„Ihre Ausführungen sind zutreffend. Der europäische Gesetzgeber hat sich bei der Einführung der MDR, mit Ausnahme der Regelung der gesamtschuldnerischen Haftung des Herstellers und des Bevollmächtigten in Art. 11 Abs. 5 MDR, gegen eine Regelung der Haftung für fehlerhafte Medizinprodukte entschieden. Insbesondere wurde auch keine Haftungsregelung für PMS getroffen.
Die Beweislastregeln für fehlerhafte Medizinprodukte ergeben sich daher aus dem ProdHaftG und der Zivilprozessordnung (soweit es sich um Verstoße i.S.d
§ 823 i.V.m. MDR/MPDG handelt und dort keine besondere Beweislastverteilung normiert ist). Grundsätzlich muss im Prozess jeder die für ihn günstigsten Tatsachen beweisen. Meine Erfahrung als Prozessanwältin hat mir jedoch gezeigt, dass in der Praxis auch die Beweislastregeln des ProdHaftG nicht immer berücksichtigt werden. In der Regel wird auf Kosten des Geschädigten ein Sachverständigengutachten eingeholt, das sich mit allen in Betracht kommenden Fehlern befasst.
Mir persönlich sind keine europäischen oder nationalen Leitlinien zur Regelung der Beweislast bei Medizinprodukten bekannt. Natürlich finden sich in den juristischen Kommentaren und in der Rechtsprechung entsprechende Ausführungen und Erläuterungen.
Ich möchte Sie noch darauf hinweisen, dass die Produkthaftungsrichtlinie, auf der unser ProdHaftG basiert, im Zuge der Digitalisierung und der Regulierung von KI auf europäischer Ebene gerade „erneuert“ wird. Insbesondere sollen Regelungen für digitale Produkte aufgenommen werden.“
Ich hoffe, wir konnten Ihnen damit weiterhelfen.
Viele Grüße
Tea Bodrusic
Sehr geehrte Frau Seubert,
ich habe Ihren interessanten Artikle bis zu dem BGH Urteil bezüglich der Benannten Stelle (Brustimplantate) gelesen. Ist es richtig, dass dieser ganze Zertifizierungsaufwand bezüglich der MDR einzig und alleine dem Marktzutritt, also wirtschaftlichen Interessen, dient? Eine etwaige Führsorgepflicht bezüglich der Patienten ist völlig uninteressant und garnicht beabsichtigt. Es geht hier nur darum, die Hürden möglichst hoch zu halten, um Teilnehmer von dem Medizinprodukte-Markt fernzuhalten. Das ist eine absolut aggressive Politik der EU. Mit den Patienten hat das überhaupt nichts zu tun. In dem Zusammenhang kann ich es nicht verstehen, wenn bei einem Audit der Benannten Stelle auf Biokompatibilität und klinische Bewertung bestanden und geprüft wird, obwohl das garnicht Ziel der Zertifizierung ist. Und was ich schon vor Ihrem Artikel wußte: Eine Haftung des Herstellers ist in jedem Fall gegeben, unabhängig von irgendwelchen Zertifizierungen.
Mit freundlichen Grüßen
Dr. Wolfgang Willmann
Sehr geehrter Herr Dr. Willmann,
Freu Seubert hat mich die Antwort unten wissen lassen.
Mit den besten Grüßen, Christian Johner
„Sehr geeherter Herr Dr. Willmann,
vielen Dank für Ihren Kommentar. Die MDR-Zertifizierung dient in der Tat in erster Linie dem Marktzugang. Ihr Einwand zeigt wichtige Aspekte auf und ich schätze Ihre kritische Perspektive. Mit dem Hinweis auf die BGH-Rechtsprechung, die (auch) die mögliche Haftung der Benannten Stelle bestätigt, wollte ich aufzeigen, dass das deutsche Rechtssystem über das ProdHaftG hinaus zusätzliche Haftungsgrundlagen bereithält. Sie haben Recht, die Herstellerhaftung besteht unabhängig von „Zertifizierungen“, aber es ist wichtig zu betonen, dass „Zertifizierungen“ durchaus eine haftungsmindernde Wirkung haben können. Sie dienen als Nachweis, dass ein Hersteller die relevanten Sicherheits- und Qualitätsstandards eingehalten hat, was bei der Beurteilung von Haftungsfragen durchaus gewichtet werden kann.
Sollten Sie weitere Fragen haben, können Sie sich jederzeit gerne an mich wenden!
Mit freundlichen Grüßen
Sonia Seubert“