Die regulatorische Strategie festzulegen, zählt zu den zentralen Aufgaben der Regulatory-Affairs-Abteilungen bei Medizinprodukteherstellern.
Weshalb ist eine gute regulatorische Strategie so wichtig? Was müssen die Regulatory Affairs Experts tun? Antworten liefert dieser Artikel.
Mit unserem Starter Kit verschaffen Sie sich ergänzend zu Ihrer Strategie einen Überblick über alle notwendigen Regularien und Normen, sodass Sie Ihre Medizinprodukte und IVD schnell und sicher im EU-Markt zulassen können.
1. Was legt eine regulatorische Strategie fest?
a) Hintergrund
Hersteller von Medizinprodukten müssen eine Vielzahl an regulatorischen Anforderungen beachten, um ihre Medizinprodukte legal weltweit vermarkten zu können. Dazu zählen
- gesetzliche Anforderungen,
- normative Anforderungen und
- behördliche Leitfäden.
Diese unterscheiden sich weltweit, genauso die Zulassungsverfahren.
b) Ziele
Die regulatorische Strategie soll dazu beitragen, dass die Produkte schnell, sicher und ohne unnötige Aufwände in den Markt gebracht werden können.
Eine vollständigere Übersicht über die Ziele einer regulatorischen Strategie finden Sie weiter unten im Kapitel „Weshalb ist die regulatorische Strategie so wichtig?“.
Um dies zu erreichen, müssen die Hersteller Folgendes tun:
- Regulatorische Anforderungen und weitere Faktoren ermitteln, welche die Zulassung beeinflussen
- Regulatorisch relevante Entscheidungen treffen
Wie sich diese Aktivitäten gegenseitig beeinflussen (s. Abb. 1), wird im nächsten Teilkapitel weiter ausführt.
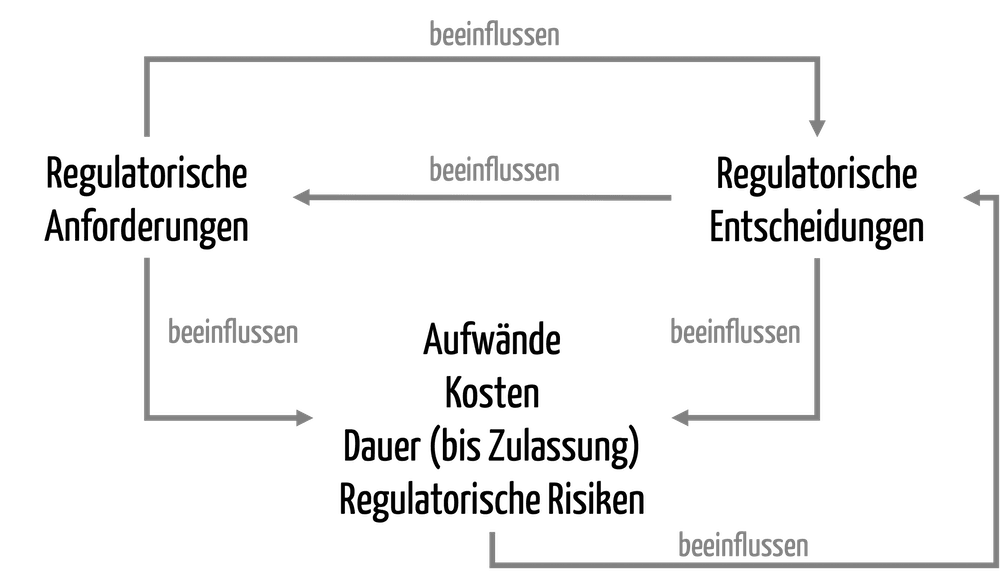
c) Zusammenspiel von regulatorischen Anforderungen und Entscheidungen
Bei der Entwicklung einer regulatorischen Strategie erhalten Hersteller Gewissheit über die regulatorischen Anforderungen an ihr Produkt. Diese Anforderungen hängen wiederum ab von den regulatorischen Entscheidungen, die sie treffen (s. Tab. 1).
| Regulatorische Anforderungen und weitere Faktoren | Beeinflussung durch regulatorische Entscheidungen (Beispiele) |
| Qualifizierung des Medizinprodukts | Zielland Zweckbestimmung Definition, was zum Produkt zählt Wahl Medizinprodukt vs. Zubehör |
| Risikoklassifizierung | (Einschränkung) der Zweckbestimmung (z. B. der Indikation) Definition, was zum Produkt zählt Einschränkung der Funktionalität Wahl der Technologie usw. |
| Weg zur Marktfreigabe (Zulassung, Registrierung), ggf. Sonderverfahren | Zielland Zweckbestimmung Auswahl des (möglichen) Verfahrens |
| Notwendige Unterlagen (Technische Dokumentation) | Gewähltes Verfahren |
| Identifikation von Äquivalenzprodukten | Zielland Zweckbestimmung Definition, was zum Produkt zählt Gewähltes Verfahren |
| Notwendige (klinische) Daten bzw. klinische Studie | Zweckbestimmung Funktionalität, Technologie Gewähltes Verfahren Gewähltes Äquivalenzprodukt |
| Produktspezifische Anforderungen (Gesetze, Normen, Leitlinien etc.) | Zielland Zweckbestimmung Funktionalität, Technologie Gewähltes Verfahren |
| Gebrauchsanweisung, Labeling | Zielland Zweckbestimmung |
| QM-Systeme einschließlich Post-Market Surveillance | Zielland |
d) Weitere regulatorische Entscheidungen
Hersteller treffen einige Entscheidungen, um die regulatorischen Anforderungen zu beeinflussen. Andere Entscheidungen wirken sich direkt auf die Aufwände, Kosten, Zulassungsdauern und regulatorischen Risiken aus:
- Reihenfolge der Märkte, in welche die Produkte in Verkehr gebracht werden sollen
- Kombinierte Zulassung von mehreren Produkten bei einem Zulassungsverfahren
- Wahl der (lokalen) Partner (z. B. für die Registrierung und Zulassung)
- Interaktion mit der Behörde (z. B. durch Nutzen des Q-Submission-Programms)
2. Weshalb ist die regulatorische Strategie so wichtig?
Eine passende regulatorische Strategie ist für die Unternehmen aus sechs Gründen unentbehrlich:
| Bedeutung, Vorteil | Erläuterung, Beispiele |
| 1. Planbarkeit von Kosten und Dauer | Eine Planung ist notwendig, um die notwendigen Ressourcen bereitzustellen und Umsätze abschätzen zu können. Sie ist damit ein wichtiger Input für Business- und Vermarktungspläne. |
| 2. Regulatorische Klarheit | Wenn die Unternehmensführung Klarheit hat über die regulatorischen Anforderungen, kann sie strategische Entscheidungen treffen, z. B. über die internationale Vermarktung. |
| 3. Minimierung von Zeit und Kosten | Durch Anpassung der Zweckbestimmung, die Zusammenfassung von Zulassungsverfahren und die Berücksichtigung von Abhängigkeiten können interne und externe Aufwände (z. B. für das Sammeln klinischer Daten) und Kosten minimiert und Zulassungsverfahren beschleunigt werden. |
| 4. Schnelle Umsätze | Je früher ein Produkt in den Markt kommt, desto schneller können Hersteller Umsätze generieren. Bei neuen Produkten sind die Umsätze meist hoch, solange die Konkurrenz noch nicht aufgeholt hat. |
| 5. Minimieren regulatorischer Risiken | Eine fehlerhafte Strategie kann schwerwiegende Folgen haben. Wenn der Hersteller erst während des Zulassungsverfahrens von der Behörde in Kenntnis gesetzt wird, dass der gewählte Zulassungsweg nicht funktioniert, verliert er Zeit und Geld, und die Konkurrenz überholt. |
| 6. Planbarkeit der Entwicklung | Ohne Kenntnisse von landesspezifischen Anforderungen zu Beginn der Entwicklung, besteht die Gefahr, dass im Nachhinein Änderungen am Produkt notwendig werden oder zusätzliche Prüfungen durchgeführt werden müssen. |
Die Schlussfolgerung lautet, dass eine regulatorische Strategie wesentlich für die Wettbewerbsfähigkeit des Unternehmens ist. Entsprechend hoch ist die Verantwortung der Regulatory Affairs Experts.
3. Wie gelangt man zu einer regulatorischen Strategie?
a) Expertise sicherstellen
Eine regulatorische Strategie zu definieren, ist keine triviale Aufgabe. Der Prozess verlangt ein großes Maß an Expertise, sowohl in produktspezifischer Hinsicht (z. B. bezüglich des medizinischen Zwecks oder der eingesetzten Technologien) als auch in regulatorischer und klinischer Hinsicht.
Je nach Zielland impliziert dies auch sprachliche Expertise, denn in vielen Ländern liegen die gesetzlichen Vorgaben nur in Landessprache vor.
Im Idealfall bilden Sie ein Team bzw. haben Zugriff auf Produktmanagement, klinische Experten, Regulatory Affairs und QM.
Falls diese Expertise nicht in ausreichendem Maß vorhanden oder verfügbar ist, um eine belastbare regulatorische Strategie festzulegen, dann holen Sie sich externe Unterstützung wie die des Johner Instituts dazu.
b) Frühzeitig beginnen
Starten Sie rechtzeitig mit der Erarbeitung der Strategie, am besten sehr früh im Produktentstehungsprozess. Wenn Sie von Anfang an die regulatorischen Anforderungen der Zielländer kennen, können Sie das Produkt so entwickeln, dass die landesspezifischen Anforderungen bereits auf Anhieb erfüllt und Produktprüfungen länderübergreifend kombiniert werden. Somit ersparen Sie sich später zusätzliche Prüfungen oder Studien.
c) In der richtigen Reihenfolge vorgehen
Input sammeln
Als Input für die Strategie dienen:
- Produktbeschreibung, einschließlich der Zweckbestimmung
- Liste der Zielländer
- Technische Dokumentation, falls vorhanden
- Informationen über bereits vorhandene Zulassungen
Qualifizierung und Klassifizierung durchführen
Starten Sie auf oberster Ebene und bestimmen Sie pro Zielland die Qualifizierung, die Klassifizierung und mögliche Zulassungsverfahren
Zweckbestimmung ggf. anpassen
Diskutieren Sie die Zweckbestimmung und Claims. Falls es Möglichkeiten gibt, ein weniger komplexes Zulassungsverfahren zu wählen, dafür aber im Gegenzug die Zweckbestimmung angepasst werden muss, sollten Sie dies mit Ihren klinischen Experten besprechen.
Generell hat die Zweckbestimmung einen Einfluss auf die notwendigen klinischen Nachweise. Betrachten Sie deshalb die klinischen und regulatorischen Anforderungen nie getrennt, sondern erarbeiten Sie eine kombinierte Zulassungsstrategie. Nur so haben Sie Gewissheit, dass Sie nicht auf unerwartete regulatorische Hürden stoßen.
Landesspezifische Anforderungen ermitteln
Ermitteln Sie im nächsten Schritt die landesspezifischen regulatorischen Anforderungen. Vergleichen Sie diese und ermitteln Sie die Unterschiede und Gemeinsamkeiten (z. B. bezüglich der grundlegenden Anforderungen).
Zusammenfassung für das Management erstellen
Bereiten Sie Ihre Ergebnisse und die wichtigsten Informationen für das Management auf, z. B. als Präsentation oder Management Summary. Eine regulatorische Strategie kann sehr umfangreich werden!
d) Strategie regelmäßig überprüfen
Überprüfen Sie Ihre regulatorische Strategie in regelmäßigen Abständen. Passen Sie sie an, wenn sich Änderungen ergeben, seien es technologische, regulatorische oder solche, die durch einen übergeordneten Businessplan entstehen.
4. Fazit und Zusammenfassung
Die regulatorische Strategie ist eine unverzichtbare Grundlage für den Marktzugang und somit für den unternehmerischen Erfolg. Eine mangelhafte Strategie kann im schlimmsten Fall das Aus bedeuten, wenn Sie z. B. durch einen falschen Zulassungsweg Zeit und Geld verlieren und die Konkurrenz schneller ist.
Legen Sie deshalb großen Wert auf die Entwicklung einer regulatorischen Strategie. Nehmen Sie sich die Zeit für die Erarbeitung und beginnen Sie damit möglichst früh im Produktentstehungsprozess.
Wenn Sie nicht über die notwendige Expertise verfügen oder Sie eine zweite Meinung wünschen, dann helfen Ihnen unsere regulatorischen und klinischen Experten gerne bei der Erarbeitung oder Überprüfung Ihrer Zulassungsstrategie.


