Die SSCP (“Summary of Safety and Clinical Performance”) ist nicht der einzige Bericht, den die MDR von vielen Medizinproduktehersteller einfordert. Mit dem PSUR und dem PMS-Report hat die SSCP sogar inhaltliche Überschneidungen.
Die IVDR stellt mit dem SSP („Summary of Safety and Performance“) fast identische Anforderungen.
Wie grenzen sich all diese Berichte voneinander ab? Wie können Hersteller Doppelarbeit und unnötige Aufwände vermeiden? Dieser Artikel gibt Antworten sowie sieben plus einen Tipp.
1. SSCP / SSP: Weshalb noch ein Bericht?
Die SSCP (“Summary of Safety and Clinical Performance”) bzw. SSP einerseits und der PSUR (“Periodic Safety Update Report”) andererseits berichten zwar beide über die Sicherheit. Sie haben aber unterschiedliche Ziele, Empfänger und Vorgaben dazu, wann und wie sie erstellt und aktualisiert werden müssen (Tabelle 1).
| SSCP, SCP | PSUR | |
| Empfänger, Zielgruppe | Öffentlichkeit (über EUDAMED) z.B. Fachanwender, ggf. Patienten | Intern, Benannte Stellen, Behörden |
| Ziel | Informieren z.B., um über den Kauf oder Einsatz des Produkts zu entscheiden | Post-Market-Surveillance-Daten konsolidieren, um über Maßnahmen entscheiden zu können |
| Verpflichtend bei | Implantierbare Produkte, Medizinprodukte der Klasse III sowie IVDs der Klassen C und D | Medizinprodukte der Klassen IIa, IIb und III sowie IVDs der Klassen C und D |
| Aktualisierung | Keine Vorgaben, typischerweise parallel mit PSUR (min. jährlich), wenn neue (klinische) Daten vorliegen | Bei Klasse IIa min. jedes zweite Jahr, bei Klassen IIb und III sowie bei IVDs min. jährlich |
| Sprache | Sprachen der EU-Mitgliedsstaaten, in denen das Produkt verkauft werden soll. Immer auch Englisch | Typischerweise Englisch oder die Sprache des Herstellers |
Den Herstellern wird mit dem SSCP, dem Kurzbericht über Sicherheit und klinische Leistung, (bzw. dem SSP bei den IVD-Herstellern) ein zusätzlicher Bericht aufgebürdet. Gleichzeitig ermöglicht er den Herstellern, die Informationen für die Öffentlichkeit zielgruppenspezifischer zu steuern und formulieren.
2. Was müssen SSCP / SSP enthalten?
a) Inhalte gemäß MDR und IVDR
Bei der Auswahl der Inhalte unterliegen die Hersteller den gesetzlichen Anforderungen. Diese legen die MDR im Artikel 32 bzw. die IVDR im Artikel 29 wortgleich fest. Demnach müssen die SSCPs umfassen:
- die Identifizierung des Produkts und des Herstellers einschließlich der Basis-UDI-DI und — falls bereits ausgestellt — der SRN;
- die Zweckbestimmung des Produkts und sämtliche Indikationen, Kontraindikationen und Zielgruppen;
- eine Beschreibung des Produkts einschließlich eines Hinweises auf etwaige frühere Generationen oder Varianten und eine Beschreibung der Unterschiede sowie gegebenenfalls eine Beschreibung des gesamten Zubehörs, anderer Produkte sowie von Produkten, die für eine Verwendung in Kombination mit dem Produkt bestimmt sind;
- mögliche diagnostische oder therapeutische Alternativen;
- einen Hinweis auf alle angewandten harmonisierten Normen und GS;
- die Zusammenfassung der klinischen Bewertung gemäß Anhang XIV und einschlägige Informationen über die klinische Nachbeobachtung nach dem Inverkehrbringen;
- das vorgeschlagene Profil und die Schulung der Anwender;
- Angaben zu möglichen Restrisiken und unerwünschten Wirkungen, Warnhinweise und Vorsichtsmaßnahmen.
b) Vorgaben der MDCG
Die MDCG gibt in der Leitlinie MDCG 2019-9 eine Kapitelstruktur für die SSCP vor, analog die MDCG 2022-9 eine Kapitelstruktur für die SSP. Letztere unterscheidet dabei zwischen Produkten zur Selbsttestung (wendet sich direkt an die Patienten/Laien) und nicht zur Selbsttestung (wendet sich an professionelle Anwender und ggf. an Patienten/Laien) .
Die von der MDCG vorgeschlagene Kapitelstruktur spezifiziert die Inhalte noch genauer, welche die MDR bzw. IVDR einfordern. Eine vereinfachte Darstellung zeigt die Abbildung 1.
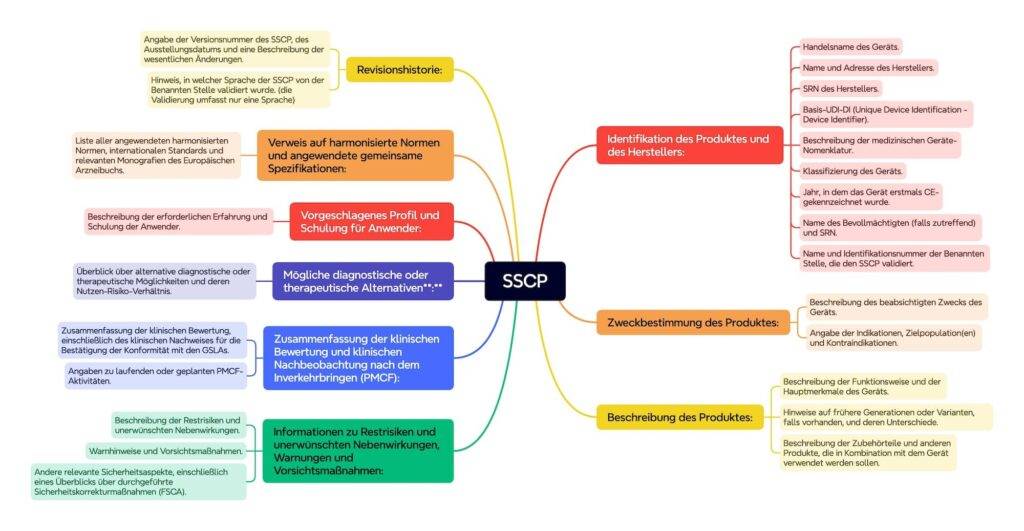
3. Woher stammen die Daten?
Die Inhalte welche der Kurzbericht über Sicherheit und klinische Leistung (SSCP) bzw. der SCP zusammenfasst, stammen fast ausschließlich aus der Technischen Dokumentation (s. Abb. 2).
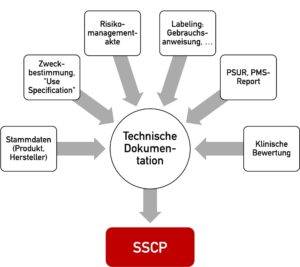
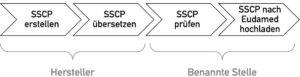
Die IVD- und Medizinproduktehersteller sind verpflichtet, den SSP bzw. SSCP in die relevanten Sprachen der EU-Zielländer zu übersetzen, in denen das Produkt vermarktet werden soll.
Alle Versionen schicken die Hersteller dann zu ihrer jeweiligen Benannten Stelle, welche eine(!) Sprachversion prüft. Dabei hat die Benannte Stelle einen Blick darauf, ob die Daten im Kurzbericht tatsächlich mit den Daten in der TD übereinstimmen. Beispielsweise vergleicht sie die Angaben in den V&V Berichten, dem Risikomanagement, der klinischen Bewertung bzw. Leistungsbewertung, der Post-Market Surveillance, dem PMCF/PMPF und der IFU mit den Angaben im SSCP/SSP.
Im Erfolgsfall lädt die Benannte Stelle alle Sprachversionen in die EUDAMED hoch (s. Abb. 3).
4. Tipps für das Erstellen des SSCPs
Tipp 1: Beteiligen Sie die richtigen Personen
Der Kurzbericht zur Sicherheit und klinischen Leistung lässt sich als Essenz der Technischen Dokumentation für die Öffentlichkeit verstehen.
Am Erstellen dieses Kurzberichtes sollten die Expertinnen und Experten aus den folgenden Bereichen beteiligt werden:
- Clinical Affairs (wichtigste Rolle)
- Regulatory Affairs Manager (ggf. Legal)
- Quality Management, auch die PRRC
- Risk Management
- Product Management
Tipp 2: Aktualisieren Sie den Bericht zusammen mit dem PSUR
Sobald neue Daten vorliegen, sollte der SSCP aktualisiert werden. Das ist spätestens der Fall, wenn eine neue Version des PSUR („regelmäßig aktualisierter Bericht über die Sicherheit“) vorliegt.
Tipp 3: Vermeiden Sie Diskrepanzen zwischen TD und SSCP / SSP
Die Öffentlichkeit – dazu zählen auch die Wettbewerber – über alle Risiken und Probleme zu informieren, mag schwerfallen und dazu verleiten, die Daten zu „schönen“. Doch hier gilt ebenfalls: Ehrlichkeit währt am längsten.
Auch unbeabsichtigte Diskrepanzen sollten Sie vermeiden. Eine leicht andere Indikation oder unterschiedlich formulierte Sicherheitshinweise führen schnell zu unnötigen Diskussionen mit Benannten Stellen.
Es hat sich bei der Prüfung des SSCP/SSP bewährt, der Benannten Stelle neben dem Kurzbericht ein weiteres Dokument zur Verfügung zu stellen, das die Inhalte des SSP den entsprechenden TD-Dokumenten, inkl. Kapitel, gegenüber gestellt.
Tipp 4: Verwenden Sie eine klare Sprache
Im Gegensatz zu den klinischen Bewertungen bzw. Leistungsbewertungen sollte der SSCP bzw. SSP nicht wie eine wissenschaftliche Veröffentlichung mit vielen „Insider-Abkürzungen“ und (unverständlichen) Fachbegriffen formuliert, sondern auf die Zielgruppe zugeschnitten sein. Dazu zählen auch die Laien.
Ggf. hilft es, den SSCP / SSP in Bereiche für Laien und Fachanwender aufzuteilen. Bei IVDs ist dies durch die MDCG 2022-9 sogar vorgegeben.
Tipp 5: Sorgen Sie für eine professionelle Übersetzung
DeepL und Google Translate leisten großartige Dienste. Aber eine professionelle Übersetzung ersetzen sie nicht. Zumindest das „Fine-tuning“ des SSCPs / SSPs muss von einer Person durchgeführt werden, welche die Zielsprache ebenso beherrscht, wie sie die Inhalte versteht.
Unabhängig davon, in welchen EU-Länder Sie Ihr Produkt vermarkten wollen: Sie benötigen immer auch eine englische Version des SSCPs / SSPs.
Tipp 6: Nutzen Sie den Leitfaden MDCG 2019-9 bzw. 2022-9
Sie ersparen sich Diskussionen mit Ihrer Benannten Stelle, wenn Sie sich sowohl an die Kapitelstruktur als auch an die Inhalte halten, die der Leitfaden MDCG 2019-9 bzw. MDCG 2022-9 vorgeben.
Tipp 7: Vergessen Sie nicht, das Usability Engineering einzubinden
Den Kurzbericht sollten auch Laien verstehen. Damit haben Sie neben der Gebrauchsanweisung ein weiteres Dokument, das Sie bei der Prüfung der Gebrauchstauglichkeit berücksichtigen sollten, d.h. beispielsweise bei der summativen Bewertung.
Bonus-Tipp: Automatisieren Sie das Erstellen des SSCPs
Fast alle Informationen, welche der „Kurzbericht über Sicherheit und Leistung“ enthalten muss, stammen aus der Technischen Dokumentation. Oft sogar buchstabenidentisch. Daher besteht ein großer Teil der Arbeit im Kopieren, Strukturieren und Formatieren von Inhalten.
Das sind Aufgaben, die ein Computer in Sekundenbruchteilen fehlerfrei erledigen kann.
5. Fazit und Zusammenfassung
Für höherklassige Produkte ist der „Kurzbericht über Sicherheit und klinische Leistung“, auf englisch “Summary of Safety and Clinical Performance” (SSCP) Pflicht. Bei IVDs heißt dieser Bericht „Kurzbericht über Sicherheit und Leistung“ bzw. „Summary of Safety and Performannce“ (SSP). Beide bedeuten für die Hersteller dieser Produkte zusätzliche Aufwände.
Diese Berichte sorgen für Transparenz über die Risiken und die Wirksamkeit der Produkte. Das mag nicht allen Herstellern gefallen, zumal auch der Wettbewerb einen Einblick erhält.
Aber es gibt auch gute Nachrichten:
- Die Pflicht, einen SSCP zu veröffentlichen gilt nur für höherklassige Produkte.
- Für sichere und leistungsfähige Produkte entsteht durch den SSCP/SSP und die EUDAMED ein weiterer Kanal, über den die Hersteller die Qualität ihrer Produkte kommunizieren können.
- Dank der Leitlinien MDCG 2019-9 und MDCG 2022-9 herrscht Klarheit darüber, was der Bericht enthalten muss und wie er aufgebaut sein sollte.
- Für den Bericht müssen keine neuen Daten erhoben werden. Sie finden sich bereits in der Technische Dokumentation.
- Dank Digitalisierung lässt sich die Arbeit für das Erstellen der SSCPs bzw. SSPs minimieren.
Die Clinical-Affairs- und IVD-Teams des Johner Instituts helfen rund um den SSCP und SSP: Sie beantworten Ihre Fragen, schulen Ihr Kolleginnen und Kollegen, prüfen Ihre Kurzberichte und nimmt Ihnen auf Wunsch das Erstellen des SSCPs bzw. SSPs ganz ab.
Melden Sie sich. Hier finden Sie die Kontaktmöglichkeiten.


