Die IEC 61010-2-101 ist eine für In-vitro-Diagnostik (IVD) harmonisierte Norm. IVD-Hersteller können die IEC 61010 nutzen, um die Konformität mit den grundlegenden Sicherheit- und Leistungsanforderungen der IVD-Verordnung (IVDR) nachzuweisen.
Die IEC 61010-Familie
Anwendungsbereich
Die IEC 61010 ist eine Normenreihe, die Sicherheitsbestimmungen für elektrische Mess-, Steuer-, Regel- und Laborgeräte formuliert. Dabei ist der Begriff Labor nicht nur im medizinischen Sinn zu verstehen. Beispielsweise würden auch Geräte für ein Lebensmittellabor in den Anwendungsbereich der Normen-Serie fallen.
IEC 61010-1: Die Basisnorm
Die Basisnorm ist die IEC 61010-1. Sie formuliert die Anforderungen an elektrische(!) Geräte und deren Zubehör wie den Schutz vor elektrischem Schlag oder den Schutz vor mechanischen Gefährdungen.
IEC 61010-2-X: Die Partikularnormen
Die Partikularnormen stellen besondere Anforderungen an bestimmte Gerätetypen wie z.B.:
- IEC 61010-2-020: Laborzentrifugen
- IEC 61010-2-033: Handgehaltene Multimeter und andere handgehaltene Messgeräte […]
- IEC 61010-2-061: Laborgeräte zum Mischen und Rühren
- IEC 61010-2-081: (Semi-)automatische Laborgeräte für Analysen und andere Zwecke
- IEC 61010-2-101: In-Vitro-Diagnostik-(IVD)-Medizingeräte
IEC 61010-2-101: Besondere Anforderungen an IVD
Anwendungsbereich
Die IEC 61010-2-101 ist für Medizinprodukte harmonisiert, die unter die IVD-Richtlinie fallen, also für alle In-vitro-Diagnostika im Sinn der Definition in der IVD-Richtlinie.
Jedes Medizinprodukt, das als Reagenz, Reagenzprodukt, Kalibriermaterial, Kontrollmaterial, Kit, Instrument, Apparat, Gerät oder System — einzeln oder in Verbindung miteinander — nach der vom Hersteller festgelegten Zweckbestimmung zur In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben, einschließlich Blut- und Gewebespenden, verwendet wird und ausschließlich oder hauptsächlich dazu dient, Informationen zu liefern
- über physiologische oder pathologische Zustände oder
- über angeborene Anomalien oder
- zur Prüfung auf Unbedenklichkeit und Verträglichkeit bei den potentiellen Empfängern oder
- zur Überwachung therapeutischer Maßnahmen. […]
- Die Norm ist auch für IVD-Geräte anzuwenden, die von Laien (z.B. Patienten selbst) verwendet werden sollen.
Die Norm ist für Computer bzw. Software anzuwenden, die Teil eines Geräts sind, das explizit unter den Anwendungsbereich der Norm fallen bzw. explizit dazu entwickelt wurden, um mit solchen Geräten genutzt zu werden.
Anforderungen der IEC 61010-2-101
Die IEC 61010-2-101 ist vorgesehen, in Verbindung mit der Basisnorm (IEC 61010-1) verwendet zu werden. Sie adressiert die gleichen Aspekte wie die Basisnorm. Die Inhaltsverzeichnisse beider Normen sind identisch. Die Mindmap und die Tabelle unten stellen Ihnen das Inhaltsverzeichnis vor.
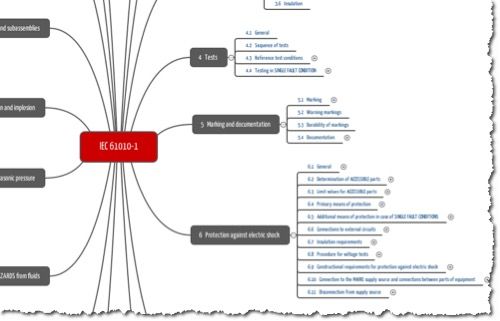
Die IEC 61010-2-101 formuliert nur die Deltas zur IEC 61010-1, in dem sie konkret angibt, welche Absätze zu ersetzen oder hinzuzufügen sind. D.h. sie kann ohne die Basisnorm nicht verwendet werden.
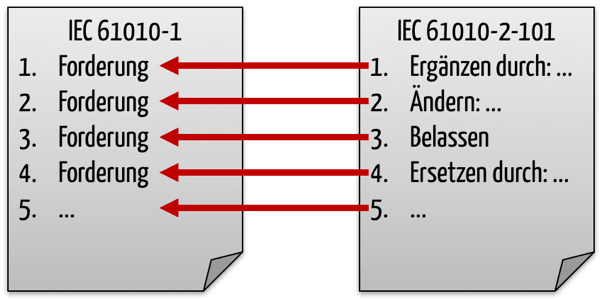
Viele Kapitel und Teilkapitel belässt die IEC 61010-2-101 unverändert und schreibt nur, dass das entsprechende Kapitel des Teils 1 anwendbar sei („This clause of part 1 is applicable“).
IEC 61010-1: Die Basisnorm
Schutz vor physikalischen Gefährdungen
Die IEC 61010-1 ist für elektrische Geräte anzuwenden. Entsprechend beschreibt die Norm Sicherheitsanforderungen, um physikalische Gefährdungen zu beherrschen wie:
- Elektrische Energie
- Elektromagnetische Energie (Laserstrahlung, UV-Strahlung)
- Thermische Energie, Feuer
- Mechanische Energie (Sturz, Explosion, scharfe Ecken, bewegte Teile, Ultraschall)
- Stoffe und Materialien (Gase, Flüssigkeiten)
Die Geräte müssen die Sicherheit gegen diese Gefährdungen gewährleisten. Unter welchen Bedingungen und wie das zu testen ist, beschreibt die Norm ebenfalls.
Gemeinsamkeiten mit und Unterschiede zur IEC 60601-1
Ähnlich wie die IEC 60601-1 adressiert die IEC 61010-1 die physikalischen Gefährdungen. Die Kapitelstruktur beider Normen lässt dies gut erkennen:
| IEC 61010-1 | IEC 60601-1 |
|---|---|
| 1 Scope and object | 1 Scope, object and related standards |
| 2 Normative references | 2 Normative references |
| 3 Terms and definitions | 3 Terminology and definitions |
| 4 General requirements | |
| 4 Tests | 5 General requirements for testing ME EQUIPMENT |
| 6 Classification of ME EQUIPMENT and ME SYSTEMS | |
| 5 MARKING and documentation | 7 ME EQUIPMENT identification, marking and documents |
| 6 Protection against electric shock | 8 Protection against electrical HAZARDS from ME EQUIPMENT |
| 7 Protection against mechanical HAZARDS | 9 Protection against MECHANICAL HAZARDS of ME EQUIPMENT and ME SYSTEMS |
| 8 Resistance to mechanical stresses | 9 Protection against MECHANICAL HAZARDS of ME EQUIPMENT and ME SYSTEMS |
| 9 Protection against the spread of fire | 11 Protection against excessive temperatures and other HAZARDS |
| 10 Equipment temperature limits and resistance to heat | 11 Protection against excessive temperatures and other HAZARDS |
| 11 Protection against HAZARDS from fluids | 9 Protection against MECHANICAL HAZARDS of ME EQUIPMENT and ME SYSTEMS |
| 12 Protection against radiation, including laser sources, and against sonic and ultrasonic pressure | 10 Protection against unwanted and excessive radiation HAZARDS |
| 13 Protection against liberated gases, explosion and implosion | 11 Protection against excessive temperatures and other HAZARDS |
| 14 Components and subassemblies | 15 Construction of ME EQUIPMENT |
| 15 Protection by interlocks | Chapter 9, … |
| 16 HAZARDS resulting from application | à IEC 62366 |
| 17 RISK assessment | 13 HAZARDOUS SITUATIONS and fault conditions for ME EQUIPMENT |
| 14 PROGRAMMABLE ELECTRICAL MEDICAL SYSTEMS (PEMS) | |
| 16 ME SYSTEMS | |
| 17 Electromagnetic compatibility of ME EQUIPMENT and ME SYSTEMS | |
| 12 Accuracy of controls and instruments and protection against hazardous output |
Die IEC 60601-1 ist für Medizinprodukte mit einem Anwendungsteil anzuwenden. D.h. sie gilt v.a. für Medizinprodukte, die zwangsläufig mit Patienten in Kontakt kommen. Hingegen geht die IEC 61010-1 davon aus, dass nur (gesunde) Anwender mit dem Gerät in Berührung kommen. Entsprechend niedriger sind die Anforderungen beispielsweise mit Bezug zu Ableitströmen.
Während die IEC 60601-1 selbst harmonisiert ist, wird die IEC 61010-1 nur über die harmonisierte Partikularnorm indirekt verpflichtend.




S.g. Prof. Johner,
besten Dank für Ihre Klarstellung! Ich hatte jüngst eine Diskussion über diese Unterschiede – und Ihr Kommentar zeigt, dass (salopp gesagt:) „nicht alles, was ein elektrisches Gerät ist, automatisch unter IEC 60601-1 fällt“.
Denken wir bspw. an einen Kühlschrank zur Aufbewahrung von menschl. Gewebsproben zur späteren IVD-Analyse: dieser ist mE ein elektrisches Gerät unter MDD, aber nicht unter IVDD (da ja nach Zweckbestimmung der Kühlschrank nur zur Lagerung von Probenbehältnissen dient und keinerlei Informationen für In-vitro-Untersuchungen liefert).
Wegen des fehlenden Anwendungsteils und direkten Patientenkontakts ist, wie ich Sie verstanden habe, die IEC 60601-1 nicht zwingend anzuwenden; wohl wäre daher die IEC 61010-1 für den Kühlschrank als elektr. Laborgerät zweckmäßiger anzuwenden.
MfG T. Friedl
Genau so sehe ich es auch.
Sehr geehrter Prof. Johner,
aufgrund des Datums der Veröffentlichung dieses interessanten Artikels vermute ich, dass Sie sich auf die neue 61010-2-101 vom Oktober 2017 beziehen?!
Dazu habe ich eine Frage bezüglich des Anwendungsbereichs dieser neuen Norm:
– bei den Änderungen gegenüber der Vorgänger-Norm (2003-09) steht zu lesen:
„a) Allgemeine Laborgeräte nach IEC 61010-2-081 „Besondere Anforderungen an automatische und semiautomatische Laborgeräte für Analysen und andere Zwecke“ wurden vom Anwendungsbereich ausgenommen. Damit sind Geräte nach IEC 61010-2-081 und Geräte nach IEC 61010-2-101 voneinander abgegrenzt.“
– an der entsprechenden Stelle im Normtext selbst (1.1.2) wird diese Aussage aber wieder relativiert:
„1.1.2 Vom Anwendungsbereich ausgenommene Geräte
Ergänzung:
Ergänze den folgenden Punkt:
aa) Erzeugnisse im Anwendungsbereich der IEC 61010-2-081, es sei denn, sie sind speziell vom Hersteller für ln-vitro-Untersuchungen vorgesehen.“
Dieser letzte Halbsatz verwirrt mich:
für alle Geräte, die unter die 61010-2-081 fallen UND ein IVD Produkt sind, gilt die 6101-2-101 offenbar doch, und die Ausnahme gilt nur für nicht IVD-Produkte.
Allerdings gilt die 61010-2-101 doch ohnehin nur für IVD-Produkte, wie schon der Titel dieser Norm aussagt: „Teil 2-101: Besondere Anforderungen an ln-vitro-Diagnostik (IVD)Medizingeräte“.
Damit sind doch alle nicht IVD-Produkte ohnehin vom Anwendungsbereich der 61010-2-101 ausgeschlossen und die nun in der neuen Version hinzugefügte Ausnahme ohne jeden Sinn, denn sie waren und sind von jeher ausgeschlossen gewesen?!
Zudem stimmt die getroffene Aussage, dass „Geräte nach IEC 61010-2-081 und Geräte nach IEC 61010-2-101 voneinander abgegrenzt“ sind so auch nicht mehr, denn für IVD-Produkte die unter die -2-081 fallen gilt ja zusätzlich auch die -2-101 (in der -2-081 gibt es keine Ausnahme vom Anwendungsbereich für IVD-Produkte).
Wie verstehen sie den neu (oder doch nicht neu?) definierten Anwendungsbereich der -2-101 in Bezug auf IVD-Produkte? Vielleicht können Sie mich ja etwas „entwirren“?
Vielen Dank und viele Grüße,
Martin Schroeder
Sehr geehrter Prof. Johner,
darf ich davon ausgehen, dass beim Erfüllen der EN 60601-1 automatisch auch die 61010-1 erfüllt ist oder muss eine solche Behauptung durch einen weiteren Test abgeprüft werden?
Danke
Stefan Klein
Lieber Herr Klein,
ich würde das genau so sehen. ich müsste nochmals durch alles durch. Aber generell ist die IEC 61010 eher eine Untermenge der IEC 60601-1, deren spezifischen Anforderungen auch strenger sind als die der Labornorm.
Wenn ich eine genaue Delta-Analyse machen soll, geben Sie einfach Bescheid.
Beste Grüße, Christian Johner