Die computerbasierte Modellierung und Simulation (CM&S) werden bei der Entwicklung und Zulassung von Medizinprodukten und für den Markterfolg vieler Hersteller zunehmend entscheidend.
Dieser Artikel
- verschafft eine Übersicht über die Möglichkeiten der Modellierung und Simulation,
- nennt Hürden und regulatorische Voraussetzungen,
- verlinkt die wichtigsten Quellen und
- gibt konkrete Tipps zum Einsatz speziell für Medizinproduktehersteller.
1. Was man unter Computer-based Modeling & Simulation versteht
a) Begriffsdefinitionen
Eine hilfreiche Definition der Begriffe „Computer-based Modeling“ bzw. „Computational Modeling“ stammt von der FDA selbst:
Computational modeling is the process of representing a real-world system by means of a computer and then running the simulation by implementing a numerical scheme.
Frontiers in Medicine, September 2018, Volume 5, Article 241 by Tina Morrision (FDA) et al.
Eine der Anwendungsmöglichkeiten dieser Modellierung und Simulation ist die „in silico medicine“. Diese lässt sich wie folgt definieren:
It is the direct use of computer simulation in the diagnosis, treatment, or prevention of a disease. More specifically, in silico medicine is characterized by modeling, simulation, and visualization of biological and medical processes in computers with the goal of simulating real biological processes in a virtual environment.
Quelle
b) Modellierung und Simulation in anderen Branchen
Der Einsatz von Computermodellen und Simulationen ist in anderen Branchen weit verbreitet:
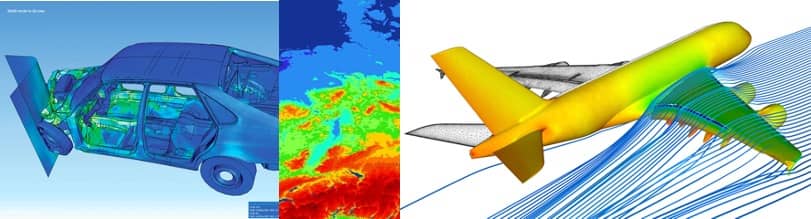
- Automobilhersteller simulieren Crashtests. Sie nutzen Crashtests mit echten Autos vornehmlich zur Validierung und Weiterentwicklung von Computermodellen.
- Die Entwicklung von Flugzeugen und die Überprüfung von deren Flugeigenschaften findet ausschließlich im Computer statt.
- Die Vorhersage des Wetters basiert auf Computermodellen.
- Die mechanischen Eigenschaften neuer Produkte berechnen Hersteller u.a. mit Hilfe der Finite-Elemente-Methode.
2. Einsatzgebiete in der Medizintechnik
Einsatzmöglichkeiten für computerbasierte Modellierung und Simulation bieten sich den Medizinprodukteherstellern in allen Phasen des Produktlebenszyklus.
a) Entwicklung von Medizinprodukten
Hersteller müssen die „gewählte Lösung“ begründen
Gesetze wie die MDR und IVDR verpflichten die Hersteller, die grundlegenden Sicherheits- und Leistungsanforderungen zu erfüllen. Dazu zählen Forderungen nach
- der mechanischen, elektrischen, elektromagnetischen und biologischen Sicherheit der Produkte,
- Zuverlässigkeit und Erstfehlersicherheit sowie
- Erfüllung der Leistungsmerkmale
Die Hersteller müssen begründen, weshalb sie eine bestimmte Lösung gewählt haben, z.B. eine bestimmte Konstruktion:
„The documentation shall […] include a justification […] of the solutions adopted to meet those [general safety and performance] requirements.
MDR Anhang II, Kapitel 4.
Solch eine Begründung wird besonders dann gelingen, wenn Hersteller aufzeigen können, dass andere Lösungen der gewählten Lösung unterlegen sind.
Modellierung und Simulation bieten sich dafür an
Ein sehr effizienter Weg dazu besteht darin, alternative Lösungen im Computer zu simulieren und die beste Option zu wählen. Diese Optionen betreffen:
- Auswahl von Materialien
- Gestaltung von Bauteilen, z.B. Form, Materialdicken
- Design und Positionierung von Antennen
- Gestaltung von User Interfaces

Doch nicht nur das Produkt selbst ist Gegenstand der Modellierung, sondern auch die Anatomie und die Physiologie der Patienten.

b) Produktion
Einige Hersteller nutzen computerbasierte Modellierung, um Produktionsprozesse zu simulieren, z.B.:
- Abfüllung von Produkten
- Sterilisierung und Desinfektion
- Gestaltung von Messständen
c) Verifizierung, Validierung und Zulassung
Auch der Nachweis, dass die Medizinprodukte sicher und leistungsfähig sind und den versprochenen klinischen Nutzen bieten, lässt sich mit Hilfe von Computermodellen ganz oder teilweise führen.
Die FDA hat in einigen Fällen die Zulassung von Medizinprodukten sogar ausschließlich auf Basis solcher Modelle und Simulationen ausgesprochen. Dazu zählt ein Produkt, dessen „Kernspin-Kompatibilität“ nachzuweisen war.
Weiter hat die FDA ein Gerät für die 3D-Mammographie zugelassen, dessen diagnostische Leistungsfähigkeit anhand synthetischer(!) Bilder bewertet wurde. Dazu simulierte der Hersteller sowohl die Brust (z.B. Größe, Fettanteil, Geometrie, Milchgänge, Gefäße, Läsionen) als auch das Medizinprodukt selbst.
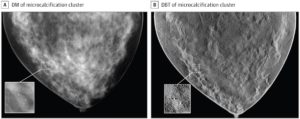
Damit wurde ein großer Teil der klinischen Prüfung durch die Simulation erbracht, also durch in-silico clinical trials.
d) Post-Market-Phase
Auch in der Post-Market-Phase, also nach der Inverkehrbringung, hilft die Simulation den Herstellern:
- Fehlerbilder im Feld lassen sich anhand von Computermodellen nachstellen und Ursachen identifizieren.
- Hersteller können schnell verschiedene Maßnahmen zur Fehlerbeseitigung ausprobieren und die beste Option wählen.
- Auch die Verifizierung und Validierung dieser Maßnahmen und damit der Wirksamkeitsnachweis für Behörden gelingt mit Modellen.
- Modelle helfen bei der Prognose künftiger Fehler. Hersteller sind damit in der Lage, auch Extremsituationen zu simulieren.
e) Zusammenfassung
Es gibt kaum eine Phase im Produktlebenszyklus, in der Modellierung und Simulation nicht zum Einsatz kommen können. Das sieht auch die FDA so.
3. Vorteile (nicht nur) für Medizinproduktehersteller
a) Beispiele
Die Vorteile von computerbasierter Modellierung und Simulation liegen auf der Hand:
- Die Entwicklung kann schneller erfolgen, weil keine physischen Prototypen mehr entwickelt werden müssen.
- Die Produkte sind sicherer, weil verschiedene Optionen ausprobiert und die beste Option gewählt werden kann.
- Die Produkte können auch unter Extrembedingungen getestet werden, was ebenfalls deren Sicherheit erhöht.
- Tierexperimente lassen sich minimieren oder sogar vermeiden.
- Teure Teststände werden teilweise durch Computermodelle ersetzt.
- Die Kosten und die Dauer für klinische Studien lassen sich minimieren.
- An klinischen Studien brauchen nicht so viele Patienten teilnehmen.
- Sicherheit und Leistungsfähigkeit lassen sich auch für Patienten nachweisen, die in ausreichender Anzahl nur schwer zu rekrutieren sind. Hier ist eine Erweiterung der Patientenkohorte um synthetische Patienten möglich.
b) Zusammenfassung
Die computerbasierte Modellierung verspricht somit viele Vorteile:
- Kürzere „Time to market“
- Niedrigere Kosten
- Sichere Produkte
- Weniger ethische Konflikte durch Tierversuche und klinische Prüfungen
Doch diese Methoden haben auch ihren Preis. Dazu weiter unten mehr.
In dieser Podcast-Episode stellt Dr. Simon Sonntag vor, wie digitale Zwillinge nicht nur die Geschwindigkeit bis zur Inverkehrbringung erhöhen, sondern auch in der Post-Market-Phase nützlich sind.
Er erläutert zudem ganz konkrete erste Schritte, welche die Medizinproduktehersteller gehen sollten.
Diese und weitere Podcast-Episoden finden Sie auch hier.
4. Regulatorische Anforderungen im Kontext von CM&S
a) Europa
Selbst die aktuellen Gesetze wie die MDR enthalten keine spezifischen Anforderungen an den Einsatz von Computermodellen bei der Entwicklung von Medizinprodukten. Sie sehen allerdings deren Einsatz und die Simulation explizit vor.
[…] gegebenenfalls die Ergebnisse von Untersuchungen an biophysikalischen oder anderen Modellen, deren Gültigkeit bereits erwiesen wurde; (Anhang I, 10.1.a))
[…] Ergebnisse von Tests wie technischen, Labor-, Anwendungssimulations- und Tiertests bzw. Versuchen […]; (Anhang II, 6.1.a))
[…] die vorklinische Erprobung, zum Beispiel Laboruntersuchungen, Erprobung der simulierten Verwendung, Computermodelle, […] Tiermodelle (Anhang VII, 4.5.4.a))
Die ISO 13485 verpflichtet die Hersteller zur:
- Computerized Systems Validation
- Prozessvalidierung
- Validierung von Messmitteln
- Planung von Überwachungs- und Messprozessen
- Verwendung angemessener statistischer Methoden
b) USA/FDA
Die FDA wurde vom US-Kongress verpflichtet, den Einsatz von CM&S zu fördern und zu regulieren. Die Behörde hat bereits im August 2011 das Dokument „Advancing Reglatory Science at FDA“ veröffentlicht. Darin hat sie „Use and develop computational methods and in silico modeling” als einen Schwerpunkt ihrer Arbeit erkoren.
Tina Morrision, die bei der FDA das Thema vorantreibt, hat 2018 in einer Publikation in „Frontiers in Medicine“ die Möglichkeiten des „Computational Modeling for Medical Devices“ und die notwendige „Regulatory Science“ erläutert.
Schon zuvor hatte sie das Guidance Document „Reporting of Computational Modeling Studies in Medical Devices Submission” maßgeblich entwickelt, das seit 2016 in einer finalen Version vorliegt.
Dieses Dokument beschreibt (wie der Name vermuten lässt), welche Dokumentation die FDA erwartet. Sehr spezifische Vorgaben zur Validierung der Modelle fehlen.
c) ASME V&V 40
Dafür verweist die FDA auf den „V&V 40“ der American Society for Mechanical Engineering (ASME) mit dem Titel „Verification and Validation of Computational Modeling of Medical Devices“.
Dieses Dokument beschreibt die Schritte, die Hersteller durchlaufen sollten, wenn sie Computermodelle validieren.
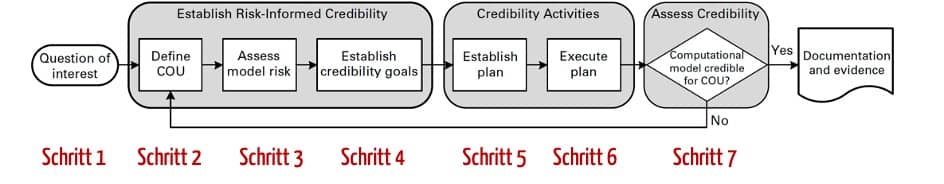
Zu diesen Schritten zählen:
- Question of Interest formulieren
Genau festlegen, welche Frage mit dem Modell beantwortet werden soll. Beispiel: „Wie viel Flüssigkeit soll ich Dialysepatienten entziehen?“ - Context of Use (COU) beschreiben
Der COU beschreibt, welche Rolle das Modell bei der Beantwortung der Frage spielt und was der spezifische Gegenstand des Computermodells ist. Beispiel: „Es sollen die Flüssigkeitskompartimente der Patienten simuliert werden, um die Hydrierung des Patienten abzuschätzen.“ - Risiken analysieren
Die Risiken sind bestimmt durch den Einfluss des Modells auf die Entscheidung des Herstellers und die Konsequenzen dieser Entscheidung. Beipsielsweise wäre der Einfluss des Modells größer, wenn sich der Hersteller ausschließlich auf das Modell verlässt. - Credibility Goals festlegen
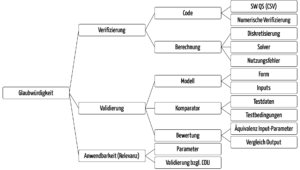
Hier beschreibt das Dokument der ASME zahlreiche Aspekte (s. Abb. 7), bezüglich derer die Hersteller Kriterien bestimmen müssen. Das reicht von der Analyse der Diskretisierungsfehler über die Angemessenheit des Modells und seiner Formeln und Konstanten bis hin zur Überprüfung des Komparators, mit dessen Hilfe das Modell validiert werden soll.
5. Der Einsatz von CM&S in der Praxis
a) Herausforderungen
Die Vorteile von Computermodellen bei der Entwicklung und Zulassung von Medizinprodukten sind offensichtlich. In der Praxis kämpfen die Hersteller jedoch mit zahlreichen Herausforderungen:
- Mangel an Fachkräften
Die Experten und Expertinnen sind rar gesät, die fähig sind, Computermodelle zu entwickeln und Medizinprodukte damit zu simulieren. - Regulatorische Unsicherheit
Weil die europäischen Behörden und Benannten Stellen die Regulatory Science nicht im gleichen Maß vorantreiben wie die US-Amerikaner, bleibt eine regulatorische Unsicherheit. Werden Simulationen und Validierung der Modelle anerkannt? Wie viele andere Nachweise werden erwartet? - Hohe Kosten der Werkzeuge
Es gibt viele Open-Source-Tools. Aber die haben meist nur einen sehr eingeschränkten Anwendungsbereich. Weiterhin fehlt der Support, die Validierung dieser Tools fehlt, und die Gebrauchstauglichkeit lässt Wünsche offen. Professionelle Werkzeuge hingegen können extrem teuer sein. - Hoher Aufwand für Entwicklung und Validierung der Modelle
Entwicklung und Validierung von Computermodellen sind aufwändig. Beispielsweise dauerte dies bei der 3D-Mammographie 1,75 Jahre. Jedoch hätte es ohne den Einsatz dieser Methode vier Jahre gedauert.
b) Nächste Schritte gehen
Wie bei jedem Aufbruch ins Unbekannte empfehlen sich die folgenden Best-Practices:
- Mit klarer und sehr begrenzter Fragestellung beginnen
- Personen einsetzen, die erste Erfahrungen und v.a. Freude an dem Projekt haben
- Hilfe holen, z.B. in Form von Beratung und Training
- Schnell aus Fehlern lernen und Fragestellungen, Methoden und Werkzeuge anpassen
- Nichts neu erfinden, auf Vorhandenes zurückgreifen: Dienstleister wie Cadfem Medical bieten „Simulation as a Service“ an und damit (vor-)validierte Modelle von Produkten und Menschen (Organen, Anatomie).
- Die Aufgeschlossenheit und das Angebot der FDA nutzen und der Empfehlung von Tina Morrision (FDA) folgen, die CM&S für Zulassungen zu nutzen.
Das Computer-based Modeling und die Simulation sind einerseits sehr leistungsfähige Hilfsmittel, um die Entwicklung, die Verifizierung, Validierung und Zulassung von Medizinprodukten zu beschleunigen. Aber alles hat seinen Preis. Jan Hertwig und Christian Johner beleuchten die Möglichkeiten und Herausforderungen.
Diese und weitere Podcast-Episoden finden Sie auch hier.
6. Zusammenfassung
a) Fast alternativlos – auch wegen neuer Wettbewerber
Es kann für die meisten Hersteller auf Dauer keine Frage sein, ob sie das computerbasierte Modellierung und Simulation bei der Entwicklung, Validierung und Zulassung ihrer Produkte einsetzen, sondern nur, wann.
Ohne diese Methoden wird es nicht gelingen, mit dem Wettbewerb Schritt zu halten. Wettbewerber sind nicht nur die bisherigen Firmen. Neue Unternehmen sowie Universitäten mit ihren Startups, die über Werkzeuge und Expertise in Bereich Modellierung und Simulation verfügen, werden neu in den Markt drängen.
b) Eine Frage der Ethik
Doch nicht nur der Wettbewerbsdruck sollte Hersteller veranlassen, sich auf den Weg zu machen. Patienten und Tiere unnötigen Versuchen und Risiken auszusetzen, ist schlicht unethisch.
Auch die FDA sieht hier Chancen:
[…] the all–in silico approach for conducting imaging trials is not intended to replace but rather complement or minimize traditional clinical trials. Incrementally incorporating computational results in regulatory submissions can, for example, help decrease the human trial size and length.
c) Hersteller, Behörden und Benannte Stellen sind gefragt
Das Maß, in dem Europa bei der „Regulatory Science“ vielen US-amerikanischen Initiativen im Bereich „Computer-based Modeling and Simulation“ hinterherhinkt, ist bedenklich. Hier wäre mehr Engagement von Behörden und Benannten Stellen wünschenswert.
Hersteller können sich in der Avicenna Alliance engagieren, um aktiv an der Gestaltung u.a. des regulatorischen Umfelds mitzuwirken.
Das Johner Institut wird noch intensiv Hilfestellung dabei geben, regulatorische Klarheit zu erlangen und die Modellierung und Simulation möglichst schnell und einfach nutzbar zu machen.
Bei weiteren Fragen wenden Sie sich gerne an das Johner Institut (Kontaktformular) oder Cadfem Medical.
Interessenserklärung: Das Johner Institut und Cadfem Medical haben bei der Keynote bei der MedConf 2020 zusammengearbeitet. Die Keynote bildet auch die Basis dieses Artikels. Es besteht keine kommerzielle Zusammenarbeit zwischen den beiden Firmen.
Änderungshistorie
- 2023-09-15: Ergänzung des Podcasts zu digitalen Zwillingen
- 2020-10-27: Erstellung des Fachartikels




