Mit einem Zytotoxizitätstest lässt sich eine Probe daraufhin überprüfen, wie stark diese die menschlichen Zellen schädigen oder sogar den Tod dieser Zellen verursachen kann. Normen und Gesetze verlangen von den Herstellern nachzuweisen, dass ihre Produkte nicht zytotoxisch sind.
Mit einem guten Testaufbau gelingt der Nachweis, ob eine Probe 100 % zytotoxisch, d.h. stark zytotoxisch ist, oder 0 %, d.h. nicht zytotoxisch. Hingegen kann ein ungeeigneter Testaufbau dazu führen, dass nicht nur die Zytotoxizität falsch bestimmt wird.
Vielmehr kann er damit auch zur Folge haben, dass zytotoxische Substanzen nicht erkannt werden, die womöglich auch irritierende, sensibilisierende oder im schlimmsten Fall kanzerogene/mutagene/reprotoxische (CMR) Eigenschaften aufweisen. Mit fatalen Konsequenzen für Patienten, Anwender und Dritte.
Daher ist ein sorgfältiger Aufbau des Tests unumgänglich. Wie das gelingt und welche 7 Powertipps bei der Auswahl des Labors helfen, erfahren Sie in diesem Artikel.
1. Begriffsdefinitionen und Grenzwerte
Die EN ISO 10993-1 definiert Zytotoxizität wie folgt:
Die EN ISO 10993-5 definiert auch die Grenzwerte und damit, wann ein Produkt/Material/Extrakt zytotoxische Effekte verursacht. Die Norm nennt zwei Kriterien, um zu bestimmen, ob eine Substanz als zytotoxisch zu klassifizieren ist:
„Eine Reduktion der Lebensfähigkeit von Zellen um mehr als 30 % wird als eine zytotoxische Wirkung angesehen.“
„Das Erreichen einer numerischen Gradeinteilung von mehr als 2 nach den Tabellen 1 und 2 wird als zytotoxische Wirkung angesehen.“
2. Quantitative und qualitative Auswertung
Dass es zwei Ansätze gibt, um festzulegen, wann etwas zytotoxisch ist, folgt aus den beiden Möglichkeiten zur Auswertung von Zytotoxizitätstests: der qualitativen Auswertung und der quantitativen Auswertung.
|
Bewertung |
Qualitative Bewertung |
Quantitative Bewertung |
|
Was |
Zellveränderungen, Wachstumshemmung |
Zelltod, Hemmung des Zellwachstums, Zellproliferation, Koloniebildung |
|
Womit |
Mikroskop | Assay/Färbung … (MTT, XTT, BCA, …) |
|
Wie | Visuelle Einschätzung | Proteinmenge, Freisetzung von Enzymen, Reduktion von Vitalfarbstoffen, … |
|
Ergebnisdarstellung | Klasse (0 bis 4) | Prozent (0 % bis 100 %) |
|
Grenzwert | > Klasse 2 | > 30 % |
Während die quantitative Auswertung meist auf Assays und eine Auswertung mittels Photometer setzt, erfolgt die qualitative Auswertung rein optisch mit dem Mikroskop. Bei der qualitativen Auswertung mittels Mikroskop wird der toxische Einfluss auf die Zellen visuell beurteilt. Die Einteilung erfolgt dabei in Klassen (grades).
|
Grad |
Reaktivität |
Zustand der Kulturen |
|
0 |
Keine | … keine Zellauflösung, keine Verringerung des Zellwachstums |
|
1 |
Gering | <= 20 % der Zellen sind rund, lose anhaftend … nur geringe Wachstumshemmung bemerkbar |
|
2 |
Leicht | <= 50 % der Zellen sind rund, … keine ausgedehnte Zellauflösung, <= 50 % Wachstumshemmung bemerkbar |
|
3 |
Mäßig | <= 70 % der Zellschichten enthalten runde Zellen oder sind aufgelöst, … > 50 % Wachstumshemmung |
|
4 |
Stark |
Fast oder vollständige Zerstörung der Zellschichten |
Unter dem Mikroskop kann das dann wie folgt aussehen:

Das Ergebnis eines Zytotoxizitätstest ist kein Maß für „bestanden“ oder „nicht bestanden“. Auch zytotoxische Ergebnisse können für bestimmte Materialien und Anwendungen akzeptabel sein.
3. Regulatorische Anforderungen
Regularien wie die MDR fordern den Nachweis der Biokompatibilität aller Materialien, mit denen Patienten direkt oder indirekt in Kontakt kommen.
Der Zytotoxizitätstest ist DER Standardtest zur Biokompatibilität nach EN ISO 10993-1.
Im Artikel zu Biokompatibilität und ISO 10993-1 erhalten Sie einen Überblick über das Thema und lernen weitere regulatorische Anforderungen kennen.
Zytotoxizitätstests sind essenziell für jede Produktkategorie, Kontaktdauer und Kontaktart eines Medizinprodukts. Mehr noch: Sie finden auch Anwendung für Prüfungen im Rahmen der Validierung der Endreinigung (ISO 19227). Als typischer Test für Chargenfreigabe sind sie seit Jahren etabliert.

Der Grund hierfür liegt in der starken Sensitivität des Zytotoxizitätstestes, was ihn als Screening-Test ideal macht.
Der Zytotoxizitätstest ist ein Screening-Test, der ein breites Spektrum an Produktionshilfsmitteln, Monomeren, Metallionen, Weichmachern, Reinigungs- und Desinfektionsmitteln usw. detektieren kann, aber nicht alle in toxikologisch relevanter Konzentration!
Zytotoxische Ergebnisse lassen jedoch noch keinen Rückschluss auf die Effektursache zu. Auch ist ein bestandener Zytotoxizitätstest keine Garantie dafür, dass es keine kritischen Rückstände gibt oder das Produkt bzw. Material keine problematischen Substanzen freisetzt. Der Grund hierfür liegt darin, dass der Test zwar insgesamt ein sehr sensitiver Screeningtest ist (also viele verschiedene Substanzen auch in niedrigen Konzentrationen gut anzeigt); bei einer zu geringen Konzentration ist er aber limitiert und schlägt nicht mehr an, obwohl die Werte womöglich toxikologisch noch hoch relevant sind.
Der Zytotoxizitätstest alleine reicht nicht aus, um die Biokompatibilität oder die Reinheit von Medizinprodukten zu belegen. Es sollten mit Blick auf Produkt, Anwendung und Fragestellung immer weitere Analysemethoden ausgewählt werden.
4. Ablauf des Zytotoxizitätstests
Ein Zytotoxizitätstest besteht im Wesentlichen aus drei Schritten.

Schritt 1: Die Extraktion
Hier wird das Produkt mit einem Extraktionsmittel in Kontakt gebracht und in einem inerten Gefäß über eine bestimmte Zeit bei definierter Temperatur und mit einem auf das Produkt abgestimmten Extraktionsverhältnis extrahiert. Details hierzu finden Sie in der EN ISO 10993-12.
Das Extraktionsmittel kann stark variieren, ist aber meist Zellkulturmedium mit Serumzusatz, manchmal auch mit einem Zusatz an DMSO (Dimethylsulfoxid) als Migrationsverstärker.
Schritt 2: Die Inkubation
Nach der Extraktion wird der Extrakt zusammen mit den Zellen inkubiert. Hierbei gibt es mehrere Möglichkeiten. Die Zellen können ohne Extrakt vorinkubiert werden (vorwachsen) oder erst zusammen mit den Zellen wachsen.
Die Dauer der Inkubation ist variabel: Sie ist nie geringer als 24 h und kann bis zu mehreren Tagen dauern. Die Zelllinie L929 (Mausfibroblasten) hat sich für den Test etabliert. Prinzipiell sind auch andere Zelllinien einsetzbar.
Die Zellen inkubieren (wachsen) in Gegenwart des Extraktes bis zur Subkonfluenz (Konfluenz = Zelldichte).
Schritt 3: Die Bewertung
Nach der Inkubation bis zu einem subkonfluenten Zellrasen (80 % dicht gewachsen) erfolgt die Bewertung, welchen Einfluss der Extrakt auf die Zytotoxizität hat. Dies geschieht entweder qualitativ oder quantitativ.
Sicher fragen Sie sich jetzt, welchen Einfluss all die Variablen auf den Test und damit Ihr Prüfergebnis haben können.
Die Antwort lautet: Sie können ein sehr gutes Produkt niemals schlecht prüfen. Ein Produkt, das keine zytotoxischen Substanzen freisetzt oder auf der Oberfläche enthält, wird unter keinen Umständen durch Variation der Prüfparameter zytotoxisch.
Aber je nach Kombination der Prüfparameter können Sie die Sensitivität des Tests derart herabsetzen, dass Sie ein schlechtes Produkt von 100 % zytotoxisch auf 0 % zytotoxisch herunterbekommen. Diese Annahme hat sich leider bestätigt. Die Ergebnisse des erstmals durchgeführten Ringversuch zum Zytotoxizitätstest nach ISO 10993-5 sind besorgniserregend (mehr dazu unter Punkt 5.)
Geben Sie alle Prüfparameter vor, damit bei Nachtests die Prüfergebnisse uneingeschränkt vergleichbar sind und vermeiden Sie die Beauftragung zu vieler Prüflabore für ein Produkt. Haben Sie mehrere Labore als Lieferanten freigegeben, achten Sie auf möglichst vergleichbare Testparameter.
Maskieren Sie keine schlechten Ergebnisse durch wenig sensitiv ausgerichtete Tests. Zytotoxische Ergebnisse haben immer eine ernst zu nehmende Ursache. Diese sollte dringlichst herausgefunden werden, sonst holen die Ergebnisse Sie irgendwann ein. Gerade bei Verunreinigungen von Produkten nimmt die Zytotoxizität oft mit der Zeit zu, wenn die Ursache nicht abgestellt wird.
Die oben beschriebene Prüfung von Extrakten ist der mit Abstand am häufigsten durchgeführte Prüfaufbau. Für den Hersteller reicht das Wissen um die obigen Zusammenhänge vollkommen aus.
Nehmen Sie Kontakt mit den Expert:innen des Johner Instituts auf (z. B. per E-Mail), wenn Sie mehr zu Ablauf und Ausführungen von Testvarianten erfahren wollen (z. B. Prüfung durch direkten Kontakt, Agardiffusion und Filterdiffusion).
5. Die Norm EN ISO 10993-5
Die EN ISO 10993-5 trägt den Titel „Biologische Beurteilung von Medizinprodukten – Teil 5: Prüfungen auf In-vitro-Zytotoxizität“. Mit 46 Seiten ist sie relativ überschaubar. Ein Großteil der Norm (Anhänge A bis D) widmet sich ausgiebig der Durchführung für bestimmte Prüfaufbauten, die primär für das Labor oder bei der Fehlersuche interessant sind.
Die für den normalen Hersteller relevanten Abschnitte enden auf Seite 21.
Neben den Anforderungen der EN ISO 10993-5 müssen die Hersteller auch die Anforderungen und Vorgaben der EN ISO 10993-1 und EN ISO 10993-12 für den Test berücksichtigen.
6. Ringversuch Zytotoxizität (ISO 10993-5)
Die in diesem Beitrag getroffenen Aussagen hat auch ein Ringversuch des Johner Instituts aus dem Jahr 2021 belegt.
Hintergrund
Das Johner Institut organsierte einen erstmalig unabhängigen Ringversuch zum Zytotoxizitätstest nach ISO 10993-5 aus Sicht eines Medizinprodukteherstellers. Bislang mussten sich die Labore selbst um Vergleichsprüfungen mit anderen Laboren bemühen. Wir waren überzeugt, dass ein Ringversuch im Zytotoxizitätstest möglich ist, auch wenn der Test mit seinen breiten normativen Vorgaben und Auslegungen als zu differenziert gilt, um ihn vergleichen zu können.
Der Ringversuch wurde von nationaler auf internationaler Ebene erweitert, von über 250 eingeladenen Laboren haben 52 Labore teilgenommen. Die Organisation des Ringversuchs war eine Pro-Bono-Leistung des Johner Instituts, um den Anreiz für eine höchstmögliche Teilnehmerzahl zu schaffen und damit für alle Beteiligten einen Mehrwert zu generieren.
Durchführung
Jedes Labor erhielt 2 verschiedene Materialien in Form von sterilen Schlauch-Stücken. Je eine Prüfung pro Material war durchzuführen. Die verwendeten Materialien waren den Laboren nicht bekannt. Bis auf die Vorgaben zur Extraktion wurden keine weiteren Prüfparameter vom Johner Institut festgelegt.
Die Materialien Polyvinylchlorid (PVC) und Polyethylene (PE) wurden ausgewählt, da beide typische Materialien für Medizinprodukte darstellen und das zytotoxische Potenzial allgemein bekannt war.
Qualitativ hochwertige Polyethylene gelten generell als nicht zytotoxisch, wogegen bei PVC-Materialien je nach Formulierung ein zytotoxisches Potenzial zu erwarten ist (Hemmung der Proliferation > 30%).
Die Annahme der Zytotoxizität beider Materialien wurde auch nochmal durch eine wiederholte Messung bei einem Labor im Vorfeld bestätigt.
Besonders wichtig war uns die anonyme Teilnahme. Alle Daten wurden besonders sensibel behandelt. Ziel war es, dass kein Prüflabor anhand der Ergebnisse oder Prüfparameter eindeutig identifizierbar war.
Ergebnisse
Das Ergebnis war erschreckend. Für das angenommen eindeutig zytotoxische PVC Material wurden Ergebnisse von 0 % – 100 % Proliferationshemmung ermittelt.
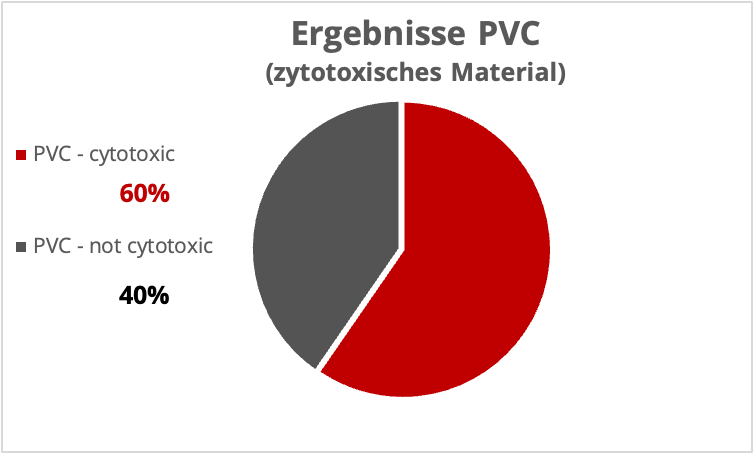
Für das unkritische Material PE wurde von 100 % klarem Ergebnis ausgegangen. Leider Fehlanzeige, es wurden hier auch klar zytotoxische Ergebnisse identifiziert, wobei die Mehrzahl der Ergebnisse unter 30 % Proliferationshemmung lag.
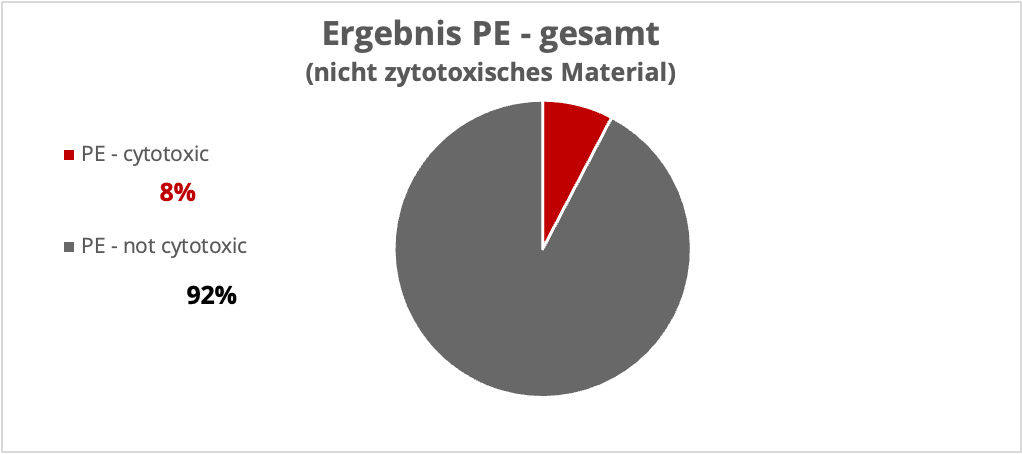
Zusammenfassend kann man sagen, dass Materialien, die nicht als zytotoxisch eingestuft sind, in den meisten Fällen auch als solche erkannt werden. Materialien, von denen angenommen wird, dass sie zytotoxisch sind, werden jedoch nicht von allen Laboren als solche identifiziert.
Ergebnis: Labore liefern keine vergleichbaren Ergebnisse für ein identisches Material oder Medizinprodukt
Für Details sehen Sie hier unseren Kurzbericht zum Ringversuch
Der Vergleich der Ergebnisse pro Labor bestätigt die sehr unterschiedliche Sensitivität der Testdesigns. Alle Empfindlichkeiten und alle denkbaren Abstufungen sind vorhanden. Die zahlreichen variablen Parameter können offensichtlich einen sehr großen Einfluss auf die Sensibilität des Testsystems haben.
Ergebnis: Die Vorgaben der ISO 10993-5 für die Labore reichen nicht aus, um vergleichbar sensitive Tests zu generieren
Vorschlag für den Testaufbau
Anhand der Auswertung der Testparameter machen wir folgenden Vorschlag für den Testaufbau:
|
Medium |
MEM + 10 % Serum DMEM + 10 % Serum |
|
Incubation |
24h pre-incubation, > 24h incubation 00h pre-incubation, 72h incubation |
|
Assay |
XTT BCA |
|
Cells |
L929 |
Folgerung
Was bedeutet das für Medizinproduktehersteller? Ein Zytotoxizitätstest kann ein sehr sensitiver Screening-Test sein. Jedoch reicht dieser alleine nicht aus, um die Biokompatibilität zu bewerten!
Um qualitativ hochwertige Testergebnisse zu erhalten, befolgen Sie unsere Powertipps zur Laborbeauftragung.
7. Powertipps zur Laborbeauftragung
Tipp 1: Geben Sie IMMER alle Extraktionsparameter selbst vor.
Leider kann es vorkommen, dass verschiedene Labore oder auch derselbe Mitarbeiter im Labor bei einer Neutestung andere Extraktionsparameter für Ihr Produkt auswählt. So kann z. B. ein Wechsel des Extraktionsverhältnisses von 3 cm²/ml auf 6 cm²/ml bereits eine doppelt so hohe Zytotoxizität bedingen und umgekehrt. Gleiches gilt für diverse andere Variablen.
Tipp 2: Beauftragen Sie möglichst immer das gleiche Labor.
Da jedes Labor einen anderen Testaufbau hat, sollten Sie nicht erwarten, von zwei Laboren die gleichen Ergebnisse zu erhalten. Seien sie also nicht von widersprüchlichen Ergebnissen überrascht. Ist Ihr Labor akkreditiert oder GLP-zertifiziert, sollten Sie auf die Qualität der Testdurchführung des Labors grundsätzlich vertrauen.
Tipp 3: Prüfen Sie immer den Bericht und die Prüfergebnisse auf Abweichungen.
auch ein zertifiziertes Labor kann Fehler machen. Besonders großen Einfluss kann eine suboptimale Extraktion der Produkte haben. Auch treten regelmäßig Ausreißer bei den Messergebnissen auf. Und falls Sie mehrere Produkte parallel testen lassen: „Vertauschungen“ sind leider keine Seltenheit.
Tipp 4: Überwachen Sie immer Ihre Prüfergebnisse! Nur so entdecken Sie Trends.
Prüfen Sie Ihre Produkte regelmäßig auf Chargengleichheit oder zumindest in gewissen Abständen auf Änderungen. Führen Sie ein Monitoring ein, um Trends frühzeitig zu erkennen.
Haben Sie zum Beispiel ein Titanprodukt mit zytotoxischen Werte konstant um 15 %, so gilt der Test offiziell als bestanden, aber es kann bereits ein größeres Problem vorliegen. Denn auch geringe Konzentrationen von Rückständen können über den relevanten toxikologischen Grenzwerten liegen, auch wenn diese Substanzen im Test fast gar nicht zytotoxisch sind.
Tipp 5: Ziehen Sie keine falschen Schlussfolgerungen aus nicht bestandenen Tests
Ein Nachweis von Zytotoxizität heißt nicht, dass Sie den Test nicht bestanden haben. Bei einigen Materialien werden Sie immer zytotoxische Ergebnisse bekommen. Das muss kein Problem sein. Bekannt ist dies z. B. bei Polyurethan.
Wenn Ihr Produkt zytotoxisch ist, heißt das nicht, dass Ihr Produkt nicht biokompatibel ist. Hier gilt es, über die von der EN ISO 10993-1 geforderte Materialcharakterisierung (Achtung: Materialzertifikate reichen nicht aus) eine detailliertere toxikologische Bewertung zu treffen.
Schreiben Sie doch eine E-Mail an die Expert:innen des Johner Instituts, wenn Sie hierzu Fragen haben.
Tipp 6: Ziehen Sie keine falschen Schlussfolgerungen aus bestandenen Tests
Gehen Sie nicht davon aus, dass der Zytotoxizitätstest jede Substanz ausreichend detektiert. Aus diesem Grund ist der Test alleine nicht ausreichend, um die Reinheit von Medizinprodukten oder die Abwesenheit von herauslösbaren Substanzen zu belegen.
Tipp 7: Vermeiden Sie unnötige Tests und Prüfkosten
Es ist wenig überraschend, dass der billigste Test nicht immer der beste ist. Zwar gibt es auch sehr gute Labore mit niedrigen Preisen. Allerdings erhalten Sie dann oft eine Standarddurchführung, die nicht auf Ihr Produkt abgestimmt ist.
Wie immer erkennen Sie ein gutes Labor an einer schnellen und aktiven Kommunikation. Fragen Sie immer nach Zusatzkosten für:
- Unsterile Produkte
- Sterilisation
- Produkthandling
- GLP
- Prüfbericht
Manchmal entpuppen sich günstige Angebote als Blackbox mit beträchtlichen Zusatzkosten.
8. Fazit
Die Laborauswahl hat auf Ihr Prüfergebnis mindestens einen ebenso großen Einfluss wie Ihr Produkt selbst. Und ein bestandener Zytotoxizitätstest heißt nicht, dass keine bedenklichen Substanzen freigesetzt werden. Durch eine korrekte und auf Ihr Produkt abgestimmte Vorgabe der Prüfparameter an das Labor erreichen Sie eine optimale Vergleichbarkeit und vermeiden eine Über- oder Unterbewertung Ihres Produktes hinsichtlich möglicher zytotoxischer Effekte.
Gerne unterstützen wir Sie bei der Laborauswahl, der Festlegung der Prüfparameter und der Beauftragung von Tests. Sollte der Test nicht bestanden sein, helfen wir bei der Interpretation der Ergebnisse. Weitere Informationen finden Sie hier.
Versionshistorie:
- 2022-03-23: Unter 6. Ergebnisse des Ringversuchs ergänzt.




Sehr interessante Ergebnisse der Ringversuche.
Deckt sich mit meinen Beobachtungen beim RV, der bei DRRR durchgeführt wurde. Ein wildes Gemisch aus falsch-positiven und falsch-negativen Ergebnissen, erhoben durch akkreditierte Labore.
Das dürfte nicht sein.
Sofern Sie wieder Ringversuch zum Thema Zytotoxizität nach DIN EN ISO 10993-5 anbieten, wäre ich an einer Teilnahme interessiert.
Gerne Infomaterial zukommen lassen.
Mit freundlichen Grüßen,
Dipl-Biol. (t.o.) Sibylle Thude
Fraunhofer-Institut für
Produktionstechnik und Automatisierung IPA
Abteilung Reinst- und Mikroproduktion
Nobelstrasse 12| 70569 Stuttgart
Telefon +49 711 970-1629
Telefax +49 711 970-1007
sibylle.thude@ipa.fraunhofer.de
http://www.ipa.fraunhofer.de