Die Food and Drug Administration (FDA) ist eine US-amerikanische Behörde, die für die Zulassung und Marktüberwachung von Lebensmitteln, Medikamenten, Kosmetika und Medizinprodukten verantwortlich ist. Sie darf eigene Gesetze erlassen, die im 21 CFR nachzulesen sind. Damit agiert die Behörde gleichzeitig als Legislative und Exekutive.
Inhalt
Diese Seite verschafft Herstellern von Medizinprodukten einen Überblick über die Anforderungen der FDA und verlinkt relevante Fachartikel.
- Zulassung und Kommunikation mit der Behörde
- Anforderungen an das QM-System
- Guidance Documents
- Unterstützung bei der Zulassung von Produkten in den USA
1. Artikel zur Zulassung und Kommunikation
Die FDA entscheidet über die Zulassung u.a. von Medizinprodukten und IVD. Dabei erstellt sie jedoch kein „FDA Zertifikat“, noch gibt es eine „FDA Zertifizierung“. Vielmehr erteilt die Behörde „Approvals“.
a) Artikel zu den Zulassungsverfahren
Einen Einstieg verschafft Ihnen der Fachartikel „FDA-Zulassung von Medizinprodukten“. Er zeigt Ihnen, wie Sie
- das richtige „Medical Device Panel“ und den Typ Ihres Medizinprodukts bestimmen,
- das Produkt klassifizieren und
- das passende Zulassungsverfahren auswählen.
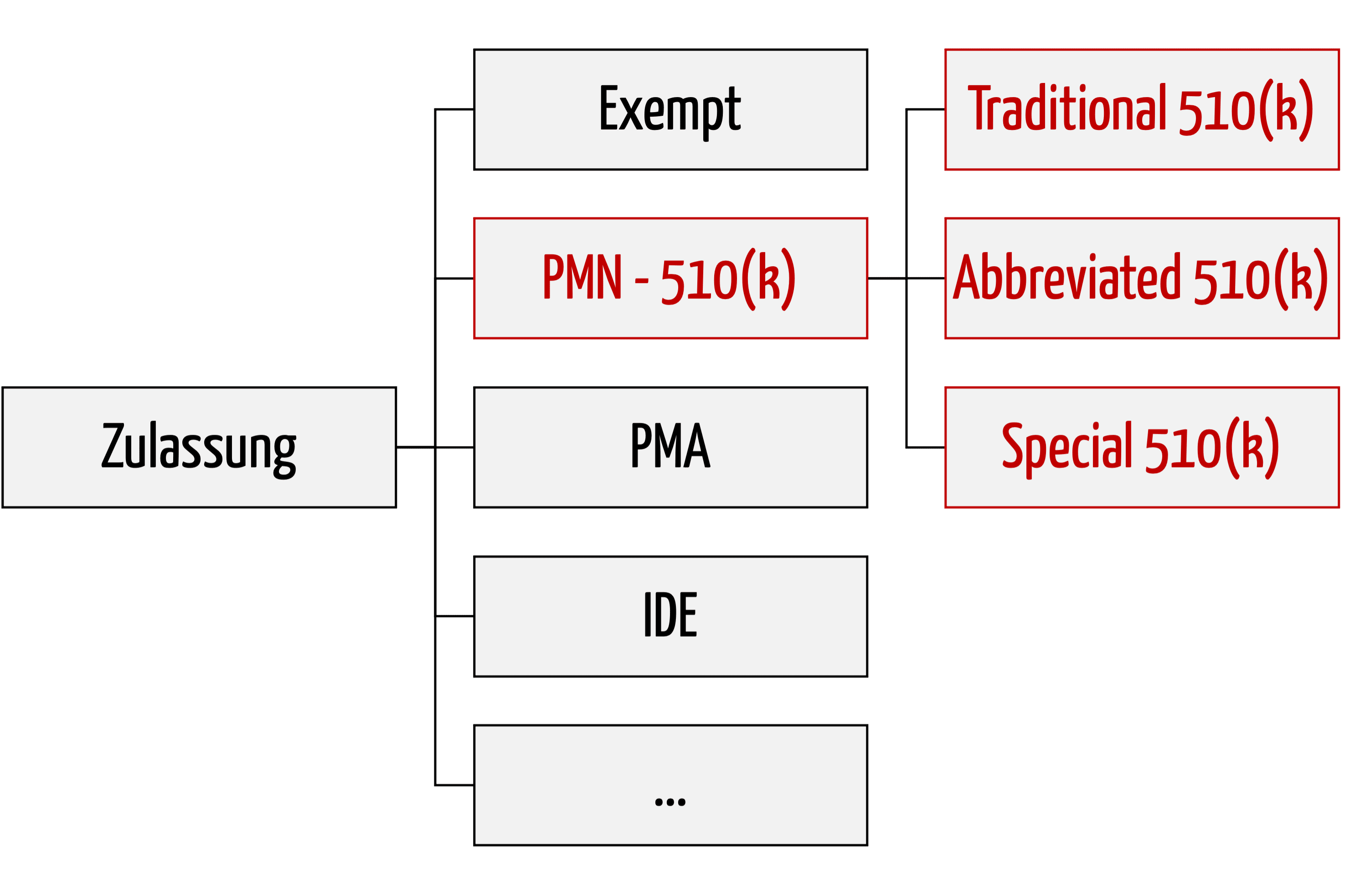
| Zulassungsverfahren |
Geeignet für Produkte, … |
| Premarket Notification PMN, auch bekannt als 510(k) |
für die es bereits ein zugelassenes Vergleichsprodukt gibt, dem sogenannten Predicate Device. Hier gibt es noch Sonderformen. |
| Abbreviated 510(k) |
für die die FDA Leitlinien mit „Special Controls“ veröffentlicht hat, welche der Hersteller anwendet |
| Special 510(k) |
die der Hersteller bereits zugelassen hatte und die er nach einer Änderung erneut zulassen will |
| Premarket Approval (PMA) |
die kritisch sind (typischerweise Klasse III) und für die es keine Vergleichsprodukte gibt |
| De-Novo-Verfahren |
die nicht ganz so kritisch sind (typischerweise Klasse II) und für die es keine Vergleichsprodukte gibt |
| Investigational Device Exempt (IDE) |
die im Rahmen klinischer Prüfungen eingesetzt werden |
| Humanitarian Device Exemption |
die noch experimentell sind und i.d.R. bei unheilbar kranken Patienten zur Anwendung kommen sollen |
| Breakthrough Medical Devices |
die für Patienten mit kritischen oder gar lebensbedrohlichen Erkrankungen und Verletzungen sind |
| Safer Technologies Program |
die die Sicherheit im Vergleich zu alternativen Produkten erhöhen und für Patienten vorgesehen sind, die weniger kritisch erkrankt oder verletzt sind. |
| Precertification (Pre-Cert) Pilot Program |
die Software sind und eine Innovation darstellen. |
Tipp
In der Johner Academy lernen Sie Schritt für Schritt
- die Klasse und das Zulassungsverfahren zu bestimmen,
- ein Äquivalenzprodukt zu finden,
- die Zulassungsakte zusammenzustellen und
- die offiziellen Kommunikationskanäle mit der Behörde zu nutzen.
b) Artikel zur Kommunikation mit der FDA
Die US-Gesundheitsbehörde hat die Kommunikation mit den Herstellern gesetzlich geregelt und formalisiert.
Tipp
Das Johner Institut begleitet Medizinproduktehersteller bei der offiziellen Kommunikation mit der FDA. Wir helfen Ihnen, den richtigen Kanal auszuwählen und die Treffen so vorzubereiten, dass die Behörde verbindliche Auskünfte gibt.
c) Weitere Artikel
Für die Registrierung der Medizinprodukte verlangt die FDA einen U.S. Agent & Official Correspondent. sowie eine FDA-Registration.
Die FDA stellt umfangreiche Anforderungen an die IT-Sicherheit beispielsweise in deren Guidance Documents zur IT Security.
2. Artikel zu den Anforderungen an das QMS
Wichtig sind die Quality System Regulations (QSR) in 21 CFR part 820. Diese gleicht die FDA weitgehend an die Anforderungen der ISO 13485 an. Sie nennt die neuen Anforderungen QMSR, Quality Management System Regulations.
Bei den FDA-Inspektionen von QM-Systemen folgt die FDA dem FDA QSIT: Quality System Inspection Technique. Falls es dabei zu Problemen kommt, müssen die Hersteller eine Remediation durchführen.
Bei diesen Inspektionen prüft die FDA die Objective Evidence. Falls der Hersteller diese Nachweise elektronisch erbringt, muss er die Anforderungen an elektronische Unterschriften des 21 CFR Part 11 erfüllen.
Im Gegensatz zu den Audits Benannter Stellen erteilt die FDA nach erfolgreichen Inspektionen weder eine „FDA Zertifizierung“ noch erstellt sie ein „FDA Zertifikat“. Abhängig von der Art des Produkts und des Zulassungsverfahrens sind erfolgreiche Inspektionen die Voraussetzung, um regulatorischen Ärger zu vermeiden oder/und Medizinprodukte legal in den USA (weiter) vermarkten zu drüfen.
Entwicklung
Mit dem Umstieg auf die ISO 13485 wurden die Anforderungen an folgende Dokumente bzw. Akten teilweise obsolet: Design History File, Device Master Record, Device History Record. Allerdings verlangt die ISO 13485 ähnliche Aufzeichnungen.
Weiterhin verpflichtet sind die Hersteller zur Beschreibung von:
3. Artikel zu den Guidance-Dokumenten
Die gesetzlichen Vorgaben in den USA sind oft allgemeingültig. Daher hat die FDA unzählige Leitlinien veröffentlicht.
a) Software
| Guidance Document |
Anwendungsbereich |
| Software Validation |
Software, die ein Medizinprodukt oder ein Teil dessen ist, sowie Software, die im Rahmen von QM-Prozessen eingesetzt wird, z. B. zur Produktionssteuerung
Beachten Sie auch die Artikel zur Prozessvalidierung und Computerized Systems Validation (CSV). |
| Interoperable Medical Devices |
Software mit externen Schnittstellen, insbesondere zu anderen Medizinprodukten und klinischen Informationssystemen |
| Medical Device Data Systems (MDDS) |
Produkte (Hardware und/oder Software), die primär dazu bestimmt sind, Daten weiterzuleiten |
| Leven of Concern |
Jede Software: Das Guidance regelt den Umfang der einzureichenden Dokumentation. |
| Off-the-shelf (OTS) Software |
Software, die allgemein verfügbare Software enthält, insbesondere Bibliotheken |
| Software-Change |
Dieses Guidance Document ist immer dann relevant, wenn ein Hersteller die Software ändern will und entscheiden muss, ob eine neue Zulassung notwendig ist. |
| Cybersecurity (mehrere Guidance Documents) |
Interoperable Medizinprodukte, die Software enthalten oder eine stand-alone Software sind insbesondere Medizinprodukte mit Netzwerkverbindungen. |
b) Security
Fast alle Medizinproduktehersteller, deren Produkte Software enthalten oder Software sind, müssen auch die Leitlinien zur IT-Security bzw. Cybersecurity beachten. Einen Einstieg gibt der Fachartikel „Cybersecurity in Medical Devices: Die Guidance-Dokumente der FDA“. Dazu zählen auch Anforderungen an die Software Bill of Materials SBOM.
Bei reinen Security Patches ist die FDA großzügig.
Die FDA erkennt einige Normen zur IT-Sicherheit als „consensus standard“ an, darunter die UL 2900.
c) Usability
Den besten Einstieg verschafft Ihnen der Beitrag FDA Human Factors Guidances, denn er stellt die beiden Leitlinien und ihr Zusammenspiel vor.
Eines dieser Dokumente ist der FDA Human Factors Engineering Guidance.
d) Klinische Bewertung
Die klinische Bewertung handhabt die FDA anders als die EU. Beispielsweise gilt für Produkte mit einem „Predicate Device“ dieser Beweis als erbracht. Dennoch hat die FDA eine Leitlinie zur klinischen Bewertung von Software verfasst.
e) Risikomanagement
FDA Benefit-Risk Guidance
FDA MAUDE Datenbank: Input fürs Risikomanagement
f) Artikel zu Post-Market Surveillance und Vigilanz
Auch an die Phase nach der Inverkehrbringung stellen die US-Behörden einige Anforderungen, z. B.
4. Unterstützung bei der Zulassung von Medizinprodukten in den USA
Haben Sie noch Fragen zur Zulassung Ihres Medizinprodukts in den USA? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller bei allen Aktivitäten:
- Festlegen der Zulassungsstrategie (FDA und weltweit)
- Klassifizierung der Produkte
- Kommunikation mit der Behörde, z. B. bei Q-Meetings
- Registration & Listing
- Remediation (schnelle Beseitigung der durch die FDA festgestellten Abweichungen)
- Post-Market Surveillance
Nehmen Sie gleich Kontakt mit unseren Expertinnen und Experten auf.