Als grundlegende Sicherheits- und Leistungsanforderungen bezeichnen die EU-Medizinprodukteverordnungen (MDR und IVDR) die Anforderungen, die jedes Medizinprodukt erfüllen muss. Auf Englisch heißen diese general safety and performance requirements, weshalb sie mit GSPR abgekürzt werden.
Die frühere Medizinprodukterichtlinie (MDD) sprach von den „grundlegenden Anforderungen“.
Inhalt
Sie finden auf dieser Seite Verweise auf relevante Fachartikel.
- Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
- Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen
- Unterschiede zwischen den Anforderungen der MDR und der MDD
- Unterstützung beim Nachweis dieser Anforderungen
1. Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
MDR und IVDR listen die grundlegenden Sicherheits- und Leistungsanforderungen in ihren jeweiligen Anhängen I. Beispiele für GSPR sind:
Hinweis
Die grundlegenden Sicherheits- und Leistungsanforderungen hängen nicht von der Klasse der Medizinprodukte ab.
2. Nachweis der grundlegenden Anforderungen
Den Nachweis, dass die Medizinprodukte diese grundlegenden Anforderungen erfüllen, erbringen die Hersteller im Rahmen eines Konformitätsbewertungsverfahrens selbst. Abhängig von diesem Konformitätsbewertungsverfahren müssen sie Benannte Stellen einbeziehen und können sie externe Prüfungen einbeziehen, müssen das aber nicht.
Meist nutzen die Hersteller harmonisierte Normen, um die Konformität mit den grundlegenden Sicherheits- und Leistungsanforderungen vermuten zu lassen.
Die MDR und IVDR fordern zudem die Einhaltung sogenannter gemeinsamer Spezifikationen (common specifications).
Tipp
Als Hersteller müssen Sie die Konformität sehr präzise und Satz für Satz nachweisen. Nutzen Sie dafür Checklisten wie die MDR-Checkliste.
3. Unterschiede zwischen MDD/IVDD und MDR/IVDR
Die MDR und IVDR formulieren die Anforderungen nicht nur granularer als die MDD bzw. IVDD, sondern sie hat diese auch erweitert. Zudem trennen die MDR und IVDR zwischen den „grundlegenden Sicherheits- und Leistungsanforderungen“ (Anhang I) und den Anforderungen und deren Nachweis in der Technischen Dokumentation (Anhang II).
Die MDR stellt im Vergleich zur MDD zusätzlich explizit Anforderungen an:
- IT-Sicherheit
- Produkte, die Arzneimittel enthalten
- Produkte, die Gewebe menschlichen oder tierischen Ursprungs enthalten
- Entsorgung
- Aktive implantierbare Produkte (die nicht im „Scope“ der MDD waren)
- Produkte, die durch Laien genutzt werden sollen
- Labeling
5. Unterstützung
Haben Sie noch Fragen zu den grundlegenden Anforderungen an Medizinprodukte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller dabei,
- die Anforderungen nachzuweisen mit einer schlanken Technischen Dokumentation,
- diese Nachweise vor dem Review durch eine Benannte Stelle zu prüfen, um Probleme bei der „Zulassung“ zu vermeiden,
- das QM-System auf Audits vorzubereiten.
Melden Sie sich! Das Team des Johner Institut freut sich auf Sie!
Die Verordnung (EU) 2025/327 über den europäischen Gesundheitsdatenraum (European Health Data Space, kurz EHDS) ist eine weitere europäische Verordnung, die Hersteller von Medizinprodukten und IVD betreffen kann. Was diese Verordnung fordert und was diese Hersteller bis wann tun müssen, klärt dieser Artikel ebenso wie mögliche Vorteile des EHDS bzw. der EHDS-VO.
Details
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und die Abgrenzung von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Der Brexit wurde mit dem 01.01.2021 vollzogen. Was für manche ein Grund zum Feiern war, bedeutet für viele eine zusätzliche Last – auch für die Hersteller von Medizinprodukten. Für Hersteller ist es wichtig zu verstehen, welche regulatorischen Anforderungen sie erfüllen müssen und von welchen Übergangsfristen sie profitieren, wenn sie ihre Produkte weiterhin in Großbritannien verkaufen…
Details
Oft wird von der Zulassung von Medizinprodukten gesprochen, auch wenn etwas anderes gemeint ist: manchmal eine Konformitätsbescheinigung, manchmal eine „Clearance“, manchmal ein erfolgreich durchlaufendes Konformitätsbewertungsverfahren. Begriffe wie „MDR-Zulassung“ sind sogar irreführend. Dieser Artikel klärt, was unter einer Zulassung von Medizinprodukten zu verstehen ist und wann Hersteller eine solche überhaupt benötigen.
Details
Viele Medizinproduktehersteller empfinden die internationale Zulassung ihrer Produkte als ein Wagnis: Den Chancen neuer Märkte stehen schwer kalkulierbare Risiken sowie Kosten und Aufwände für diese Zulassungen gegenüber. Mit fünf Schritten und der Checkliste „Internationale Zulassung“ wird es den Herstellern gelingen, diese Risiken besser zu beherrschen. Das ist notwendig, denn eine gescheiterte Zulassung ist nicht der…
Details
Der Einsatz von CMR-Stoffen ist streng reguliert. Auch die MDR regelt die CMR-Stoffe und stellt strenge Anforderungen an die Medizinproduktehersteller. Dieser Artikel hilft, diese Anforderungen zu erfüllen.
Details
Immer mehr Medizinprodukte nutzen künstliche Intelligenz, um Krankheitsbilder präziser zu diagnostizieren und Patienten wirksamer zu behandeln.
Die Begriffe Wartung, Instandhaltung, Instandsetzung, Inspektion, Service und sicherheitstechnische Kontrolle sind nicht synonym. Aber alle bezeichnen Aktivitäten im Lebenszyklus von Medizinprodukten, die dem Ziel dienen, die Sicherheit, Leistungsfähigkeit und Wirksamkeit dieser Produkte auch nach der Inverkehrbringung zu gewährleisten. Hersteller und Betreiber müssen die regulatorischen Anforderungen an die Wartung bzw. Instandhaltung erfüllen. Diese Vorgaben sind oft…
Details
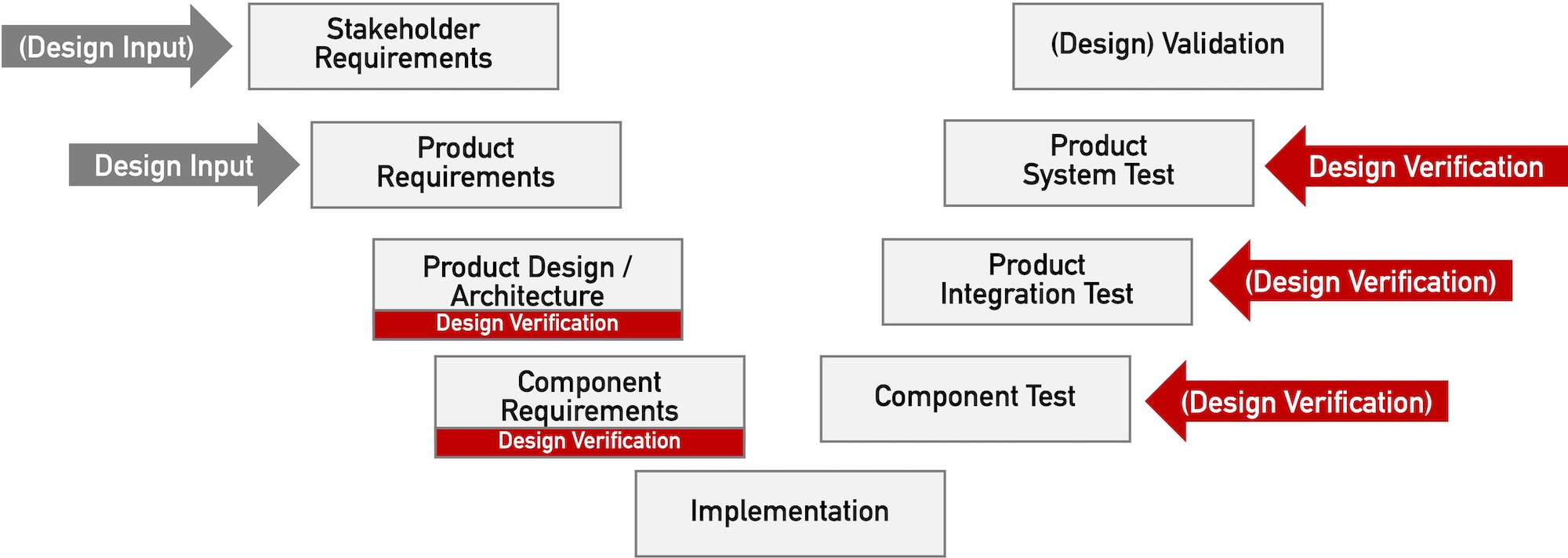
Die Forderung nach „Design Verification“ erhebt keinesfalls nur die FDA. Dieser Beitrag beschreibt, was unter „Design Verification“ zu verstehen ist und welche regulatorischen Forderungen Medizinproduktehersteller erfüllen sollten.
Eine Annahme hält sich hartnäckig: Allgemeiner Laborbedarf wie PCR-Cycler, NGS-Geräte, Fragment-Analyzer, Zentrifugen, Pipettier-Roboter und Extraktionskits müssen eine CE-IVD-Kennzeichnung tragen. Stimmt das? Es fehlt oft Klarheit darüber, Daher gibt es Unsicherheiten, um sich nicht strafbar zu machen. Dieser Artikel verschafft Klarheit und gibt Herstellern und Betreibern (z. B. medizinischen Laboren) konkrete Tipps, um regulatorischen Ärger und…
Details