Als grundlegende Sicherheits- und Leistungsanforderungen bezeichnen die EU-Medizinprodukteverordnungen (MDR und IVDR) die Anforderungen, die jedes Medizinprodukt erfüllen muss. Auf Englisch heißen diese general safety and performance requirements, weshalb sie mit GSPR abgekürzt werden.
Die frühere Medizinprodukterichtlinie (MDD) sprach von den „grundlegenden Anforderungen“.
Inhalt
Sie finden auf dieser Seite Verweise auf relevante Fachartikel.
- Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
- Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen
- Unterschiede zwischen den Anforderungen der MDR und der MDD
- Unterstützung beim Nachweis dieser Anforderungen
1. Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
MDR und IVDR listen die grundlegenden Sicherheits- und Leistungsanforderungen in ihren jeweiligen Anhängen I. Beispiele für GSPR sind:
Hinweis
Die grundlegenden Sicherheits- und Leistungsanforderungen hängen nicht von der Klasse der Medizinprodukte ab.
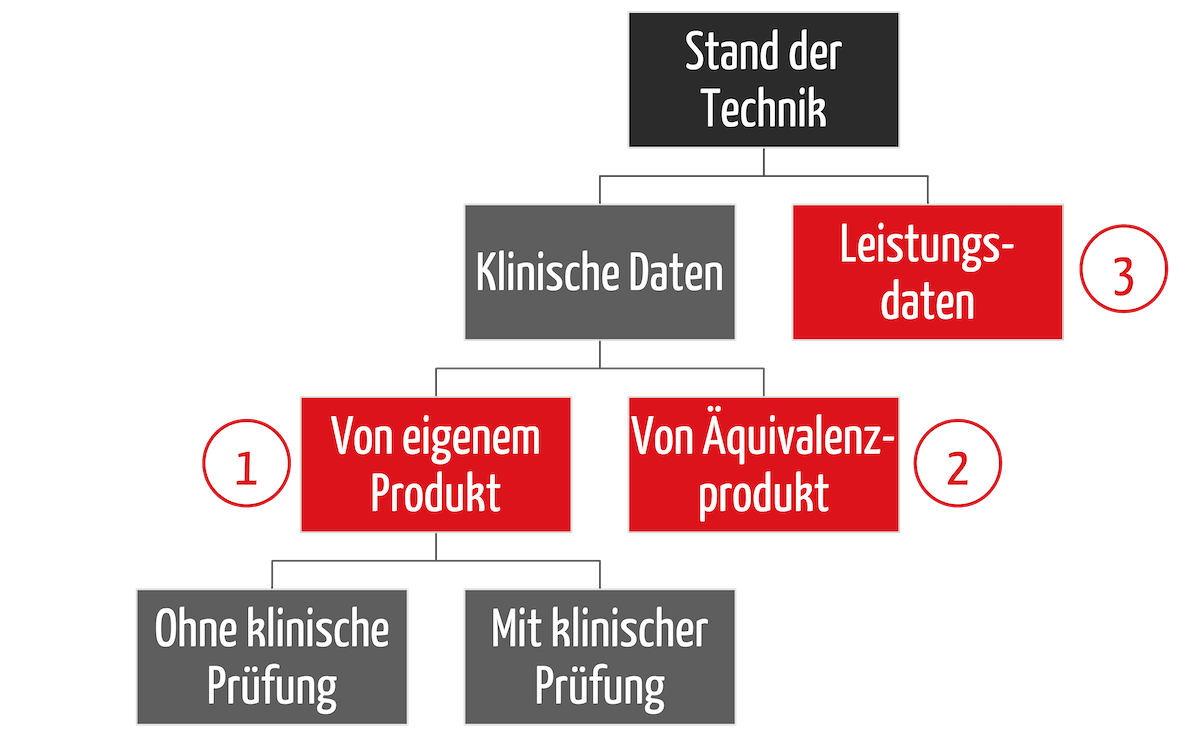
2. Nachweis der grundlegenden Anforderungen
Den Nachweis, dass die Medizinprodukte diese grundlegenden Anforderungen erfüllen, erbringen die Hersteller im Rahmen eines Konformitätsbewertungsverfahrens selbst. Abhängig von diesem Konformitätsbewertungsverfahren müssen sie Benannte Stellen einbeziehen und können sie externe Prüfungen einbeziehen, müssen das aber nicht.
Meist nutzen die Hersteller harmonisierte Normen, um die Konformität mit den grundlegenden Sicherheits- und Leistungsanforderungen vermuten zu lassen.
Die MDR und IVDR fordern zudem die Einhaltung sogenannter gemeinsamer Spezifikationen (common specifications).
Tipp
Als Hersteller müssen Sie die Konformität sehr präzise und Satz für Satz nachweisen. Nutzen Sie dafür Checklisten wie die MDR-Checkliste.
3. Unterschiede zwischen MDD/IVDD und MDR/IVDR
Die MDR und IVDR formulieren die Anforderungen nicht nur granularer als die MDD bzw. IVDD, sondern sie hat diese auch erweitert. Zudem trennen die MDR und IVDR zwischen den „grundlegenden Sicherheits- und Leistungsanforderungen“ (Anhang I) und den Anforderungen und deren Nachweis in der Technischen Dokumentation (Anhang II).
Die MDR stellt im Vergleich zur MDD zusätzlich explizit Anforderungen an:
- IT-Sicherheit
- Produkte, die Arzneimittel enthalten
- Produkte, die Gewebe menschlichen oder tierischen Ursprungs enthalten
- Entsorgung
- Aktive implantierbare Produkte (die nicht im „Scope“ der MDD waren)
- Produkte, die durch Laien genutzt werden sollen
- Labeling
5. Unterstützung
Haben Sie noch Fragen zu den grundlegenden Anforderungen an Medizinprodukte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller dabei,
- die Anforderungen nachzuweisen mit einer schlanken Technischen Dokumentation,
- diese Nachweise vor dem Review durch eine Benannte Stelle zu prüfen, um Probleme bei der „Zulassung“ zu vermeiden,
- das QM-System auf Audits vorzubereiten.
Melden Sie sich! Das Team des Johner Institut freut sich auf Sie!
Wie unterscheiden sich Verifizierung und Validierung und wie sind diese Begriffe definiert? Selbst Normen und Gesetze verwenden die Begriffe falsch oder missverständlich. Dieser Artikel
Details
Die Norm ISO 10993-17 ist Teil der Normenreihe ISO 10993 zur Biokompatibilität. Die ISO 10993-17 beschreibt die Verfahren der toxikologischen Risikobewertung. Im Herbst 2023 erschien nach über 20 Jahren eine umfangreiche Überarbeitung der Norm. Medizinproduktehersteller sollten wissen, Dabei hilft dieser Artikel.
Details
Die Qualifizierung und die Klassifizierung von IVD-Software bestimmen, wie und wie schnell IVD-Hersteller ihre Software in den Markt bringen können und welche Kosten für die „Zulassung“ anfallen. Dieser Artikel unterstützt Sie dabei, IVD-Software korrekt zu qualifizieren und zu klassifizieren. Damit können Sie regulatorische Probleme sowie daraus resultierende Aufwände und Verzögerungen vermeiden.
Details
In-vitro-Diagnostika (IVD) sind Medizinprodukte, mit denen Proben analysiert werden, die aus dem menschlichen Körper stammen. Typischerweise handelt es sich um Reagenzien, Kits oder Instrumente und Geräte. Auch Software kann als IVD zählen. Bei der „Zulassung von IVD“ müssen die Hersteller viele Verordnungen, Gesetze und Normen beachten.
Details
Das Medizinproduktegesetz (MPG) ist ein deutsches Gesetz, das die Inverkehrbringung, den Betrieb und die Überwachung von Medizinprodukten regelte. Seit dem 26.01.2021 ist das Gesetz weitgehend durch das Medizinprodukterecht-Durchführungsgesetz (MPDG) abgelöst. Dieses FAQ beantwortet die wichtigsten Fragen zum MPG und enthält die Links auf die aktuelle und frühere Versionen des Gesetzes.
Details
Inklusive kostenlosem Download der Kapitelstruktur für den klinischen Bewertungsplan Der klinische Bewertungsplan ist eines der komplexesten Dokumente der Technischen Dokumentation. Neben dem Clinical Evaluation Report wird der Clinical Evaluation Plan (CEP) am häufigsten von den Benannten Stellen kritisiert. Typischerweise 60 Arbeitsstunden benötigen selbst erfahrene Clinical Experts, um das oft mehr als 50-seitige Dokument so zu…
Details
Für Geräte, die WLAN oder RFID nutzen, gilt die Richtlinie 2014/53/EU (Funkanlagen-Richtlinie bzw. Radio Equipment Directive, RED). Auch Medizinprodukte, die „funken“, etwa weil sie sich mit dem Internet verbinden oder über eine Fernbedienung angesteuert werden, müssen die Konformität mit der RED nachweisen, bevor sie auf den Markt dürfen. Erfahren Sie in diesem Beitrag,
Details
Gesetze und Normen verpflichten Medizinproduktehersteller zur Software Bill of Materials, der SBOM. Standardisierte SBOM-Formate reichen allerdings nicht immer aus, um diese Anforderungen zu erfüllen. Insbesondere Medizinproduktehersteller, die für ihre Software keine SBOM ausliefern und nutzen, sind im Markt nicht mehr akzeptiert. Hier sind die Gründe.
Details
Dass Gesetze und Normen die IT-Security auch bei „Legacy Devices“ einfordern, ist verständlich. Die Art, wie diese Anforderungen formuliert werden, führt allerdings oft zu Verwirrung. Beispielsweise konnten sich Gesetzgeber und Normenkomitees nicht auf gemeinsame Definitionen einigen. So geht es einmal um die IT-Sicherheit bei Legacy Devices, einmal um die IT-Sicherheit von Altprodukten bzw. von Bestandsprodukten…
Details
Die EU-Verordnungen stellen hohe Anforderungen an die sogenannte Inverkehrbringung von Medizinprodukten. Erfahren Sie in diesem Artikel, was diese Regularien unter einer Inverkehrbringung verstehen, welche Missverständnisse und Widersprüche Sie kennen müssen und welche Voraussetzung die Hersteller bzw. Produkte erfüllen müssen.
Details