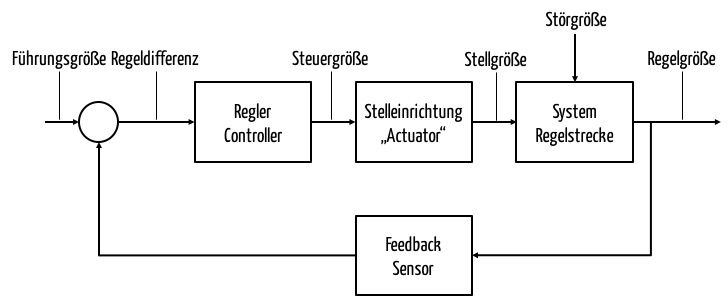
Die IEC 60601-1 ist die Norm mit dem Titel „Allgemeine Festlegungen für die Sicherheit einschließlich der wesentlichen Leistungsmerkmale“.
Inhalt
Diese Seite verschafft Ihnen eine schnelle Übersicht über die IEC 60601-1 und hilft Ihnen mit Verweisen auf weitere Fachartikel zu den folgenden Themen:
- Anwendbarkeit der Norm
- Anforderungen der Norm
- Mitglieder der Normenfamilie
- Aktuelles zur Norm
- Unterstützung beim Umgang mit der Norm
1. Anwendbarkeit der Norm
Die Norm findet bei medizinisch-elektrischen Geräten (ME-Geräte) Anwendung. Allerdings nur, wenn diese Geräte über ein Anwendungsteil verfügen.
Definition: Anwendungsteil
Teil des ME-Geräts, das bei bestimmungsgemäßem Gebrauch zwangsläufig in physischen Kontakt mit dem Patienten kommt, damit das ME-Gerät oder ein ME-System seine Funktion erfüllen kann
IEC 60601-1 3.8
Bei IVD ist eine andere Norm anwendbar, die IEC 61010-1.
Weiterführende Informationen
Lesen Sie hier mehr
2. Anforderungen der IEC 60601-1
a) Anforderungen an die physikalische und funktionale Sicherheit
Die Norm stellt Anforderungen an:
b) Weitere Anforderungen und Konzepte
Die Norm definiert eine Vielzahl an Begriffen wie Erstfehler, Erstfehler-Sicherheit, wesentliche Leistungsmerkmale, Basissicherheit, MOP, MOOP, MOPP und viele mehr.
c) Referenzierte Anforderungen
Sie verweist bei weiteren Anforderungen auf andere Normen:
3. Mitglieder der Normenfamilie
Die Normenfamilie besteht aus drei Typen:
- Die Basisnorm selbst
- Die Kollateralnormen der Serie ergänzen Querschnittsaspekte.
- Die Partikularnormen sind für bestimmte Typen an Medizinprodukten anwendbar.
 Abb. 1: Die Normenfamilie besteht aus der Basisnorm, Kollateral- und Partikularnormen.
Abb. 1: Die Normenfamilie besteht aus der Basisnorm, Kollateral- und Partikularnormen.
4. Aktuelles zur Norm
Die Normen werden regelmäßig überarbeitet. Stand 2023 sind die folgenden Versionen gültig:
|
Basisnorm |
EMV-Norm |
… |
| International |
IEC 60601-1:2005
+ A1:2012 + A2:2020 |
|
|
| EU |
EN IEC 60601-1:2006
+ A1:2013 + A2:2021 |
EN IEC 60601-1-2:2015
+ A1:2021 |
|
| USA (FDA) |
ANSI AAMI ES60601-1:2005
+ A1:2012 + A2:2021 (ab 17.12.2023) |
ANSI AAMI IEC 60601-1-2:2014
+ A1:2021 |
|
Sie finden weiter unten Fachartikel, die die jeweiligen Änderungen bzw. Unterschiede zwischen den Versionen beschreiben.
5. Unterstützung beim Umgang mit der Norm
Haben Sie noch Fragen zur Norm? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie sich tiefer in das Thema einarbeiten wollen, dann bieten sich an:
- Das zweitätige Intensivseminar
- Ein umfangreicher Selbstlernkurs in der Johner Academy
Melden Sie sich, wenn Sie Unterstützung benötigen bei
- der Entwicklung sicherer ME-Geräte und PEMS,
- der Prüfung dieser Geräte,
- der Auswahl eines Prüflabors,
- dem Erstellen einer schlanken und normenkonformen Technischen Dokumentation.
Damit stellen Sie sicher, dass Sie Ihre Produkte schnell und sicher entwickeln und ohne Probleme bei der Zulassung in den Markt bekommen.
Medizinprodukte basieren zunehmend auf Closed-Loop-Systemen. Diese „geschlossenen Regelsysteme“ finden bereits in der Medizinprodukteverordnung MDR Erwähnung. Ein Beispiel ist ein System aus einer Insulinpumpe, die von einem Gerät mit Glukosesensor gesteuert wird. Sie erfahren in diesem Artikel, was Closed-Loop-Systeme sind, wo sie in der Medizin zum Einsatz kommen und welche regulatorischen Anforderungen sie erfüllen müssen. Der…
Details
Der Begriff klinische Validierung wird häufig auch im Zusammenhang mit Medizinprodukten verwendet. Beispielsweise veröffentlicht das BMBF eine Richtlinie zum Thema „Klinische Validierung innovativer medizintechnischer Lösungen“. Auch die FDA spricht von clinical validation. Was ist eine klinische Validierung? Was unterscheidet sie von einer klinischen Bewertung und einer klinischen Prüfung? Sind klinische Validierungen überhaupt vorgeschrieben? Hier in…
Details
ASCA steht für Accreditation Scheme for Conformity Assessment. Das Verfahren soll Konformitätsbewertungen und damit Zulassungsverfahren beschleunigen. Es ist aber weder bei allen Produkten noch bei allen Märkten anwendbar. Wer von ASCA profitiert und wie das Verfahren abläuft, erläutert dieser Artikel.
Details
Die Systemarchitektur beschreibt, aus welchen Komponenten ein (Medizin)produkt zusammengesetzt ist und wie diese Komponenten über Schnittstellen miteinander in Beziehung stehen. Bei Standalone-Software fallen Systemarchitektur und Software-Architektur zusammen.
Mangelhaft gestaltete Gebrauchsanweisungen sind häufig Ursache für Benutzungsfehler, welche zu Schäden bei Patienten und Anwendern führen können. Zudem unterliegen Gebrauchsanweisungen für Medizinprodukte und IVD strengen regulatorischen Anforderungen. MDR, IVDR, die FDA sowie zahlreiche Normen stellen spezifische Anforderungen an Gebrauchsanweisungen. In diesem Artikel erfahren Sie, wie Sie eine Gebrauchsanweisung schreiben,
Details
Die MDCG hat im Oktober 2023 eine Leitlinie MDCG 2023-4 veröffentlicht mit dem Titel „Medical Device Software (MDSW) – Hardware combinations – Guidance on MDSW intended to work in combination with hardware or hardware components”.
Die EU plant, mit der neuen EU-Verordnung zu Batterien und Altbatterien („Batterieverordnung“) die EU die bestehende Richtlinie 2006/66/EG zu ersetzen. Dieser Artikel klärt darüber auf,
Details
Der Begriff „Medizinprodukte-PC“ ist nicht eindeutig definiert. Allerdings verstehen unter einem Medizinprodukte-PC die meisten Abhängig von den Konstellationen müssen die Hersteller unterschiedliche regulatorische Anforderungen erfüllen. Diese werden im vorliegenden Artikel vorgestellt.
Details
Gesetze und Normen formulieren Anforderungen, wie Medizinproduktehersteller den Entwicklungsprozess festlegen und dokumentieren müssen. Diese Anforderungen prüfen Benannte Stellen bei Audits. Dieser Artikel zum Entwicklungsprozess gibt Ihnen Tipps zu dessen Gestaltung und zum Abgleich mit anderen Prozessen wie dem Risikomanagementprozess.
Details
Medizinprodukte müssen die gesetzlichen Anforderungen an die funktionale Sicherheit, auch Funktionssicherheit und „functional safety“ genannt, erfüllen. Leider verwenden und definieren die relevanten Normen und Gesetze für Medizinprodukte den Begriff „funktionale Sicherheit“ nicht. Dieser Artikel verschafft Klarheit.
Details