Die IEC 60601-1 ist die Norm mit dem Titel „Allgemeine Festlegungen für die Sicherheit einschließlich der wesentlichen Leistungsmerkmale“.
Inhalt
Diese Seite verschafft Ihnen eine schnelle Übersicht über die IEC 60601-1 und hilft Ihnen mit Verweisen auf weitere Fachartikel zu den folgenden Themen:
- Anwendbarkeit der Norm
- Anforderungen der Norm
- Mitglieder der Normenfamilie
- Aktuelles zur Norm
- Unterstützung beim Umgang mit der Norm
1. Anwendbarkeit der Norm
Die Norm findet bei medizinisch-elektrischen Geräten (ME-Geräte) Anwendung. Allerdings nur, wenn diese Geräte über ein Anwendungsteil verfügen.
Definition: Anwendungsteil
Teil des ME-Geräts, das bei bestimmungsgemäßem Gebrauch zwangsläufig in physischen Kontakt mit dem Patienten kommt, damit das ME-Gerät oder ein ME-System seine Funktion erfüllen kann
IEC 60601-1 3.8
Bei IVD ist eine andere Norm anwendbar, die IEC 61010-1.
Weiterführende Informationen
Lesen Sie hier mehr
2. Anforderungen der IEC 60601-1
a) Anforderungen an die physikalische und funktionale Sicherheit
Die Norm stellt Anforderungen an:
b) Weitere Anforderungen und Konzepte
Die Norm definiert eine Vielzahl an Begriffen wie Erstfehler, Erstfehler-Sicherheit, wesentliche Leistungsmerkmale, Basissicherheit, MOP, MOOP, MOPP und viele mehr.
c) Referenzierte Anforderungen
Sie verweist bei weiteren Anforderungen auf andere Normen:
3. Mitglieder der Normenfamilie
Die Normenfamilie besteht aus drei Typen:
- Die Basisnorm selbst
- Die Kollateralnormen der Serie ergänzen Querschnittsaspekte.
- Die Partikularnormen sind für bestimmte Typen an Medizinprodukten anwendbar.
 Abb. 1: Die Normenfamilie besteht aus der Basisnorm, Kollateral- und Partikularnormen.
Abb. 1: Die Normenfamilie besteht aus der Basisnorm, Kollateral- und Partikularnormen.
4. Aktuelles zur Norm
Die Normen werden regelmäßig überarbeitet. Stand 2023 sind die folgenden Versionen gültig:
|
Basisnorm |
EMV-Norm |
… |
| International |
IEC 60601-1:2005
+ A1:2012 + A2:2020 |
|
|
| EU |
EN IEC 60601-1:2006
+ A1:2013 + A2:2021 |
EN IEC 60601-1-2:2015
+ A1:2021 |
|
| USA (FDA) |
ANSI AAMI ES60601-1:2005
+ A1:2012 + A2:2021 (ab 17.12.2023) |
ANSI AAMI IEC 60601-1-2:2014
+ A1:2021 |
|
Sie finden weiter unten Fachartikel, die die jeweiligen Änderungen bzw. Unterschiede zwischen den Versionen beschreiben.
5. Unterstützung beim Umgang mit der Norm
Haben Sie noch Fragen zur Norm? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie sich tiefer in das Thema einarbeiten wollen, dann bieten sich an:
- Das zweitätige Intensivseminar
- Ein umfangreicher Selbstlernkurs in der Johner Academy
Melden Sie sich, wenn Sie Unterstützung benötigen bei
- der Entwicklung sicherer ME-Geräte und PEMS,
- der Prüfung dieser Geräte,
- der Auswahl eines Prüflabors,
- dem Erstellen einer schlanken und normenkonformen Technischen Dokumentation.
Damit stellen Sie sicher, dass Sie Ihre Produkte schnell und sicher entwickeln und ohne Probleme bei der Zulassung in den Markt bekommen.
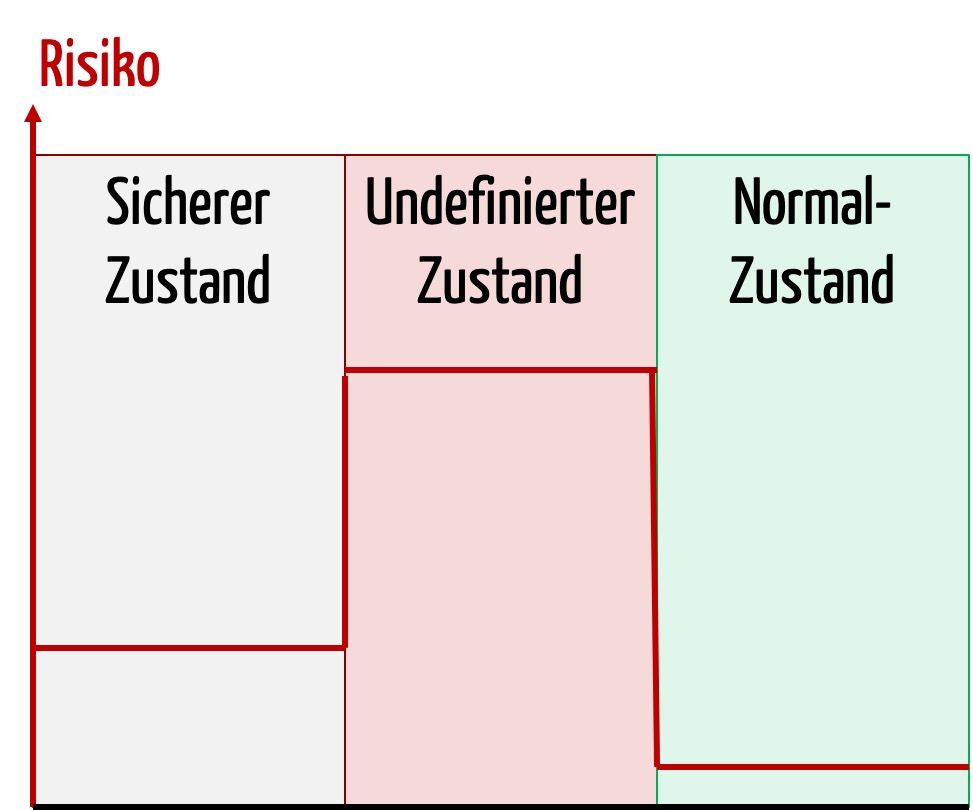
Ein sicherer Zustand wird von der IEC 60601-1 als eine mögliche Maßnahme gefordert. Was ein sicherer Zustand ist, definiert die Norm allerdings nicht. Was ist also ein sicherer Zustand? Antworten auf diese Frage und Tipps, wie Sie einen sicheren Zustand Ihres Medizinprodukts erreichen, finden Sie in diesem Artikel.
Details
Die FDA bieten Herstellern an, sogenannte recognized consensus standards bei der Zulassung ihrer Produkte zu nutzen. Die US-Behörde hat zu diesen consensus standards ein „Guidance“ Dokument veröffentlicht, das Ihnen dieser Artikel vorstellt. Er beschreibt zudem die Voraussetzungen für die Anwendung der „Standards“ und die Vorteile für Hersteller, weist aber auch auf typische Fehler hin.
Details
Während das Englische die Begriffe Safety und Security unterscheidet, kennen wir im Deutschen nur die Sicherheit. Zwar haben beide Begriffe mit einander zu tun, sind aber nicht deckungsgleich.
Der Begriff „kritische Bauteile“ wird häufig im Kontext der IEC 60601-1 verwendet. Beispielsweise sei eine „Liste kritischer Bauteile“ zu erstellen. Auch wenn die Norm den Begriff „kritisches Bauteil“ weder verwendet noch definiert, gibt es Gründe, eine solche Liste an Bauteilen zu führen. Inhaltsübersicht Begriff und Beispiele » Regulatorische Anforderungen » Wann ist eine Komponente kritisch?…
Details
Die IEC 61010-2-101 ist eine für In-vitro-Diagnostik (IVD) harmonisierte Norm. IVD-Hersteller können die IEC 61010 nutzen, um die Konformität mit den grundlegenden Sicherheit- und Leistungsanforderungen der IVD-Verordnung (IVDR) nachzuweisen.
Wann zählt ein PC zur Medical IT, wann als Medizinprodukt? Die Antwort auf diese Fragen hat weitgehende regulatorische Konsequenzen.
MOPP, MOOP und MOP: Die Norm für medizinische elektrische Geräte IEC 60601-1 benutzt diese Akronyme für „Means of Patient Protection“, „Means of Operator Protection“ und „Means of Protection“. Was es mit diesen zentralen Begriffen der Norm auf sich hat und welche Anforderungen mit ihnen verbunden sind, erfahren Sie in diesem Artikel.
Die IEC 60601-1 definiert ein PESS, ein programmierbares elektronisches Subsystem, als System, das auf einer oder mehreren zentralen Prozessoreinheiten beruht, einschließlich deren Software und Schnittstellen. Die Norm verrät nicht, was sie unter System versteht, es ist in diesem Kontext eine Komponente des Medizinprodukts. Dafür stellt die IEC 60601-1 konkrete Anforderungen an die PESS.
Details
Medizingeräte verfügen über zahlreiche Hardware-Schnittstellen. Diese sollten Hersteller genau dokumentieren, um das Produkt ohne unnötige Nachbesserungen entwickeln, Testfälle ableiten und regulatorische Forderungen erfüllen zu können. Dieser Beitrag gibt Tipps, wie es Ihnen gelingen wird, die Hardware-Schnittstellen Ihrer Medizinprodukte schnell und präzise zu spezifizieren.
Details
„Wie schreibt man erstfehlersichere Software?“ lautet die Frage, die mir eine Teilnehmerin meines Seminars medizinische Software stellt. Eine exzellente Frage, die ich nicht in einem Satz beantworte möchte: