Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Das Medical Device Single Audit Program (MDSAP) wurde ins Leben gerufen, um einen Wunsch vieler Medizinproduktehersteller zu erfüllen: Statt vieler Audits und Inspektionen durch die Behörden verschiedener Länder soll es nur noch eines geben. Die Teilnahme am MDSAP soll ausreichen, um die Wirksamkeit und Konformität von QM-Systemen (z. B. Konformität mit ISO 13485 oder 21…
Details
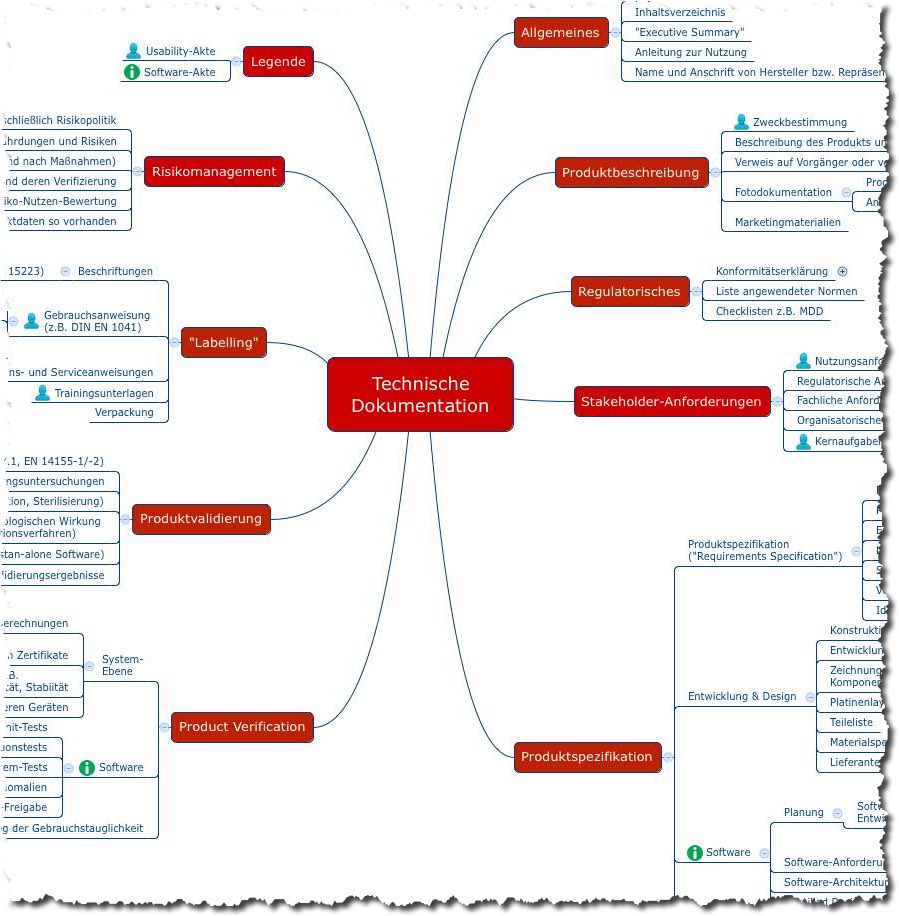
Ist die STED (Summary Technical Documentation) und deren Nachfolger ToC (Table of Contents) die Lösung für Medizinproduktehersteller, die ihre Produkte international zulassen müssen? Dieser Beitrag stellt die STED bzw. ToC und vor damit einen Vorschlag, wie Hersteller die technische Dokumentation strukturieren können.
Details
Mit dem Pre-Submission-Programm (kurz „Pre-Sub“) bietet die FDA ein formales Verfahren an, mit dem Hersteller bereits vor der eigentlichen Zulassung ihre Zulassungsstrategie sowie konkrete Fragen klären können. Ein Pre-Sub Request eignet sich unter anderem im Vorfeld von 510(k)s, De Novo Requests oder auch PMAs. Damit können auf beiden Seiten unnötige Kosten und Aufwände vermieden werden. Das Johner…
Details
Der Brexit wurde mit dem 01.01.2021 vollzogen. Was für manche ein Grund zum Feiern war, bedeutet für viele eine zusätzliche Last – auch für die Hersteller von Medizinprodukten. Für Hersteller ist es wichtig zu verstehen, welche regulatorischen Anforderungen sie erfüllen müssen und von welchen Übergangsfristen sie profitieren, wenn sie ihre Produkte weiterhin in Großbritannien verkaufen…
Details
Mit dem eStar-Programm möchte die FDA die Effizienz von Zulassungsverfahren (z. B. der 510(k)-Verfahren) durch Digitalisierung erhöhen. Bei der Weiterentwicklung von eStar arbeitet das Johner Institut mit der FDA zusammen. Wie zukunftsweisend dieser Ansatz ist und ob Sie daran teilnehmen sollten oder gar müssen, erfahren Sie in diesem Artikel.
Details
Es ist nicht einfach, in Brasilien Medizinprodukte zuzulassen. Das liegt sowohl an der Anzahl und Komplexität der Regularien als auch an der Tatsache, dass Brasilien die meisten Regularien nur auf Portugiesisch veröffentlicht hat. Dieser Artikel verschafft Ihnen einen Überblick und stellt die Gemeinsamkeiten mit dem europäischen und dem US-amerikanischen System vor. So wird es Ihnen…
Details
Das De-Novo-Verfahren, die FDA spricht auch vom „de novo program“ und vom „de novo submission process“, ist eines der Zulassungsverfahren für Medizinprodukte in den USA. Dieses Verfahren können Hersteller für neuartige Produkte anwenden – wie der Name „de novo“ bereits vermuten lässt. Hersteller sollten also einen De-Novo-Antrag für ein Produkt stellen, für das es kein…
Details
Orphan Medical Devices sind Medizinprodukte (und IVD) für kleine Patientengruppen. Die Entwicklung dieser Nischenprodukte rechnet sich für die Hersteller oft nicht. Das führt dazu, dass besonders vulnerable Gruppen wie Kinder nicht immer ausreichend medizinisch versorgt werden können. Dieser Artikel zeigt Lösungsansätze auf und ordnet die Leitlinie MDCG 2024-10 ein.
Details
Klinische Studien in Australien durchzuführen, haben viele Medizinproduktehersteller nicht auf dem Schirm. Dabei gibt es gute Gründe, für klinische Studien bzw. klinische Prüfungen auch diesen Kontinent in Betracht zu ziehen. Hersteller sollten dann aber auch die regulatorischen Anforderungen Australiens und spezifische Nachteile kennen.
Abweichungen, Nichtkonformitäten, Fehler, Findings und weitere Begriffe werden fälschlicherweise oft synonym verwendet. Sogar Normen widersprechen sich bei der Definition einzelner Begriffe explizit. Dieser Artikel klärt,
Details