Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
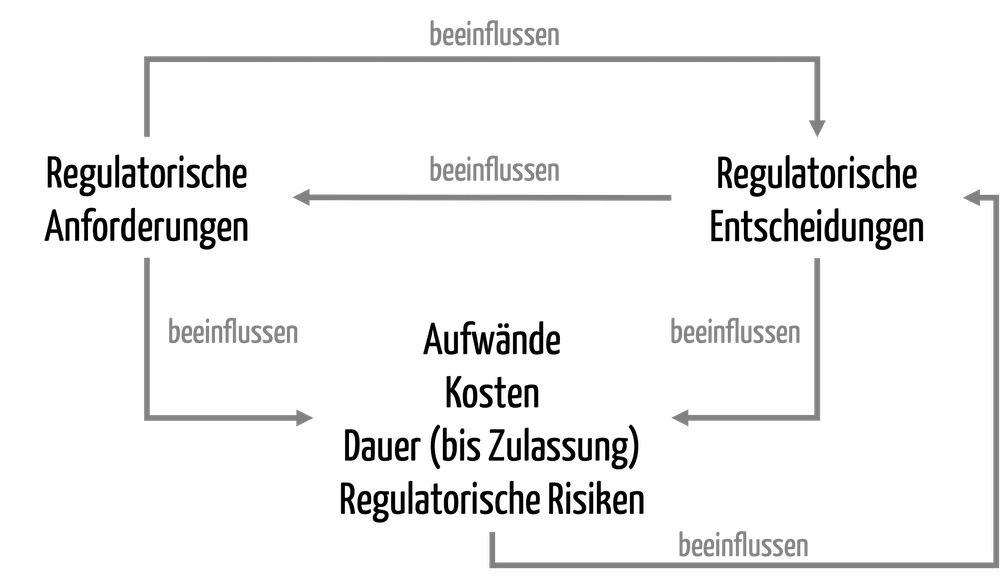
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Eine „FDA Registration“ ist eine gesetzlich vorgeschriebene Eintragung von „Establishments“ (wie Medizinprodukteherstellern) in eine FDA-Datenbank. Die FDA Registration darf nicht mit der UDI-Registrierung in der GUDID-Datenbank oder gar einer FDA-Zulassung verwechselt werden. Dieser Artikel beantwortet die wichtigsten Fragen und hilft, die häufigsten Fehler bei der FDA Registration zu vermeiden.
Details
Unternehmen müssen die digitale Transformation schnell und erfolgreich bewältigen. Das gilt auch für Medizinproduktehersteller. Denn ihre Zukunft hängt davon ab. Bei dieser Transformation begehen viele Unternehmen folgenreiche Fehler (s. 4. Abschnitt). Daher gibt dieser Fachartikel insbesondere Führungskräften einen schnellen Überblick über die Möglichkeiten der digitalen Transformation. Sie erhalten sieben Tipps, damit diese zum Erfolg wird.…
Details
Das Breakthrough Devices Program ist ein Zulassungsverfahren für Medizinprodukten, mit dem die FDA schwerstkranken Patienten einen schnelleren Zugang zu neuartigen Medizinprodukten ermöglichen möchte. Die Behörde hat dazu im Dezember 2018 ein „Guidance Document“ veröffentlicht. Sie erfahren in diesem Artikel,
Details
Eine FDA-Inspektion ist für viele Hersteller von Medizinprodukten mit großem Stress verbunden. Viele Firmen kennen die möglichen Konsequenzen wie einen öffentlichen Warning Letter und gar eine strafrechtliche Verfolgung. Aber sie wissen oft nicht, wie sie diese Konsequenzen sicher vermeiden können, ohne tagelang das ganze Unternehmen stillzulegen. Dieser Artikel zeigt, wie So wird eine FDA-Inspektion für…
Details
Phantome in der Medizintechnik helfen, Medizinprodukte schneller und wirkungsvoller zu validieren, „zuzulassen“ und in den Märkten zu überwachen. Dieser Artikel beschreibt, welche Organisationen besonders vom Einsatz dieser Phantome profitieren und welche Voraussetzungen sie dafür erfüllen müssen.
Details
Die regulatorische Strategie festzulegen, zählt zu den zentralen Aufgaben der Regulatory-Affairs-Abteilungen bei Medizinprodukteherstellern. Weshalb ist eine gute regulatorische Strategie so wichtig? Was müssen die Regulatory Affairs Experts tun? Antworten liefert dieser Artikel.
Details
Der Begriff ‚Predicate Device‘ fällt meist im Kontext von 510(k)-Zulassungen der FDA. Allerdings definiert die FDA diesen Begriff nicht. Sie legt hingegen fest, was ‚Substantial Equivalence‘ ist. Klingt kompliziert? Der Nachweis der Äquivalenz ist keinesfalls nur im Kontext der FDA relevant. Deshalb verschafft dieser Artikel Klarheit – gerade, aber nicht nur für Hersteller, die ihre…
Details
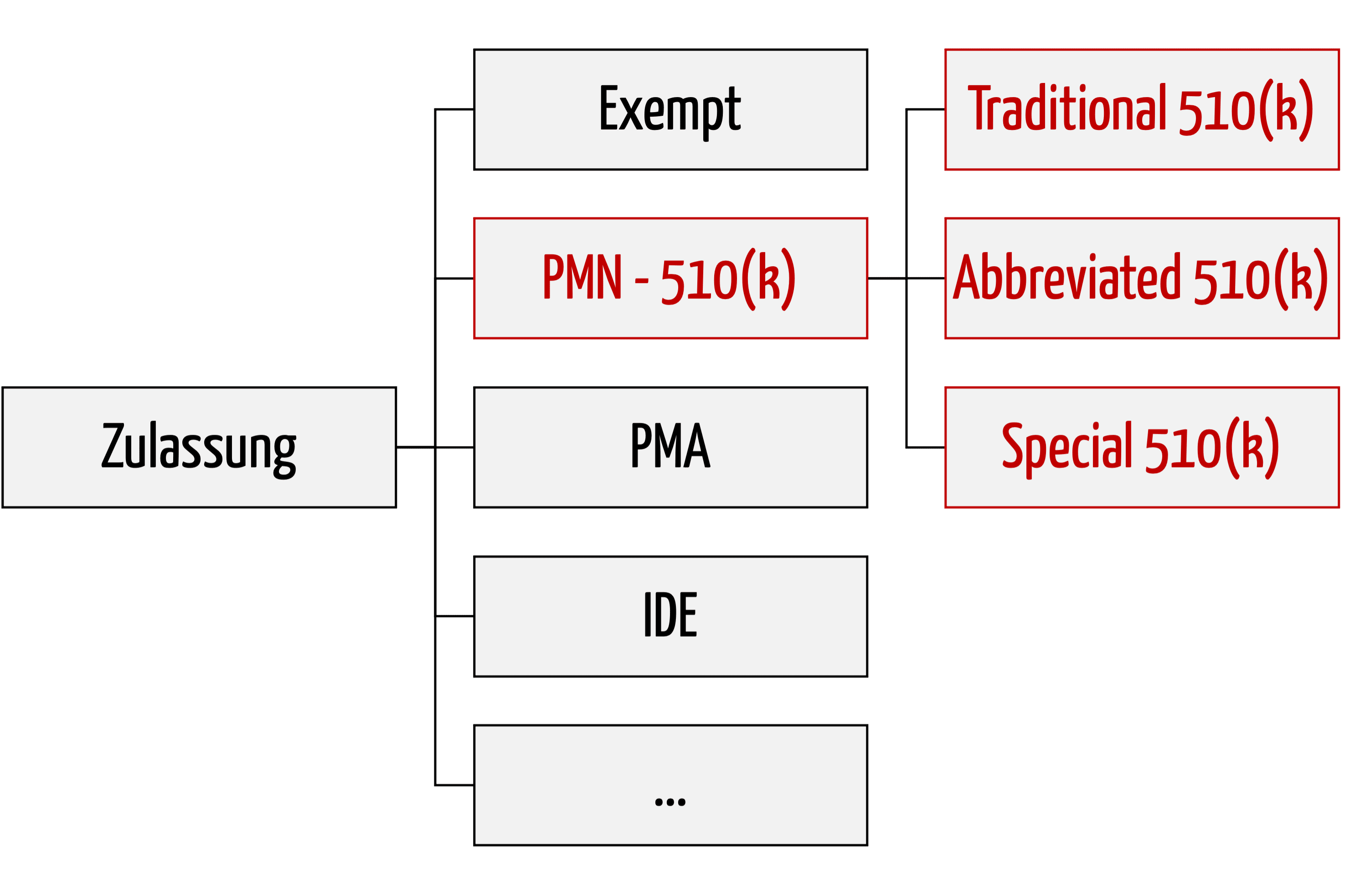
Die 510(k)-Zulassung ist das wichtigste Verfahren, um Medizinprodukte in den USA zuzulassen. Es wird auch als Premarket Notification (PMN) bezeichnet. Dieser Artikel verschafft eine schnelle Übersicht über das Verfahren und die Dokumente, die einzureichen sind.
Details
Die Branchenanalyse Medizintechnik aus dem Jahre 2020 veranschlagte den Markt für Medizinprodukte in Südkorea auf 6,7 Mrd. USD. Aufgrund einer jährlichen Wachstumsrate der Importe von (geschätzt) 10 % und der zunehmenden Überalterung der Bevölkerung bei gleichzeitigem Anstieg der medizinischen Grundversorgung ist mit einem kontinuierlichen Wachstum des südkoreanischen Markts zu rechnen. Dieser Beitrag zeigt auf, welche…
Details
Medizinproduktehersteller haben hohe Erwartungen an Regulatory Information Management Systems (RIMS). Kosten und Aufwände dafür sind immens und meist viel höher als geschätzt. Der Nutzen steht hingegen nicht fest. Dieser Artikel liefert Ihnen die entscheidenden Hinweise,
Details