Gesundheitsanbieter wie Krankenhäuser, Klinken, Praxen und Labore unterliegen umfangreichen regulatorischen Anforderungen. Genau wie die Medizinproduktehersteller.
Inhalt
Diese Seite stellt wichtige Fachartikel für diese Anwender und Betreiber zusammen.
- Regulatorische Anforderungen
- IT in Krankenhäusern und Praxen
- Umgang der Krankenhäuser mit Medizinprodukten
- Unterstützung für Krankenhäuser
1. Regulatorische Anforderungen
a) Regulatorische Anforderungen an die Betreiber
Den übergeordneten gesetzlichen Rahmen bilden die EU-Medizinprodukteverordnungen MDR und IVDR. Ein Artikel beleuchtet deren Auswirkungen auf Gesundheitseinrichtungen wie Krankenhäuser.
In Deutschland werden diese Anforderungen konkretisiert durch
Alle drei betreffen explizit auch Krankenhäuser und andere Betreiber.
Aus der MPBetreibV folgt die Pflicht zum Führen eines Medizinproduktebuchs.
Eine zentrale gesetzliche Vorgabe ist das Risikomanagement der Krankenhäuser.
b) Spezielle Anforderungen an die medizinischen Labore
Die EU reguliert medizinische Labore. Deshalb sollten diese sich mit den Anforderungen an Inhouse IVD (LDT) und die Laborprodukte „For Research Use Only“ (RUO) vertraut machen.
2. IT der Krankenhäuser, Labore und Praxen
Die Digitalisierung der Krankenhäuser schreitet (zu) langsam voran und stellt die IT der Krankenhäuser und Arztpraxen vor große Aufgaben.
a) Krankenhaus-IT aus regulatorischer Sicht
Die Krankenhaus-IT sollte aus regulatorischer Sicht bei diesen Punkten besonders aufpassen:
b) Anforderungen an die IT-Sicherheit
Einen Einstieg liefert der Artikel IT-Sicherheit im Gesundheitswesen.
Die IEC 80001-1 gibt Vorgaben zum Risikomangement bei der Krankenhaus-IT.
Hersteller müssen Sicherheitsprobleme melden. Deren Schweregrad können sie mithilfe des Common Vulnerability Scoring System (CVSS) einteilen.
Sie sollten Security Patches einspielen und die regulatorischen Implikationen kennen.
c) Anforderungen an den Datenschutz in Krankenhäusern
Die IT-Sicherheit ist eine Grundlage für den Datenschutz. Eine Einführung liefert der Artikel Datenschutz im Gesundheitswesen bei medizinischen Daten.
Ein Weg, um die Datenschutzanforderungen zu erfüllen, ist die Anonymisierung und Pseudonymisierung von personenbezogenen Daten.
All dies muss ein Datenschutzbeauftragter im Gesundheitswesen überwachen.
d) Spezielle Systeme
Mitarbeiter der Krankenhaus-IT haben vielerlei Systeme auszuwählen, zu installieren und zu administrieren:
Eine besondere Herausforderung ist die Interoperabilität dieser Produkte.
3. Umgang der Krankenhäuser mit Medizinprodukten
a) Anforderungen an konkrete Tätigkeiten
Gesetze und Normen stellen Anforderungen an alle Phasen des Produktlebenszyklus:
In diesem Kontext ist die Festlegung der Lebensdauer von Medizinprodukten entscheidend.
b) Anforderungen an spezielle (Medizin-)Produkte
Zudem gibt es Anforderungen an spezielle Typen von Produkten:
4. Unterstützung für Krankenhäuser und andere Betreiber
Haben Sie Fragen zur Auswahl, Anwendung und zum Betrieb von Medizinprodukten in Krankenhäusern, Laboren, Praxen und bei anderen Gesundheitsdienstleistern? Antworten erhalten Sie in unserem kostenlosen Micro-Consulting.
Die Seminare des Johner Instituts verschaffen den Mitarbeitenden in Gesundheitsanbietern einen guten Einstieg in Themen wie:
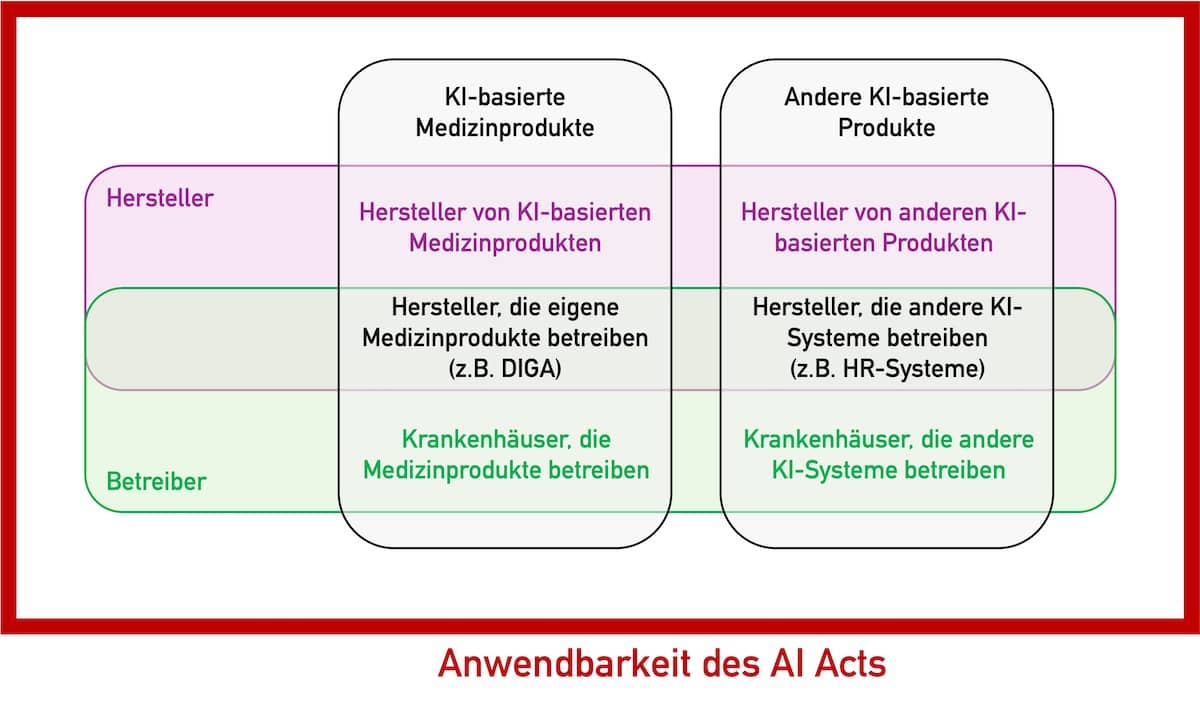
Die EU-KI-Verordnung (EU AI Act) ist veröffentlicht. Viele Hersteller von Medizinprodukten und IVD sowie andere Akteure im Gesundheitswesen stehen vor der großen Aufgabe, den über 140 Seiten umfassenden Gesetzestext zu verstehen und die Anforderungen zu erfüllen. Beachten Sie: Verstöße gegen den AI Act werden mit Geldstrafen in Höhe von bis zu 7 % des jährlichen Umsatzes geahndet. Dieser…
Details
Dieser Artikel untersucht die Anwendbarkeit des AI Acts für Hersteller von Medizinprodukten und IVD, die keine KI-basierten Produkte in den Verkehr bringen. Unter anderem beantwortet er die Frage, ob ein Hersteller den AI Act beachten muss, falls er ChatGPT verwendet oder zur eigenen Nutzung ein KI-System entwickelt, das Kundenrückmeldungen klassifiziert.
Details
Die Verordnung (EU) 2025/327 über den europäischen Gesundheitsdatenraum (European Health Data Space, kurz EHDS) ist eine weitere europäische Verordnung, die Hersteller von Medizinprodukten und IVD betreffen kann. Was diese Verordnung fordert und was diese Hersteller bis wann tun müssen, klärt dieser Artikel ebenso wie mögliche Vorteile des EHDS bzw. der EHDS-VO.
Details
Medizinprodukte über das Ende der Lebensdauer hinaus zu betreiben kann gefährlich und rechtlich problematisch sein. Daher sollten Hersteller die genaue Lebensdauer bei jedem Produkt präzise bestimmen. Doch könnten Sie auf die Schnelle sagen, wie Lebensdauer definiert oder nach welchen Kriterien sie bestimmt wird? Verwandte Begriffe wie „Nutzungsdauer“, “Haltbarkeit”, “Betriebszeit” bzw. „Service Life“ und „Shelf Life“…
Details
Die Begriffe Wartung, Instandhaltung, Instandsetzung, Inspektion, Service und sicherheitstechnische Kontrolle sind nicht synonym. Aber alle bezeichnen Aktivitäten im Lebenszyklus von Medizinprodukten, die dem Ziel dienen, die Sicherheit, Leistungsfähigkeit und Wirksamkeit dieser Produkte auch nach der Inverkehrbringung zu gewährleisten. Hersteller und Betreiber müssen die regulatorischen Anforderungen an die Wartung bzw. Instandhaltung erfüllen. Diese Vorgaben sind oft…
Details
Die In-vitro-Diagnostik-Verordnung der EU (IVDR) betrifft viele medizinische Labore, obwohl diese Verordnung den Begriff „medizinisches Labor“ weder definiert noch verwendet. Welche Labore sind betroffen? Welche weiteren Gesetze müssen die Labore beachten? Und wie sollen sie all diese Anforderungen erfüllen? Dieser Artikel gibt Antworten.
Details
Über die Stilllegung bzw. Außerbetriebnahme von Medizinprodukten und über das Ende der Vermarktung wird wenig geschrieben. Dafür thematisieren hunderte Artikel die Inbetriebnahme und Inverkehrbringung von Medizinprodukten. Doch Hersteller und Betreiber stehen häufiger vor der Frage, ob und wie sie ihre Medizinprodukte stilllegen, deren Vermarktung beenden und idealerweise die Verantwortung für diese „Altprodukte“ loswerden können. Dieser…
Details
Eine Annahme hält sich hartnäckig: Allgemeiner Laborbedarf wie PCR-Cycler, NGS-Geräte, Fragment-Analyzer, Zentrifugen, Pipettier-Roboter und Extraktionskits müssen eine CE-IVD-Kennzeichnung tragen. Stimmt das? Es fehlt oft Klarheit darüber, Daher gibt es Unsicherheiten, um sich nicht strafbar zu machen. Dieser Artikel verschafft Klarheit und gibt Herstellern und Betreibern (z. B. medizinischen Laboren) konkrete Tipps, um regulatorischen Ärger und…
Details
Den Begriff „Probenahme-Set“ definiert weder die IVDR noch eine andere Regularie. Dennoch gibt es (indirekte) regulatorische Anforderungen, die IVD-Hersteller und medizinische Labore kennen und beachten müssen. Die Anforderungen hängen von der jeweiligen Konstellation ab. Dieser Artikel stellt fünf Konstellationen vor. Er verschafft damit Klarheit und hilft, regulatorischen Ärger zu vermeiden und regulatorische Aufwände zu minimieren.
Details
So stellen Sie sicher, dass Sie Ihre Inhouse-IVD (auch Laboratory Developed Tests, LDT genannt) auch unter der nun gültigen IVDR noch anbieten können. Sie haben drei Möglichkeiten, um Rechtsstreitigkeiten zu vermeiden. Inhouse-IVD zählen zu den in-vitro-diagnostischen Tests. Gelten für diese Art von Produkten auch regulatorische Anforderungen wie die IVDR? Dieser Artikel verschafft nicht nur medizinischen…
Details