1. Definitionen
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
- HEALTH SOFTWARE
Software intended to be used specifically for maintaining or improving health of individual persons, or the delivery of care
- MEDICAL SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device or intended to be a SOFTWARE MEDICAL DEVICE
- SOFTWARE MEDICAL DEVICE
Software intended to be a medical device in its own right
- MEDICAL DEVICE SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
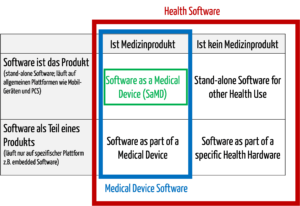
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
2. Regulatorische Anforderungen
a) Medizinische Software – ein Medizinprodukt?
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
b) Verordnungen, Gesetze, Normen
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
- In Europa sind Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten jedoch nur relativ allgemeine Vorschriften für Software, die dieser Fachartikel vorstellt.
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder „Health Software“ anwendbar. Die IEC 82304-1 fordert auch Konformität mit den Anforderungen der IEC 62304.
- Es gibt zudem MDCG-Leitlinien z.B. die MDCG 2019-11 und die MDCG 2023-4.
- Die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen, explizit auch an medizinische Software. Zudem beantwortete sie viele Fragen speziell zu Software as a Medical Device in diesem FAQ.
3. Unterstützung für Medizinproduktehersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Haben Sie Fragen zur Entwicklung und Zulassung von Medizinprodukte, die Software enthalten oder Software sind? Dann nutzen Sie das kostenfreie Micro-Consulting.
- Im Kompaktseminar Medizinische Software erwerben Sie die vorgeschriebenen Kompetenzen. Sie lernen die gesetzlichen Anforderungen an die Entwicklung von Software für die Medizintechnik kennen und erfüllen.
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
- Nutzen Sie auch die Unterstützung unserer Expertinnen und Experten. Sie helfen Ihnen, Ihre Software kurz, präzise und gesetzeskonform zu dokumentieren, und bereiten Sie auf Audits und „Tech File Reviews“ vor.
- Lassen Sie die IT-Sicherheit Ihrer Software durch Penetration Tests überprüfen.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
Unter der Barrierefreiheit – auf Englisch Accessibility – versteht man die Gestaltung von Angeboten, die auch von Menschen mit körperlichen Einschränkungen genutzt werden können. Der Begriff ‚Angebote‘ umfasst Bauwerke ebenso wie digitale und nichtdigitale Produkte. Das schließt auch Medizinprodukte (Geräte, App, Standalone-Software) ein. Welche Anforderungen an die Accessibility Hersteller von Medizinprodukten beachten sollten, um der…
Details
Die ISO/IEC 42001 trägt den Titel „Information technology – Artificial intelligence – Management system“. Erste Medizinproduktehersteller haben sich auf den Weg gemacht, sich nach dieser Norm zertifizieren zu lassen. Doch sind die Aufwände dafür gerechtfertigt? Hilft die ISO/IEC 42001 dabei, die Anforderungen des AI Act zu erfüllen? Antworten gibt dieser Artikel.
Details
Die EU-KI-Verordnung (EU AI Act) ist veröffentlicht. Viele Hersteller von Medizinprodukten und IVD sowie andere Akteure im Gesundheitswesen stehen vor der großen Aufgabe, den über 140 Seiten umfassenden Gesetzestext zu verstehen und die Anforderungen zu erfüllen. Beachten Sie: Verstöße gegen den AI Act werden mit bis zu 7 % des jährlichen Umsatzes bestraft. Dieser Artikel erspart Recherchearbeit und…
Details
Die Einbindung von KI bei Medizinprodukten hat große Fortschritte gemacht, z. B. bei der Diagnose von Krankheiten. Hersteller von Produkten mit Machine Learning stehen vor der Herausforderung, die Konformität ihrer Produkte nachweisen zu müssen. Auch wenn Sie die Gesetze kennen – welche Normen und Best Practices sind zu berücksichtigen, um die Nachweise zu führen und…
Details
Unter Software als Medizinprodukt (Software as Medical Device, SaMD) versteht man (eigenständige) Standalone-Software, die ein Medizinprodukt ist, aber nicht Teil eines solchen. Sie ist nicht zu verwechseln mit Medical Device Software im Sinne der EU. Wann müssen Sie als Hersteller Software als Medizinprodukt und wann als Medical Device Software qualifizieren? Das erfahren Sie hier – und können…
Details
Interne Software-Schnittstellen sind notwendig, um Software-Komponenten innerhalb eines Software-Systems zu verbinden. Externe Software-Schnittstellen sind die Voraussetzung dafür, dass das Software-System mit anderen Systemen kommunizieren kann. Dieser Artikel beschreibt, wie Sie Software-Schnittstellen gesetzeskonform und praxisnah dokumentieren können.
Details
Immer mehr Medizinprodukte nutzen künstliche Intelligenz, um Krankheitsbilder präziser zu diagnostizieren und Patienten wirksamer zu behandeln.
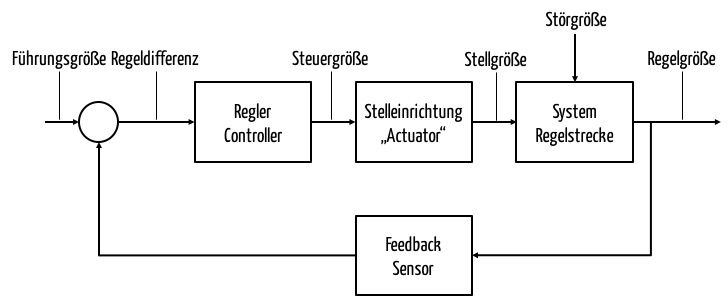
Medizinprodukte basieren zunehmend auf Closed-Loop-Systemen. Diese „geschlossenen Regelsysteme“ finden bereits in der Medizinprodukteverordnung MDR Erwähnung. Ein Beispiel ist ein System aus einer Insulinpumpe, die von einem Gerät mit Glukosesensor gesteuert wird. Sie erfahren in diesem Artikel, was Closed-Loop-Systeme sind, wo sie in der Medizin zum Einsatz kommen und welche regulatorischen Anforderungen sie erfüllen müssen. Der…
Details
Die IEC 62304 verpflichtet die Hersteller, die notwendige Segregation (auf Deutsch „Abgrenzung“) von Software-Komponenten zu bestimmen. Wie diese zu erfolgen hat, legt die Norm nicht fest, was zu vielen Diskussionen führt. Finden Sie hier Antworten auf häufige Fragen.
Viele Änderungen der Medizinprodukteverordnung (MDR) betreffen alle Hersteller von Medizinprodukten. Einige dieser Änderungen wenden sich besonders an Hersteller, deren Produkte Software enthalten oder Standalone-Software sind. Lesen Sie, was diese Hersteller beachten sollten.