Agile Softwareentwicklung für Medizinprodukte
Viele Medizinproduktehersteller schwören auf die agile Softwareentwicklung. Der nicht nur rechtlichen Implikationen ist man sich aber häufig nicht bewusst.
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
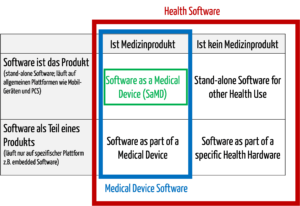
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
Lesen Sie hier mehr zum Thema gesetzeskonforme Software-Entwicklung und IEC 62304. Beachten Sie auch den Podcast zum Thema medizinische Software. Beachten Sie auch den Artikel zu den klinischen Informationssystemen z.B. zu den Patientendaten-Managementsystemen (PDMS).
Nutzen Sie die Unterstützung des Johner Instituts:
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
Viele Medizinproduktehersteller schwören auf die agile Softwareentwicklung. Der nicht nur rechtlichen Implikationen ist man sich aber häufig nicht bewusst.
Viele Digital Health Technologien und Anwendungen wie Machine Learning und Connected Home stehen im Gartner Hype Cycle gerade auf dem Gipfel der überzogenen Erwartungen. Hingegen durchleiden viele E-Health Technologien wie „Healthcare Master Data Management“ gerade das Tal der Tränen. Lernen Sie in diesem Artikel Digital Health und E-Health besser abzugrenzen. Erfahren Sie, wie die Politik…
DetailsGemeinsam mit dem TÜV SÜD, dem TÜV Nord und mit Unterstützung von Dr. Heidenreich (Siemens) hat das Johner Institut am 21.11. einen Leitfaden zur IT-Sicherheit speziell für Medizinproduktehersteller veröffentlicht.
Die IEC 62443-4-1 ist Teil einer Normenfamilie zur „IT-Sicherheit für industrielle Automatisierungssysteme“. Dieser Artikel stellt Ihnen den Teil 4-1 vor, der Anforderungen an den Lebenszyklus (Entwicklung, Wartung) von sicheren Produkten stellt. Er untersucht auch, ob diese Norm für Hersteller von Medizinprodukten sinnvoll anwendbar ist.
DetailsLOINC, die Logical Observation Identifiers Names and Codes, sind ein vom Regenstrief Institute gepflegtes System, um v.a. Laborparameter und Vitaldaten semantisch eindeutig zu verschlüsseln. Zunehmend findet das System auch in Deutschland Beachtung, auch von den Medizintechnik-Unternehmen. Die FDA legt diesen semantischen Standard besonders den IVD-Herstellern nahe. Mit Recht! Inhaltsübersicht Ziele von LOINC » Achsen » Zusammenspiel…
DetailsFuzz-Testing ist eine Methode zur Identifizierung bisher nicht-erkannter Schwachstellen und Sicherheitslücken in Software (stand-alone oder embedded), die die Schnittstellen der Systeme automatisiert mit korrekten oder falschen Werten testet.
Unter einem Security Patch versteht man eine Nachbesserung an einer Software, um eine Sicherheitslücke zu stopfen. Für einen Security Patch gelten teilweise andere regulatorische Anforderungen als an andere Software Updates. Auf was Sie achten müssen, erfahren Sie in diesem Beitrag.
Der UL 2900-2-1 nennt sich „Particular Requirements for Network Connectable Components of Healthcare and Wellness Systems“. Er zählt zur UL-2900-Familie, der Normenfamilie zur IT-Security. Lesen Sie in diesem Artikel, welche Schwächen der Standard hat und unter welchen Umständen er Ihnen dennoch nützlich sein kann.
DetailsDie IEC 62304 hat das Konzept der Sicherheitsklassifizierung eingeführt, damit Medizinproduktehersteller den Aufwand für die Software-Dokumentation an den Grad möglicher Schäden anpassen können, die durch einen Softwarefehler verursacht würden. Dieser Artikel hilft Ihnen, die Sicherheitsklassen zu bestimmen und IEC 62304 konform zu dokumentieren. Update: Keine Konformitätsvermutung mehr bei Sicherheitsklasse A? Mehr…
DetailsDieser Artikel beschreibt die Anforderungen der In-vitro Diagnostic Regulation IVDR an die Entwicklung und Dokumentation der Software. Die Anforderungen betreffen sowohl Software, die Teil eines IVDs ist (embedded Software), als auch Software, die selbst ein IVD darstellt (standalone Software). Ebenso finden Sie in diesem Beitrag einen Vergleich der Anforderungen der MDR und der IVDR an die Software.
DetailsWir nutzen Cookies auf unserer Website. Einige von ihnen sind essenziell, während andere uns helfen, diese Website und Ihre Erfahrung zu verbessern. Wenn Sie unter 16 Jahre alt sind und Ihre Zustimmung zu freiwilligen Diensten geben möchten, müssen Sie Ihre Erziehungsberechtigten um Erlaubnis bitten. Wir verwenden Cookies und andere Technologien auf unserer Website. Einige von ihnen sind essenziell, während andere uns helfen, diese Website und Ihre Erfahrung zu verbessern. Personenbezogene Daten können verarbeitet werden (z. B. IP-Adressen), z. B. für personalisierte Anzeigen und Inhalte oder Anzeigen- und Inhaltsmessung. Weitere Informationen über die Verwendung Ihrer Daten finden Sie in unserer Datenschutzerklärung. Sie können Ihre Auswahl jederzeit unter Einstellungen widerrufen oder anpassen.
Wenn Sie unter 16 Jahre alt sind und Ihre Zustimmung zu freiwilligen Diensten geben möchten, müssen Sie Ihre Erziehungsberechtigten um Erlaubnis bitten. Wir verwenden Cookies und andere Technologien auf unserer Website. Einige von ihnen sind essenziell, während andere uns helfen, diese Website und Ihre Erfahrung zu verbessern. Personenbezogene Daten können verarbeitet werden (z. B. IP-Adressen), z. B. für personalisierte Anzeigen und Inhalte oder Anzeigen- und Inhaltsmessung. Weitere Informationen über die Verwendung Ihrer Daten finden Sie in unserer Datenschutzerklärung. Hier finden Sie eine Übersicht über alle verwendeten Cookies. Sie können Ihre Einwilligung zu ganzen Kategorien geben oder sich weitere Informationen anzeigen lassen und so nur bestimmte Cookies auswählen.