Als Medizintechnik versteht man eine Untermenge der Medizinprodukte, die auch als Medizingeräte bezeichnet wird. Gleichzeitig bildet die Medizintechnik eine organisatorische Einheit in Krankenhäusern.
Inhalt
Diese Seite verschafft Herstellern und Betreibern von Medizintechnik bzw. Medizingeräten einen schnellen Überblick über die
- Medizintechnik / Medizingeräte selbst,
- regulatorischen Anforderungen an die Medizintechnik und
- Unterstützung beim Einhalten dieser Anforderungen.
1. Überblick über die Medizintechnik / Medizingeräte
a) Begriffe und Taxonomie
Der Begriff Medizinprodukt stellt den Überbegriff für viele Produktkategorien dar. Man unterscheidet beispielsweise:
- Aktive und nicht aktive Medizinprodukte: Aktive Medizinprodukte sind solche, die eine Energieversorgung haben, in der Regel in Form eines Netzanschlusses oder einer Batterie bzw. eines Akkus.
- Medizinprodukte mit und ohne Messfunktion: Auch bei Produkten mit Messfunktion müssen die Hersteller bei der Konformitätsbewertung eine Benannte Stelle einbeziehen.
Unter Medizingeräten versteht man meist „physische“ programmierbare elektrische medizinische Systeme (PEMS), also aktive Medizinprodukte. Standalone-Software wird nicht als Medizingerät klassifiziert.
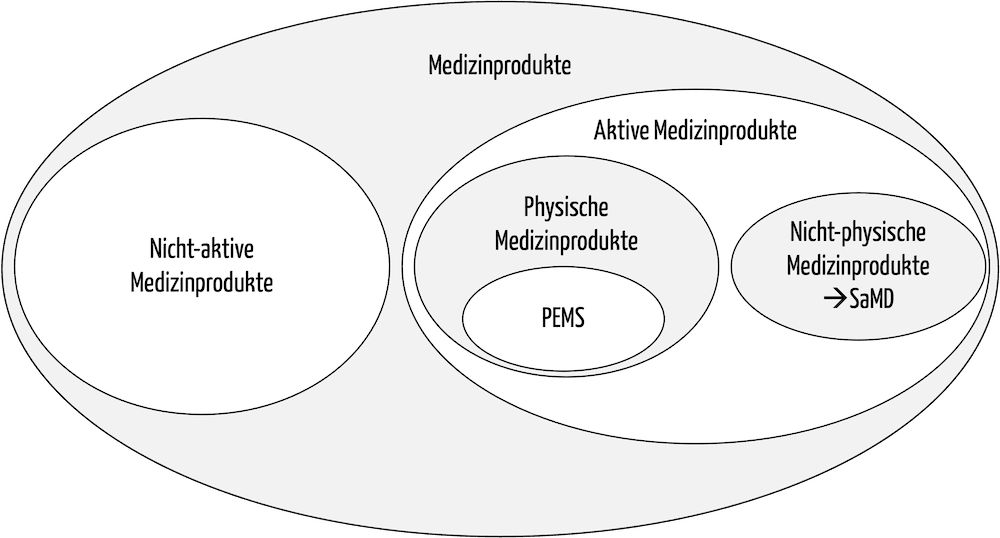
Abb. 1: In der Taxonomie der Medizinprodukte entsprechen die Medizingeräte physischen aktiven Medizinprodukten, insbesondere programmierbare elektrische medizinische Systeme (PEMS).
Der Begriff Medizintechnik wird manchmal synonym mit dem Begriff Medizingeräte genutzt. Manchmal meint man damit die Abteilung im Krankenhaus, die für die Medizingeräte zuständig ist.
Häufig gibt es Probleme mit der Zuordnung klinischer Informationssysteme. Diese sind oft Medizinprodukte, zählen aber nicht zur klassischen Medizintechnik.
b) Bedeutung der Medizintechnik
Die Medizintechnik ist ein bedeutender Wirtschaftsfaktor. Aktuelle Zahlen liefert beispielsweise BVMed.
Ein Fachartikel beleuchtet die Trends in der Medizintechnik. Zu diesen zählen Entwicklung und Einsatz von autonomen Systemen und Closed-Loop-Systemen.
2. Regulatorische Anforderungen an Medizingeräte
a) Anforderungen an die Hersteller
Da Medizingeräte eine Teilmenge der Medizinprodukte sind, gelten alle regulatorischen Anforderungen an Medizinprodukte auch für die Medizingeräte.
Weiterführende Informationen
Die Seite Regulatory Affairs listet alle Gesetze, Normen, Verordnungen und Leitlinien auf. In Europa sind besonders die MDR und das MPDG zu beachten.
Neben den grundlegenden Sicherheits- und Leistungsanforderungen sollten die Hersteller die Anforderungen an medizinisch-elektrische Geräte und die IEC 60601-Familie beachten. Dazu zählen neben den Anforderungen an die elektrische Sicherheit auch Anforderungen an die Interoperabilität, die wesentlichen Leistungsmerkmale und die funktionale Sicherheit.
b) Anforderungen an die Betreiber
Die Betreiber von Medizingeräten bzw. Medizintechnik unterliegen ebenfalls gesetzlichen Anforderungen, beispielsweise der MPBetreibV.
Eine Übersicht enthält der Schlagwortbeitrag zu den Krankenhäusern, Laboren und anderen Betreibern. Dieser verweist auf die Vorgaben zur Installation, Wartung und Außerbetriebnahme von Medizinprodukten. Er geht auch auf bestimmte Produkttypen ein, z. B. Kombinationen von Medizinprodukten, Produkte mit Mehrfachsteckdosen und Medizinprodukte-PCs.
Unterstützung
Haben Sie noch Fragen zur Entwicklung oder zum Betrieb von Medizingeräten? Qualifizierte und zudem kostenlose Antworten erhalten Sie im Micro-Consulting.
Melden Sie sich gleich, wenn Sie Unterstützung wünschen, um Ihre Medizingeräte schnell und sicher zu entwickeln und zuzulassen.
Medizinprodukte über das Ende der Lebensdauer hinaus zu betreiben kann gefährlich und rechtlich problematisch sein. Daher sollten Hersteller die genaue Lebensdauer bei jedem Produkt präzise bestimmen. Doch könnten Sie auf die Schnelle sagen, wie Lebensdauer definiert oder nach welchen Kriterien sie bestimmt wird? Verwandte Begriffe wie „Nutzungsdauer“, “Haltbarkeit”, “Betriebszeit” bzw. „Service Life“ und „Shelf Life“…
Details
Die Begriffe Wartung, Instandhaltung, Instandsetzung, Inspektion, Service und sicherheitstechnische Kontrolle sind nicht synonym. Aber alle bezeichnen Aktivitäten im Lebenszyklus von Medizinprodukten, die dem Ziel dienen, die Sicherheit, Leistungsfähigkeit und Wirksamkeit dieser Produkte auch nach der Inverkehrbringung zu gewährleisten. Hersteller und Betreiber müssen die regulatorischen Anforderungen an die Wartung bzw. Instandhaltung erfüllen. Diese Vorgaben sind oft…
Details
Der Medizintechnik-Markt ist zwar weniger volatil als andere Branchen, aber auch er steht vor einer Umwälzung, auf die nicht alle optimal vorbereitet sind. Wer die Trends in der Medizintechnik kennt, kann seine Karriere darauf einstellen und die Aus- und Weiterbildung daraufhin optimieren. Trends in der Medizintechnik a) Trends, auf die sich Mitarbeitende und Hersteller einstellen sollten In den letzten Jahren…
Details
Für Geräte, die WLAN oder RFID nutzen, gilt die Richtlinie 2014/53/EU (Funkanlagen-Richtlinie bzw. Radio Equipment Directive, RED). Auch Medizinprodukte, die „funken“, etwa weil sie sich mit dem Internet verbinden oder über eine Fernbedienung angesteuert werden, müssen die Konformität mit der RED nachweisen, bevor sie auf den Markt dürfen. Erfahren Sie in diesem Beitrag,
Details
Phantome in der Medizintechnik helfen, Medizinprodukte schneller und wirkungsvoller zu validieren, „zuzulassen“ und in den Märkten zu überwachen. Dieser Artikel beschreibt, welche Organisationen besonders vom Einsatz dieser Phantome profitieren und welche Voraussetzungen sie dafür erfüllen müssen.
Details
Der Begriff „Medizinprodukte-PC“ ist nicht eindeutig definiert. Allerdings verstehen unter einem Medizinprodukte-PC die meisten Abhängig von den Konstellationen müssen die Hersteller unterschiedliche regulatorische Anforderungen erfüllen. Diese werden im vorliegenden Artikel vorgestellt.
Details
Im Mai 2016 wurde die deutsche Ausgabe der IEC 60601-1-2:2014 (Edition 4) als DIN EN 60601-1-2:2016 mit dem Titel Elektromagnetische Störgrößen – Anforderungen und Prüfungen veröffentlicht. Ende 2020 folgte die um das Amendment 1 (AMD 1) ergänzte und als Edition 4.1 bezeichnete Ausgabe dieser „EMV-Norm“.
Details
Die Maschinenrichtlinie (2006/42/EG) ist allgemein auf Maschinen aller Art anwendbar. Doch auch für die Hersteller von Medizinprodukten kann die Richtlinie relevant sein: Sowohl die MDR als auch die IVDR verweisen auf sie.
Die Norm IEC 60601-1-11 ist eine Ergänzungsnorm zur IEC 60601-1. Sie legt Anforderungen an Medizinprodukte fest, die in einer häuslichen Umgebung verwendet werden. Die Norm trägt den Titel “Medical electrical equipment Part 1-11: General requirements for basic safety and essential performance Collateral Standard: Requirements for medical electrical equipment and medical electrical systems used in the…
Details
Die IEC 60601-1-8 ist eine Ergänzungsnorm zu der IEC 60601-1, der Norm mit den allgemeinen Festlegungen. Die IEC 60601-1-8 legt Anforderungen an Alarmsysteme sowie an deren Dokumentation und Prüfung fest. Damit gibt sie den Herstellern konkrete Handlungsleitungen bei der Spezifikation und beim Entwurf ihrer Medizinprodukte. Allerdings müssen die Hersteller sicher mit der Vielzahl der Begriffe…
Details



