Als Medizintechnik versteht man eine Untermenge der Medizinprodukte, die auch als Medizingeräte bezeichnet wird. Gleichzeitig bildet die Medizintechnik eine organisatorische Einheit in Krankenhäusern.
Inhalt
Diese Seite verschafft Herstellern und Betreibern von Medizintechnik bzw. Medizingeräten einen schnellen Überblick über die
- Medizintechnik / Medizingeräte selbst,
- regulatorischen Anforderungen an die Medizintechnik und
- Unterstützung beim Einhalten dieser Anforderungen.
1. Überblick über die Medizintechnik / Medizingeräte
a) Begriffe und Taxonomie
Der Begriff Medizinprodukt stellt den Überbegriff für viele Produktkategorien dar. Man unterscheidet beispielsweise:
- Aktive und nicht aktive Medizinprodukte: Aktive Medizinprodukte sind solche, die eine Energieversorgung haben, in der Regel in Form eines Netzanschlusses oder einer Batterie bzw. eines Akkus.
- Medizinprodukte mit und ohne Messfunktion: Auch bei Produkten mit Messfunktion müssen die Hersteller bei der Konformitätsbewertung eine Benannte Stelle einbeziehen.
Unter Medizingeräten versteht man meist „physische“ programmierbare elektrische medizinische Systeme (PEMS), also aktive Medizinprodukte. Standalone-Software wird nicht als Medizingerät klassifiziert.
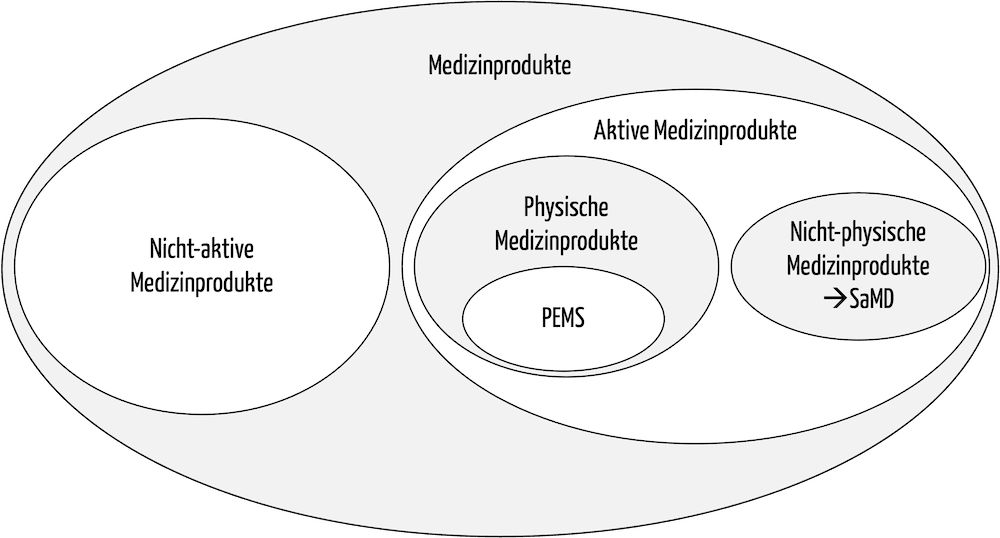
Abb. 1: In der Taxonomie der Medizinprodukte entsprechen die Medizingeräte physischen aktiven Medizinprodukten, insbesondere programmierbare elektrische medizinische Systeme (PEMS).
Der Begriff Medizintechnik wird manchmal synonym mit dem Begriff Medizingeräte genutzt. Manchmal meint man damit die Abteilung im Krankenhaus, die für die Medizingeräte zuständig ist.
Häufig gibt es Probleme mit der Zuordnung klinischer Informationssysteme. Diese sind oft Medizinprodukte, zählen aber nicht zur klassischen Medizintechnik.
b) Bedeutung der Medizintechnik
Die Medizintechnik ist ein bedeutender Wirtschaftsfaktor. Aktuelle Zahlen liefert beispielsweise BVMed.
Ein Fachartikel beleuchtet die Trends in der Medizintechnik. Zu diesen zählen Entwicklung und Einsatz von autonomen Systemen und Closed-Loop-Systemen.
2. Regulatorische Anforderungen an Medizingeräte
a) Anforderungen an die Hersteller
Da Medizingeräte eine Teilmenge der Medizinprodukte sind, gelten alle regulatorischen Anforderungen an Medizinprodukte auch für die Medizingeräte.
Weiterführende Informationen
Die Seite Regulatory Affairs listet alle Gesetze, Normen, Verordnungen und Leitlinien auf. In Europa sind besonders die MDR und das MPDG zu beachten.
Neben den grundlegenden Sicherheits- und Leistungsanforderungen sollten die Hersteller die Anforderungen an medizinisch-elektrische Geräte und die IEC 60601-Familie beachten. Dazu zählen neben den Anforderungen an die elektrische Sicherheit auch Anforderungen an die Interoperabilität, die wesentlichen Leistungsmerkmale und die funktionale Sicherheit.
b) Anforderungen an die Betreiber
Die Betreiber von Medizingeräten bzw. Medizintechnik unterliegen ebenfalls gesetzlichen Anforderungen, beispielsweise der MPBetreibV.
Eine Übersicht enthält der Schlagwortbeitrag zu den Krankenhäusern, Laboren und anderen Betreibern. Dieser verweist auf die Vorgaben zur Installation, Wartung und Außerbetriebnahme von Medizinprodukten. Er geht auch auf bestimmte Produkttypen ein, z. B. Kombinationen von Medizinprodukten, Produkte mit Mehrfachsteckdosen und Medizinprodukte-PCs.
Unterstützung
Haben Sie noch Fragen zur Entwicklung oder zum Betrieb von Medizingeräten? Qualifizierte und zudem kostenlose Antworten erhalten Sie im Micro-Consulting.
Melden Sie sich gleich, wenn Sie Unterstützung wünschen, um Ihre Medizingeräte schnell und sicher zu entwickeln und zuzulassen.
Die IEC 60601-1 definiert wesentliche Leistungsmerkmale als Leistungsmerkmale, die erforderlich sind, um Freiheit von unvertretbaren Risiken zu erreichen. Dieser Artikel soll klären, was die Norm damit meint und wie sich diese wesentlichen Leistungsmerkmale von der Basissicherheit abgrenzen. Der Beitrag geht auch auf das IEC 60601-1/AMD1/ISH1:2021 INTERPRETATION SHEET 1 ein.
Details
Das Recycling und die Entsorgung von Medizinprodukten überlassen viele Hersteller den Betreibern, z.B. den Krankenhäusern. Dabei bietet diese letzte Phase des Produktlebenszyklus den Herstellern neue Möglichkeiten: von der Differenzierung über Kosteneinsparungen bis hin zu neuen Geschäftsmodellen. An neuen Konzepten sind auch die Krankenhäuser interessiert, die durch die anhaltende Pandemie ökonomisch unter Druck stehen und zudem…
Details
Zunehmend finden autonome Systeme auch in der Medizin Verwendung. Zu diesen autonomen Systemen zählen einzelne Medizinprodukte wie OP-Roboter. Aber auch Kombinationen einzelner (Medizin-)Produkte bilden autonome Systeme. Vielen Medizinprodukteherstellern und Krankenhäusern ist nicht klar,
Details
Wie geplant liegt für das das 2. Amendment zur IEC 60601-1 ein erster Committee Draft for Vote (CDV) vor. Es nennt sich auch IEC 60601-1 A2:2019. Wir haben für Sie die wichtigsten der insgesamt 78 Änderungen zusammengefasst, damit Sie abschätzen können, ob Sie die Zeit für das Lesen und die ca. 35 Euro investieren möchten,…
Details
Dass Mehrfachsteckdosen auch bei Medizinprodukten in der täglichen Praxis benötigt werden, liegt auf der Hand. Doch welche regulatorischen Konsequenzen sich ergeben, wenn man Mehrfachsteckdosen verwendet, ist vielen nicht klar. Dieser Artikel verschafft Ihnen den notwendigen Überblick darüber, welche Risiken dadurch entstehen, wie Sie diese Risiken identifizieren, analysieren und vermeiden können, welche regulatorischen Anforderungen Sie dabei…
Details
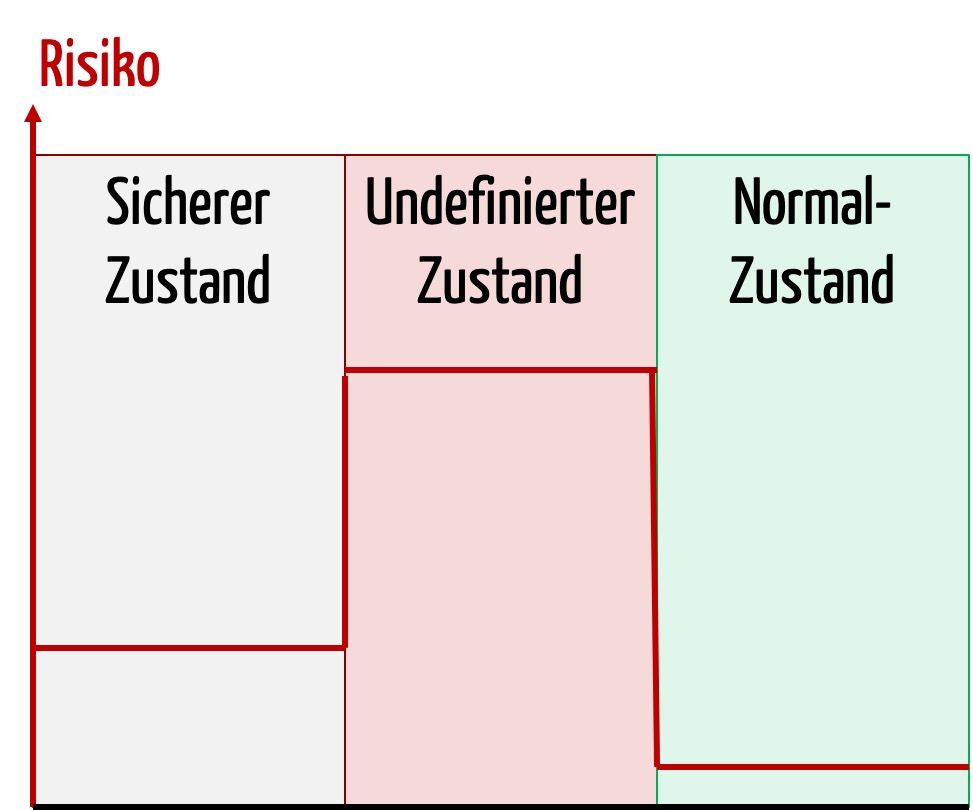
Ein sicherer Zustand wird von der IEC 60601-1 als eine mögliche Maßnahme gefordert. Was ein sicherer Zustand ist, definiert die Norm allerdings nicht. Was ist also ein sicherer Zustand? Antworten auf diese Frage und Tipps, wie Sie einen sicheren Zustand Ihres Medizinprodukts erreichen, finden Sie in diesem Artikel.
Details
Mit zunehmender Vernetzung von Medizinprodukten stehen Sie immer häufiger vor der Frage, was das Medizinprodukt ist und ob Sie besser das „ganze System“ d.h. die Kombination von Medizinprodukten oder lieber die Komponenten einzeln als Medizinprodukt in Verkehr bringen sollen.
Die IEC 61010-2-101 ist eine für In-vitro-Diagnostik (IVD) harmonisierte Norm. IVD-Hersteller können die IEC 61010 nutzen, um die Konformität mit den grundlegenden Sicherheit- und Leistungsanforderungen der IVD-Verordnung (IVDR) nachzuweisen.
Wann zählt ein PC zur Medical IT, wann als Medizinprodukt? Die Antwort auf diese Fragen hat weitgehende regulatorische Konsequenzen.
MOPP, MOOP und MOP: Die Norm für medizinische elektrische Geräte IEC 60601-1 benutzt diese Akronyme für „Means of Patient Protection“, „Means of Operator Protection“ und „Means of Protection“. Was es mit diesen zentralen Begriffen der Norm auf sich hat und welche Anforderungen mit ihnen verbunden sind, erfahren Sie in diesem Artikel.